超声内镜结合LCI/BLI-ME判断根除幽门螺杆菌后早期胃癌浸润深度的研究*
周晓黎, 舒 磊, 杨 林, 杨 健, 廖 艳, 时昭红
武汉市第一医院消化内科,武汉 430022
根除幽门螺杆菌后胃癌是指根除幽门螺杆菌(Helicobacterpylori,H.pylori)1年以上被发现的胃癌,包括根除幽门螺杆菌后发生的胃癌和根除幽门螺杆菌前发生的、但是在根除幽门螺杆菌后被发现的胃癌[1]。多项指南[2-3]指出对于病变大小和部位适合整块切除的早期胃癌(early gastric cancer,EGC)患者接受内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)后的生存率不低于外科手术,术后生活质量却明显提高[4]。根除幽门螺杆菌后发现的早期胃癌具有不同于周围黏膜的微结构,但规整性缺失不明显的内镜特征。因此,在根除幽门螺杆菌的黏膜背景下发现与诊断早期胃癌是一项具有挑战性的工作,且对于根除幽门螺杆菌后早期胃癌浸润深度的判断需要更多临床经验的积累,为获得及早治疗的时机和治疗方式的选择提供依据。
本文旨在通过回顾性分析病例的方法研究超声内镜(endoscopic ultrasound,EUS)结合联动成像技术(linked color imaging,LCI)/蓝激光成像技术(blue laser imaging,BLI)放大内镜(magnifying endoscopy,ME)判断根除幽门螺杆菌后早期胃癌浸润深度的准确性及其影响因素。
1 资料和方法
1.1 一般资料
选取2017年10月至2023年6月于武汉市第一医院就诊且资料完整的根除幽门螺杆菌后早期胃癌患者91例,其中5例患者同时存在两处病变,共计96处病灶。纳入标准:①患者1年前经H.pylori根除治疗,经13C-UBT或14C-UBT检测结果为阴性。②术前均行超声内镜及联动成像技术/蓝激光成像技术-放大内镜(LCI/BLI-ME)检查,评估病变浸润深度。③患者接受内镜黏膜下剥离术或外科手术治疗,以术后病理学检查为判断标准。
1.2 主要器材
日本富士能(FUJINON)VP-7000主机、LASEREO激光内窥镜系统;日本Olympus公司EG-760Z、CV-290主机和GIf-H260、GIF-Q290内镜,EU-ME2(探头频率5~20 MHz),黑帽(MAJ-1990)。
1.3 方法
1.3.1 LCI/BLI-ME检查 固定黑帽后白光内镜检查模式进镜至十二指肠降部,切换LCI模式退镜观察。通过黏膜色泽对比强化,如果呈现出紫、红、黄不规则混合颜色的区域,则考虑癌性病变。进一步结合BLI-ME模式观察,对可疑病灶使用BLI-bright、BLI模式进行低倍、高倍放大观察,通过对病变区域是否有明显的边界线(boundary line,DL)、黏膜微血管(microvascular pattern,MV)和(或)表面微结构(microsurface pattern surface,MS)与周围黏膜的异同,判断是否为早期胃癌[5]。
1.3.2 EUS检查超声探头频率 选用5~20 MHz。正常胃壁EUS图像从内向外可分为5层,依次为:黏膜与水界面的反射波及黏膜浅层、黏膜肌层、黏膜下层、固有肌层、浆膜层[6]。EUS扫查中,若病变侵犯第1~2层且第3层高回声线连续完整,判定病灶浸润深度为uT1a,对应病理组织学分期pT1a。若第3层高回声线出现中断、呈楔形改变或拱形隆起改变,第4层低回声线连续完整,判定病灶浸润深度为uT1b,对应病理组织学分期pT1b[7]。
1.4 病理学检查分期
所有病例均行内镜黏膜下剥离术治疗或手术治疗,进行组织病理学检查,以术后组织病理学检查分期为判断标准,确定病变浸润深度。
1.5 观察指标
收集患者的临床资料,包括患者的性别、年龄、早期胃癌病灶发生的部位、大小、超声内镜的诊断结果,术后病理组织学报告等。统计早期胃癌发生的部位依照日本第13版《胃癌处理规约》(1999年)分别以U、M、L代替胃的上、中、下三区,超声诊断分别为病灶浸及黏膜层、黏膜下层,分别统计出病灶例数。
1.6 统计学方法
使用SPSS 21.0软件对数据进行统计学分析,计数资料采用χ2检验,率的比较和单因素分析采用χ2检验,多因素分析采用Logistic回归。以P<0.05为差异具有统计学意义。诊断效能的统计学描述采用灵敏度、特异度、准确度表示;超声内镜的诊断结果与术后病理学检查结果进行一致性检验,计算Kappa值。一致性结果分为5级:0.81~1.0为良好,0.61~0.80为较好,0.41~0.60为中等,0.21~0.40为一般,0~0.20为极低。
2 结果
2.1 患者的基本资料
本次研究根据纳入及排除标准,共纳入符合要求的临床病例91例,其中男性例数为54例(59.34%),女性例数为37例(40.66%),所有患者的平均年龄为(61.5±10.7)岁。5例患者均有2处早癌病灶,共计病灶96处。
2.2 根除幽门螺杆菌后胃黏膜在内镜下的特征性表现
幽门螺杆菌根除后胃黏膜非活动性急性炎症消退,黏膜发红肿胀趋于缓和,胃窦部多有肠化生表现,多呈地图样发红改变(图1A1),LCI观察胃窦部黏膜色泽对比度明显,呈现紫红色地图状改变(图1A2),BLI观察胃窦部地图样病灶呈现茶色改变(图1A3)。在胃体大弯侧可见点状发红改变(图1B1),LCI观察胃窦体交界处萎缩界限较模糊,较白光更显色泽上的差异(图1B2),BLI观察胃体部可见茶色背景黏膜(图1B3),均为根除幽门螺杆菌后胃黏膜在内镜下的特征性表现。
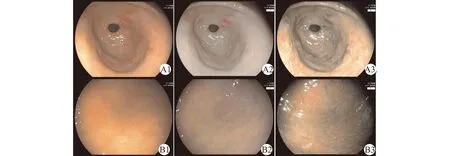
A1:白光内镜下胃窦部呈地图状发红改变;A2:LCI观察胃窦黏膜色泽对比度明显,呈现紫红色地图状改变;A3:BLI观察胃窦部地图样病灶呈现茶色改变;B1:白光内镜下胃体部充气后皱襞展平,可见点状发红;B2:LCI观察胃窦体交界处萎缩界限较模糊,较白光更显色泽上的差异;B3:BLI观察胃体部可见茶色背景黏膜
2.3 根除幽门螺杆菌后早期胃癌在LCI/BLI-ME下的特征性表现
本研究显示根除幽门螺杆菌后早期胃癌病灶在胃M区多见,共有43处,占44.8%;3 cm以内病灶共80处,占83.3%,多呈现斑片状发红或地图样发红。根除幽门螺杆菌后胃黏膜在内镜下具有特征性的表现。如图为一例白光内镜下肉眼观察到的混合型(表面隆起型并表面凹陷型,0-Ⅱa+Ⅱc)颜色发红的病灶(图2A),在LCI模式下呈现“紫包黄”改变(图2B),这是存在于黏膜表层且伴有扩张的肿瘤病灶表现,与周围组织分界线(DL)不清晰是根除幽门螺杆菌后的黏膜背景表现。BLI-bright观察病灶呈茶褐色改变,可见白区的增宽(图2C),BLI弱放大观察病灶呈茶褐色改变,黄色线为DL,可见腺管结构的紊乱(图2D),BLI中放大观察病灶呈茶褐色改变,可见蓝色标不规则表面微结构(IMSP)及红色标不规则表面微血管(IMVP),白色标为白球征(white globe appearance,WGA),为肿瘤病变的特异性内镜图像(图2E),BLI强放大观察病灶中央结构完全消失,其中掺杂扭曲的MV(图2F)。

A:白光观察病灶呈0-Ⅱa+Ⅱc改变,表面略发红;B:LCI观察病灶呈“紫包黄”改变,黄色线为DL,发红,DL显示不清;C:BLI-bright观察病灶呈茶褐色改变,黄色线为DL,可见白区的增宽;D:BLI弱放大观察病灶呈茶褐色改变,黄色线为DL,可见腺管结构的紊乱;E:BLI中放大观察病灶呈茶褐色改变,可见蓝色标IMSP及红色标IMVP,白色标为WGA,为肿瘤病变的特异性内镜图像;F:BLI强放大观察病灶中央结构完全消失,其中掺杂扭曲的MV
2.4 EUS结合LCI/BLI-ME诊断HP根除后早期胃癌浸润深度准确性术前评估与术后病理吻合情况对照
本组统计数据显示,与术后病理组织学检查结果相比较,EUS结合LCI/BLI-ME对根除幽门螺杆菌后早期胃癌浸润深度判断的总体准确率为77.08%,uT1a期及uT1b期的判断准确率分别为82.86%和61.53%。分期不足12例,占17.14%;分期过度10例,占38.46%。对黏膜层病变判断的诊断敏感度85.29%,诊断特异度57.14%,阳性预测值82.86%,阴性预测值61.5%。Kappa值0.43。提示对uT1a期的诊断准确率较高。见表1。

表1 EUS对根除幽门螺杆菌后早期胃癌浸润深度的术前评估和术后病理结果对照(例)Table 1 Comparison of preoperative and postoperative pathological results of the invasion depth in early gastric cancer after Helicobacter pylori eradication detected by EUS(n)
2.5 EUS结合LCI/BLI-ME诊断根除幽门螺杆菌后早期胃癌浸润深度准确性影响因素的分析
单因素分析显示,病灶发生在胃上1/3区(U区)有17例,其中12例与术后病理吻合;胃下1/3区(L区)36例,其中29例与术后病理吻合;胃中1/3区(M区)43例,其中35例与术后病理吻合。隆起型病灶17例,其中12例与术后病理吻合;平坦型病灶28例,其中20例与术后病理吻合;凹陷型病灶13例,其中8例与术后病理吻合;混合型病灶38例,其中32例与术后病理吻合。病灶≤3 cm的病例70例,其中60例与术后病理吻合;病灶大于3 cm的病例26例,其中14例与术后病理吻合。中高分化程度的病灶80例,其中68例与术后病理吻合;低分化程度的病灶16例,其中6例与术后病理吻合。见表2。
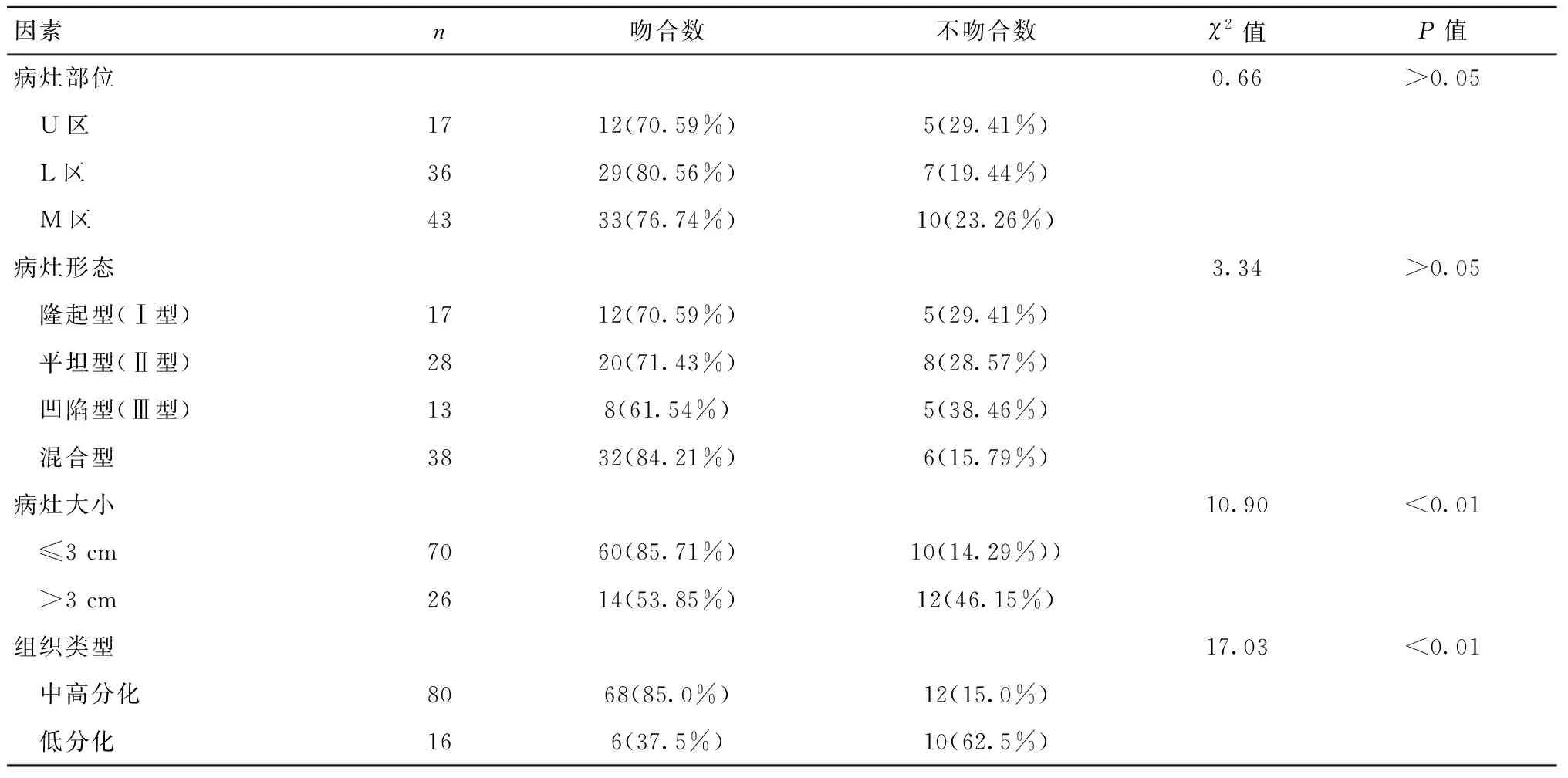
表2 EUS对根除幽门螺杆菌后早期胃癌浸润深度的术前评估和术后病理吻合率的单因素分析[n(%)]Table 2 Univariant analysis of preoperative infiltration depth and postoperative pathological anastomosis rate of early gastric cancer after Helicobacter pylori eradication detected by EUS[n(%)]
多因素分析显示病灶大小、组织分化类型与诊断准确性有相关性(均P<0.01),病灶越大,EUS诊断准确性越低;组织分化类型越高,EUS诊断准确性越高(表3)。而病灶部位、病灶形态与EUS诊断准确性无相关性(均P>0.05)。代表性病例为一名63岁男性,在白光内镜下见一表面平坦型(0-Ⅱb)发红病灶,病变边界欠清晰(图3A),LCI观察病灶中央呈现典型的“紫包黄”的改变(图3B),BLI-bright近距离观察病灶,病灶呈茶褐色改变、DL(+)(图3C),BLI弱放大观察可见MV扭曲、紊乱及IMVP(图3D)。BLI强放大观察可见IMSP,MS呈微小乳头样分布(图3E)。EUS显示病变浸润至黏膜肌层,黏膜层及黏膜肌层层次模糊、增厚,厚约4.5 mm(图3F)。经ESD获得术后完整病理标本(图3G),病理检查结果示:(胃)中分化腺癌,浸润深度为黏膜肌层,黏膜下层完整,脉管侵犯(-),水平切缘(-),垂直切缘(-)(图3H)。此例患者的术前超声内镜诊断与术后病理报告结果一致。
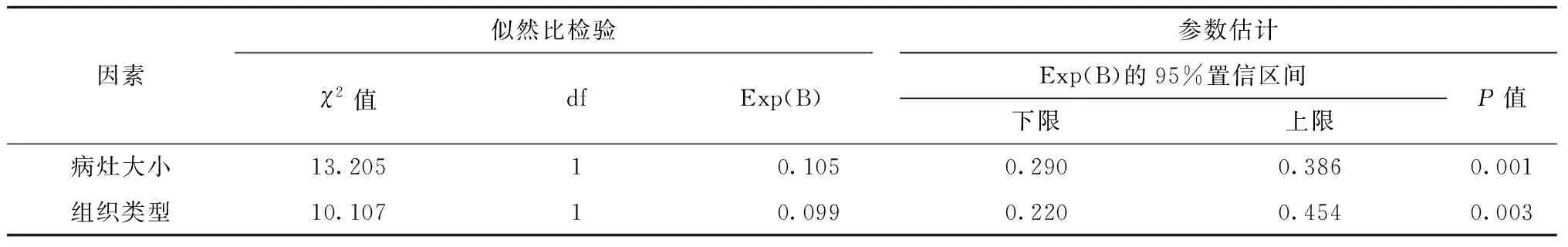
表3 影响术前评估和术后病理吻合率的多因素分析[n(%)]Table 3 Multivariant analysis of preoperative assessment and postoperative pathological anastomosis rate[n(%)]

A:白光下病灶呈0-Ⅱb表现,边界欠清晰,为发红病变;黄线为DL(±);B:LCI观察病灶的色泽差别更加明显,病灶中央呈现典型的“紫包黄”的改变;C:BLI-bright近距离观察病灶,病灶呈茶褐色改变,DL(+);D:BLI弱放大观察黄线为DL,MV扭曲、紊乱,蓝标为IMVP;E:BLI强放大观察黄线为DL,红标为IMSP,MS呈微小乳头样分布;F:EUS显示病变浸润至黏膜肌层,黏膜层及黏膜肌层层次模糊、增厚,厚约4.5 mm;G:ESD术后标本(白光-LCI-BLI-水下);H:病理结果为(胃)中分化腺癌,浸润深度为黏膜肌层,黏膜下层完整,脉管侵犯(-),水平切缘(-),垂直切缘(-)
3 讨论
2020年统计数据显示全世界新增胃癌发病人数为109万,死于胃癌的人数高达77万[8]。H.pylori是胃癌第一大致癌因素,根除H.pylori能减少胃癌的发生,但一部分患者即使在去除H.pylori这一始动因素后仍不可逆地发展成胃癌。有报道显示成功根除H.pylori胃癌的发病率达每年0.24%[9],胃早癌切除后的患者在根除H.pylori后异时性胃癌的发生率有2.3%~9.8%[10-11]。近几十年来H.pylori根除治疗患者数量增加,此类人群发生胃癌的数目也相应增加,早诊断早治疗对降低此类患者的病死率有重要意义。
根除H.pylori后胃癌并不具有独立的组织病理学形态,只是在常规癌特征基础上出现一些变化。在根除H.pylori的病例中,判断一个病变是否为早期胃癌,首先要观察病变发生的背景有没有萎缩。特别是在胃体高度萎缩的情况下,必须注意色调(黏膜发红)和凹凸变化。经过根除H.pylori后,早期胃癌在内镜下会出现平坦化改变:隆起型癌的隆起变低平、凹陷性病变变平坦、癌和周围黏膜的边界变得不清晰、放大内镜下微结构异质性不足等等,因此也会导致漏诊(没有发现)或诊断不足(误判为非癌)。因此,辨识根除H.pylori后的背景黏膜,及早发现早期胃癌病灶,通过EUS诊断病灶的浸润深度,对获取治疗机会及选择治疗方式具有重要的意义。
本研究显示根除H.pylori后胃癌的总体特点:M区为主,小于3 cm的病灶多见,病灶呈“胃炎样”表面微结构,可为多个病灶。BLI-ME显示根除H.pylori后早期胃癌局部边界不清,微结构有异质性,但差别较小,尤其是平坦型病变(Ⅱb)在普通白光内镜下缺乏特异性表现,难以被识别。根除H.pylori后胃癌的表现为病灶凹陷性发红,有以下几种可能原因:一方面根除H.pylori后胃黏膜弥漫性红斑消失,胃癌病灶相对发红;另一方面凹陷性变化多有可能是胃泌素引起的胃癌增殖信号变化的原因之一[12],胃黏膜表层出现难以判断的低异型度癌或非癌腺管的上皮。因此对红色平坦、凹陷病变不要轻易诊断为单纯的黏膜发红、糜烂;要注意观察其大小、高低差、红色的改变。LCI在中远距离的早期胃癌病灶筛查中具有优势,LCI增强红、白、黄、蓝的颜色色调,增强色差的同时提高了亮度,更容易发现病变。BLI-ME弱放大可显示病灶的边界,BLI-ME满倍率放大可进一步观察MV及MS,判断病灶的性质,从而提高精查效率。
2021年早期胃癌内镜下治疗指南指出[13],病灶的浸润深度是确定早期胃癌是否具有ESD术适应证的最重要的依据之一。EUS融合了内镜和超声的双重诊断功能,能清晰识别胃壁的层次结构,以此来对局部的组织结构特点进行识别,区分出黏膜层和黏膜下层,同时显示局部的邻近器官,是目前胃肠道肿瘤局部分期最精确的内镜检查方法[14]。目前国内外报道显示EUS判断早期胃癌浸润深度的准确性具有一定差异,但总体准确率在61.67%~89.86%[15-16]。徐瑶等[17]研究报道超声内镜对早期胃癌浸润深度诊断的总体准确率为74.1%,对黏膜层诊断的灵敏度、特异度、阳性预测值及阴性预测值分别为74.8%、66.7%、95.9%和20.4%。多因素分析发现黏膜凹陷是影响超声内镜诊断准确性的独立危险因素(P<0.05)。一项Meta分析[18]指出EUS对EGC黏膜层诊断的敏感度、特异度分别为76%~86%和72%~73%。王炘等[19]研究显示,EUS对EGC浸润深度诊断的总体准确率为74.3%,低估率为8.6%,过判率为17.1%。本研究中EUS联合LCI/BLI-ME对根除幽门螺杆菌后早期胃癌浸润深度判断的总体准确率为77.08%,对uT1a期及uT1b期的判断准确率分别为82.86%和61.53%。结果显示对根除幽门螺杆菌后早期胃癌浸润深度判断的总体准确率与报道相一致,对uT1a期的诊断敏感度较高。
本研究中,对于不同部位的病灶EUS诊断准确率分别为U区70.59%、L区80.56%、M区76.74%,差异无统计学意义。对于不同形态的病灶准确率分别为隆起型70.59%、平坦型71.43%、凹陷型61.54%,混合型84.21%,差异无统计学意义。该结果可能是因为本研究首先通过LCI/BLI-ME对病灶进行精确的定位观察,为EUS提供了靶向操作的机会,超声探头放置的准确性更高,减少了检查部位与病灶形态造成的误差。≤3 cm与>3 cm病变EUS的准确率分别为85.71%和53.85%,差异有统计学意义。病变直径小的EUS诊断准确率较高,与张秀静等[20]研究的结果相近。中高分化病变和低分化病变的EUS判断准确率分别为85%和37.5%,分化程度高的EUS诊断准确率较高,差异有统计学意义。研究考虑分化程度低的病变易出现微浸润灶,导致浸润深度被低估[21-22]。
本研究结果显示超声内镜结合LCI/BLI-ME对根除H.pylori后早期胃癌的浸润深度诊断与病理检查结果一致性较好,为此类患者合理制订治疗策略提供了重要依据,具有一定的临床应用价值。由于客观条件限制,本研究选取病例时剔除了部分未行EUS检查的患者,有可能导致选择偏倚,因此需要更多的内镜中心及临床病例来进一步研究。

