列线图预测肝癌肺转移患者的总体和癌症特异性生存率:一项回顾性队列研究*
冯锦城, 李 民, 熊 俊△
华中科技大学同济医学院附属协和医院 1肝脏移植中心 2肝胆外科,武汉 430022
肝细胞癌是全球第四大常见癌症相关死亡原因和第六大常见恶性肿瘤[1]。尽管肝癌的早期诊断和治疗有助于提高患者生存率,但由于肝内复发和肝外转移的风险高,肝癌患者的长期生存率仍然较差[2-5]。肺是肝外转移的最常见部位,发生率在39.5%至55%之间[6-8]。一项基于人群的研究表明,在转移性肝癌患者中,36.2%的患者发生了肺转移[9]。有研究表明,过表达AEG-1基因可促进肝癌细胞生长以及定向肺转移,沉默AEG-1基因抑制肝癌细胞生长及定向肺转移[10]。尽管已有文献报道关于肝癌肺转移患者的生存率[11-12],但这些报道纳入的病例数相对较少,而且很少同时分析该疾病的总体生存率和癌症特异性生存率。列线图已被用于多种癌症的生存预后,并被认为是能够提供个性化生存预测的可靠工具[13-14]。鉴于癌症生存估计对于评估预后和改善癌症治疗很重要,在本研究中,我们使用美国国立癌症研究所的监测、流行病学、结果数据库(SEER)研究了2242名肝癌肺转移患者,以开发和验证列线图用于预测这类患者的总生存期和癌症特异性生存期。
1 资料与方法
1.1 一般资料
这项回顾性研究使用来自美国国立癌症研究所的监测、流行病学、结果数据库(SEER)(https://seer.cancer.gov)2010年至2016年的数据。SEER数据库由美国国家癌症研究所(National Cancer Institute,NCI)癌症控制和人口科学部(Division of Cancer Control and Population Sciences,DCCPS)的监视研究项目(Surveillance Research Program,SRP)提供支持。SEER计划提供涵盖28%的美国人口的综合人口统计和癌症统计信息。41361例18岁或以上的患者在2010年1月1日至2016年12月31日期间被诊断为肝细胞癌的病例,排除了具有一种以上原发癌的病例后,其中共有2242例初诊时出现肺转移。根据赫尔辛基宣言,这项研究不需要机构审查委员会的审查,因为SEER数据库是公开可用的,没有个人可识别的私人信息。所有患者数据都在SEER数据库中进行了去标识化处理,因此,也不需要知情同意。纳入标准:①患者年龄在18岁以上;②在诊断肝细胞癌时同步出现了肺转移;③所有患者均经病理学或者临床诊断为肝细胞癌。排除标准:有2种原发癌的患者。
1.2 统计学方法

2 结果
2.1 患者临床资料
2242例患者中,男性1781例(79.4%),女性461例(20.6%);年龄18~96岁,中位年龄为62岁。917例(40.9%)存在晚期T3或T4疾病。手术和化疗分别占病例的1.8%(41)和32.3%(725)(表1)。截止随访终点,2058例死亡,中位随访时间为2(0~81)月。癌症特异性死亡发生在1923/2242(85.8%)例中。1年总生存率和癌症特异性生存率分别为10.5%(95%CI:8.7%~12.7%)和11.8%(95%CI:9.8%~14.2%)(图1A)。接受和未接受化疗的病例其1年癌症特异性生存率分别为19.4%(95%CI:15.8%~23.8%)和6.1%(95%CI:4.2%~8.8%)(P<0.01,图1B)。接受肝切除手术的病例,1年癌症特异性生存率52.0%(95%CI:35.7%~75.8%),未接受手术的病例为10.6%(95%CI,8.7%~13.0%)(P<0.01;图1C)。
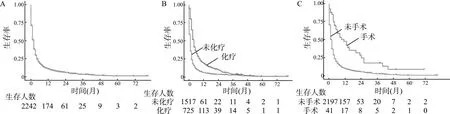
A:癌症特异性生存率的Kaplan-Meier曲线;B:按是否使用化疗分层;C:按是否进行手术分层,手术数据不全的病例已排除

表1 患者一般临床资料及癌症特异性生存率的单因素分析结果aTable 1 Patient characteristics and results of univariate analysis of CSSa
2.2 影响因素分析
单因素分析结果显示与更好的癌症特异性生存期相关因素包括女性、诊断时年龄较小、保险状态、小肿瘤(直径≤10 cm)、单发肿瘤、T1~T2、阴性AFP、使用化疗和接受手术(表1)。
在多变量生存分析中(表2),女性(相对于男性,风险比:0.809;95%CI:0.678~0.967,P=0.020)、投保状态(相对于未投保状态,风险比:0.721;95%CI:0.555~0.936,P=0.014)、化疗使用(对比未使用化疗,风险比:0.432;95%CI:0.372~0.500,P<0.01)和接受手术(对比未手术,风险比:0.456;95%CI:0.293~0.711,P=0.001)与更好的癌症特异性生存期显著相关。更高的肿瘤分期(T3与T1:风险比1.314,95%CI:1.032~1.673,P=0.027;T4与T1:风险比1.476,95%CI:1.158~1.881,P=0.002)和阳性AFP状态(与阴性AFP状态相比:风险比1.351,95%CI:1.081~1.689,P=0.008)与较差的癌症特异性生存期显著相关。

表2 癌症特异性生存率的多变量Cox比例风险模型aTable 2 Multivariable Cox proportional hazard model of cancer-specific survival a
在总生存期的多变量Cox回归模型中,投保状态、小肿瘤、T1~T2、AFP阴性、化疗使用和接受手术与总生存期改善显著相关(表3)。
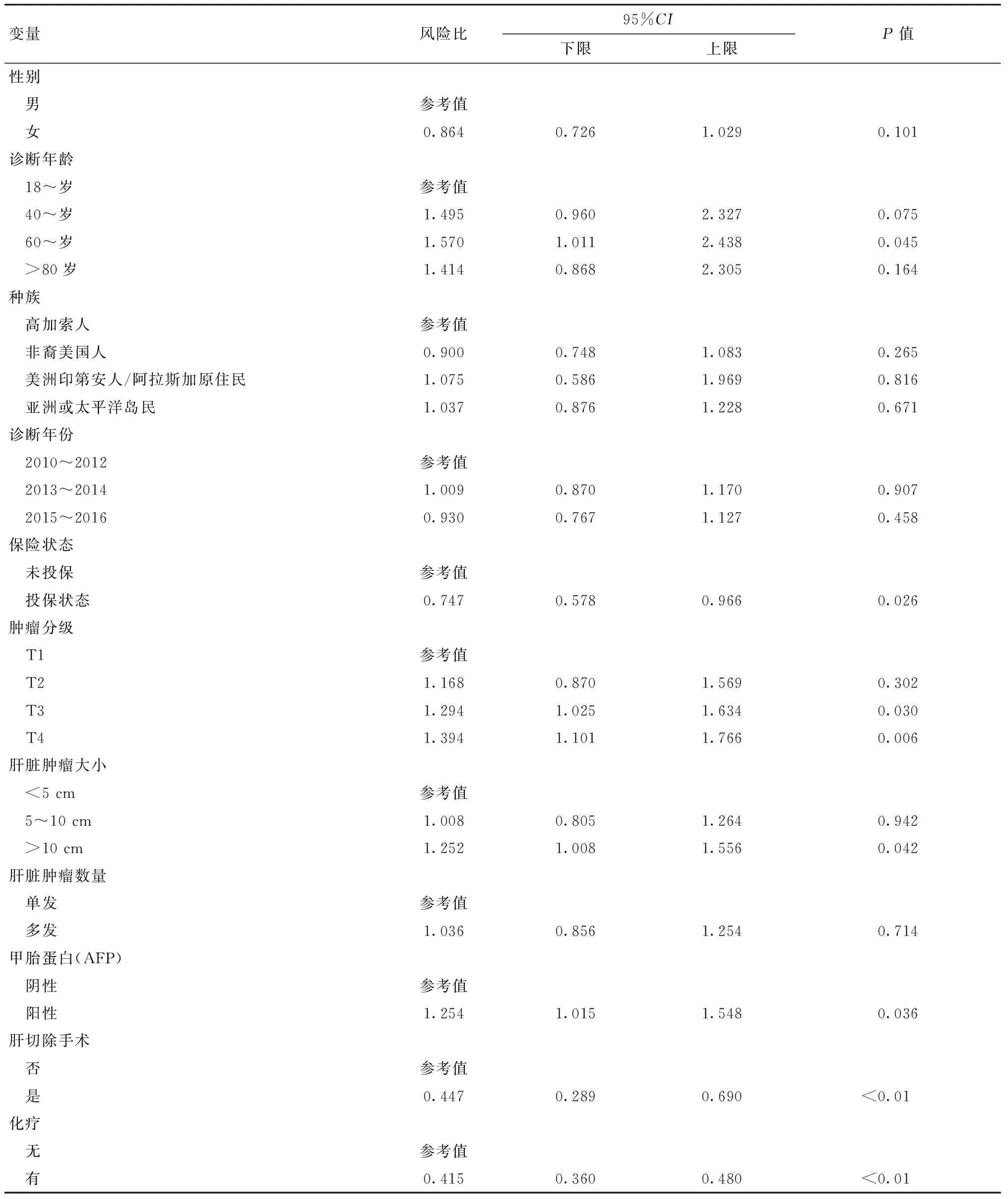
表3 总生存率的多变量Cox比例风险模型aTable 3 Multivariable Cox proportional hazards model of overall survival a
2.3 预测模型
影响总生存期和癌症特异性生存期的独立预测因子用于构建列线图(图2和图3),并采用Bootstrap方法对模型进行内部验证。

图2 预测1年总生存率的列线图Fig.2 A nomogram predicting 1-year overall survival
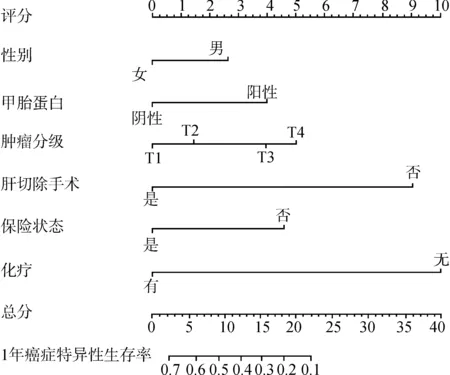
图3 预测1年癌症特异性生存率的列线图Fig.3 A nomogram predicting 1-year cancer-specific survival
结果表明列线图预测癌症特异性生存期有良好的准确性,其校正的C指数为0.71(95%CI:0.69~0.73),总生存期预测的C指数则为0.72(95%CI:0.70~0.74)。校准曲线也显示实际生存概率和预测生存概率之间具有良好的一致性(图4)。

图4 预测1年总生存率(A)和癌症特异性生存率(B)的校准曲线Fig.4 The calibration curves for predicting 1-year OS(A)and CSS(B)
3 讨论
肝癌患者发生肺转移在临床工作中并非罕见,但相关研究较少。鉴于SEER数据库已被广泛用于临床研究[15-16],本研究分析了来自SEER数据库的2242例肝癌肺转移患者,发现肝癌肺转移患者的1年总生存率约10%,这与之前报道的结果一致[9,17]。我们建立了两个列线图来预测该疾病患者的总生存期和癌症特异性生存期,结果显示预测总生存期和癌症特异性生存期的列线图的校正C指数分别为0.72和0.71。
肝癌肺转移患者的中位总生存期时间为2个月,这一结果短于已发表的研究中肝癌肺转移患者的4.5个月[11]。这可能部分是因为这项已发表的小样本研究仅包括接受肝内治疗的患者,而本研究纳入的为有或没有治疗的初始肺转移的肝癌患者。在本研究中,多变量生存分析表明,投保状态、小肿瘤、肿瘤T1~T2期、甲胎蛋白阴性、化疗使用和接受手术是肝癌肺转移患者总生存期改善的独立预测因素。
女性比男性具有更好的癌症特异性生存期,但女性和男性在总生存期上没有差异。与肝癌T1~T2期患者相比,T3~T4期患者的总生存期较差,并且与癌症特异性死亡的可能性增加有关。甲胎蛋白阳性是总生存期的独立预后因素,它也影响肝癌特异性死亡。对于肝癌肺转移患者,全身化疗比手术更常见,队列中约有三分之一的患者接受了化疗,接受化疗的患者预后优于未接受化疗的患者。尽管接受手术治疗的患者数量有限,但我们的分析表明,对原发病灶的手术治疗往往会延长总生存期和癌症特异性生存期。这与Hu等[11]新近发表的研究结果一致。他们研究发现对原发病灶的手术是肝癌肺转移患者的独立预后因素。我们目前的研究结果也表明,手术治疗可能为一些肝癌肺转移患者提供更长生存期的机会。先前的报道提示,肝癌肺转移患者进行肺转移手术在某些患者中具有相对较高的生存率[18-21]。
本研究中,我们建立了两个列线图,可以为肝癌肺转移患者提供个性化的生存预测。列线图纳入了常见的临床变量,并经内部验证展现出良好的一致性,但仍需要模型的外部验证。总之,我们提供了两个基于独立预后因素的预后模型,以帮助临床医生评估该类患者的预后。

