注射用卡瑞利珠单抗致不良反应的分析研究
郭春霞,高明
1 洛阳石化医院肿瘤内科,洛阳 471012;2 郑州大学第一附属医院肿瘤内科,郑州 450052
注射用卡瑞利珠单抗为我国自主研发的一种人源化程序性死亡受体1(programmed death-1,PD-1)单克隆抗体,可通过与PD-1 特异性结合的方式阻断PD-1/程序性死亡受体配体1(programmed death-ligand 1,PD-L1)信号通路的传导,解除T 淋巴细胞的免疫抑制,增强机体免疫反应及应答,从而发挥抗肿瘤的作用[1-2]。目前,已有研究证实[3-4]注射用卡瑞利珠单抗对肺癌、肝癌、食管癌等恶性肿瘤均具有较好的治疗效果。自2020 年12 月28 日起,注射用卡瑞利珠单抗已被纳入国家医保药品目录,药品价格平均降幅超过80%,这意味着将有更多的恶性肿瘤患者可使用注射用卡瑞利珠单抗进行治疗,减轻了患者的经济负担,且可获得较好的生存获益。相关研究表明[5],注射用卡瑞利珠单抗临床疗效确切,但同样会产生反应性毛细血管增生症、贫血、乏力等不良反应。因此,注射用卡瑞利珠单抗的安全性成为临床关注的重点问题。既往研究报道[6]大多对注射用卡瑞利珠单抗引起的不良反应进行个案分析,但关于注射用卡瑞利珠单抗致不良反应的系统性、全面性分析报道仍较少。基于此,本研究旨在通过分析注射用卡瑞利珠单抗相关不良反应的发生情况,以期为临床合理用药及采取针对性措施减少其不良反应提供参考。现报道如下。
1 资料与方法
1.1 一般资料
采用回顾性研究,选取2020 年1 月~2021 年12 月期间某院收治的103 例恶性肿瘤患者作为研究对象,其中男性81 例,女性22 例;年龄≤55 岁者24 例,>55 岁者79 例;膀胱癌2 例,贲门癌1 例,胆管癌2 例,肺癌32 例,肝癌35 例,结肠癌1 例,前列腺癌1 例,软组织肉瘤1 例,肾癌1 例,食管癌20 例,胃癌5 例,牙龈癌1 例,胰腺癌1 例;注射用卡瑞利珠单抗联合用药情况:单独使用注射用卡瑞利珠单抗者19 例,注射用卡瑞利珠单抗联合1 种药物者50 例,注射用卡瑞利珠单抗联合2 种及以上药物者34 例。
纳入标准:①经病理组织活检确诊者。②于医院接受规范化治疗者。③可耐受本研究治疗药物者。④年龄≥18 岁者。⑤单一恶性肿瘤者。⑥符合国家药品监督管理局批准的注射用卡瑞利珠单抗治疗适应症(如肿瘤、肝癌、食管癌、鼻咽癌、胆管癌、胃癌等)者。
排除标准:①妊娠期或哺乳期女性者。②治疗前存在心、肾等重要脏器功能异常者。③治疗中途转院者。④合并自身免疫性疾病或严重心脑血管疾病者。⑤既往接受过PD-1 或抗PD-L1 抗体治疗者。
1.2 治疗方法
所有患者均使用注射用卡瑞利珠单抗(苏州盛迪亚生物医药有限公司,国药准字S20190027,规格200mg/瓶)治疗:①肺癌者:200mg/次,静脉注射,每3 周1 次,直至疾病进展或出现不可耐受的毒性。②肝癌者:3mg/kg,静脉注射,每3 周1 次,直至疾病进展或出现不可耐受的毒性。③食管癌及其他恶性肿瘤者:200mg/次,静脉注射,每2 周1 次,直至疾病进展或出现不可耐受的毒性。与其他化疗药物联合使用时,应首先静脉滴注注射用卡瑞利珠单抗,间隔30min 以上后再给予其他化疗药物。
1.3 评价标准
通过不良反应因果关系评定标准5 项原则[7]判断恶性肿瘤患者应用注射用卡瑞利珠单抗治疗后不良反应[包括免疫相关性不良反应(如免疫性肝炎、免疫性肠炎)、输液反应(如发热)以及可能发生的脱靶效应(如骨髓抑制)]与注射用卡瑞利珠单抗的关联性。其中,临床事件发生在与药物使用相对合理的时间内,可用合并症或者其他药物的作用来解释,可以缺少去激发试验的信息为“可能有关”;临床事件发生在与药物使用相对合理的时间内,不能归因于合并症或其他药物的作用,对于去激发试验的反应是合理的,尚不需要再激发试验的信息为“很可能有关”;临床事件发生在与药物使用相对合理的时间内,不能用合并症或其他药物的作用来解释,对于去激发试验的反应是合理的,有明确的药理学或生物学性质,必要时给予再激发试验为“肯定有关”。此外,参照《新型抗肿瘤药物临床应用指导原则》(2019 年版)[8]中相关内容进行不良反应分级:轻度反应、不需要治疗为1 级;中度反应、需要治疗为2 级;中度反应、威胁患者生命,但可恢复为3 级;严重反应、加速死亡或直接致死为4 级。
1.4 统计学方法
应用SPSS 25.0 软件处理分析数据。计量资料经Shapiro-Wilk正态性检验,符合正态分布以±s表示;计数资料以n(%)表示。
2 结果
2.1 恶性肿瘤患者不良反应发生情况
103 例恶性肿瘤患者中发生注射用卡瑞利珠单抗说明书中报道的不良反应共24 种,合计116 例次。其中,反应性毛细血管增生症发生率最高(52.59%);其次为甲状腺功能低下(15.52%);未发生致死性不良反应(表1)。

表1 恶性肿瘤患者不良反应发生情况
2.2 不同资料特征的恶性肿瘤患者不良反应发生情况
本研究结果提示,不同资料特征的恶性肿瘤患者不良反应发生情况存在一定差异。女性患者不良反应发生率高于男性;年龄>55 岁患者不良反应发生率高于年龄≤55 岁患者;注射用卡瑞利珠单抗联合2 种及以上药物患者的不良反应发生率高于注射用卡瑞利珠单抗联合1 种药物及单独使用注射用卡瑞利珠单抗患者,注射用卡瑞利珠单抗联合1 种药物患者的不良反应发生率高于单独使用注射用卡瑞利珠单抗患者(表2)。
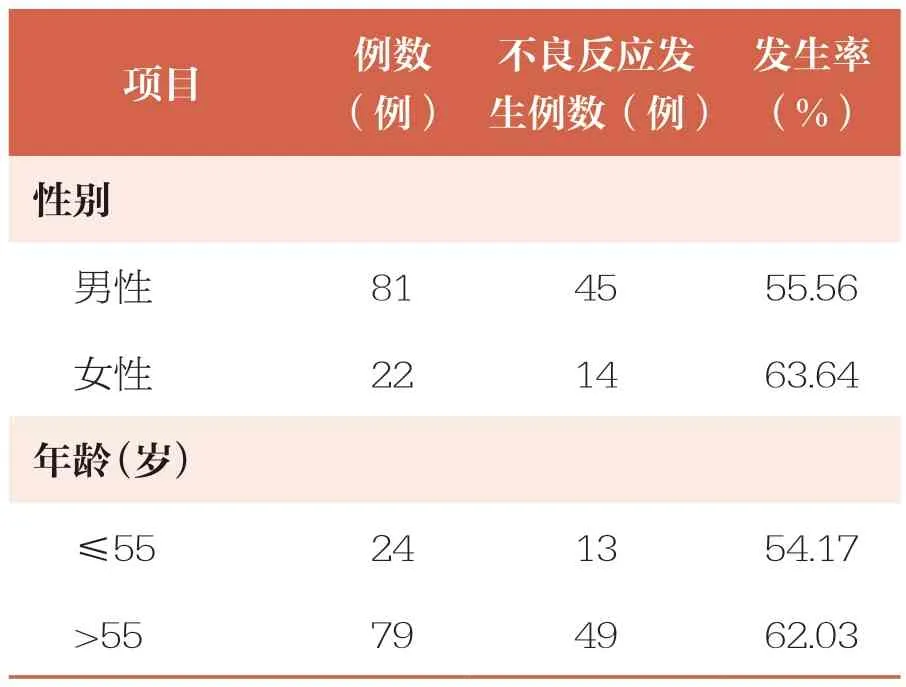
表2 不同资料特征恶性肿瘤患者不良反应发生情况
3 讨论
恶性肿瘤已成为威胁人类健康的严重公共卫生问题之一,多数患者确诊时已是中晚期,错过了进行根治性手术治疗的机会,故需采取其他手段进行治疗[9]。近年来,免疫治疗作为一种新型疗法已逐渐被人们所关注,并用于治疗中晚期恶性肿瘤患者[10]。目前,免疫检查点分子主要包括PD-1/PD-L1 及细胞毒性T 淋巴细胞相关抗原4,其相应的免疫检查点抑制剂,如阿替利珠单抗、帕博利珠单抗、注射用卡瑞利珠单抗等,已相继用于治疗恶性肿瘤。其中,注射用卡瑞利珠单抗作为一种PD-1 抑制剂,对PD-1 具有较高的亲和力,可阻断PD-1/PD-L1 信号通路,逆转或减弱肿瘤细胞的免疫耐受及逃逸作用,重新激活T 淋巴细胞并恢复免疫系统识别,最终达到杀伤肿瘤细胞的作用[11-12]。续广娟等[13]研究显示,免疫检查点抑制剂治疗恶性肿瘤时可引起反应性毛细血管增生症、白癜风、甲状腺功能低下、口腔糜烂、反酸等一系列免疫相关性不良反应,累及皮肤、内分泌及消化系统等,降低患者对治疗的耐受性,影响治疗效果,导致患者预后不良。因此,分析探讨恶性肿瘤患者应用注射用卡瑞利珠单抗治疗时的不良反应发生情况对于提高治疗安全性及促进患者疾病转归至关重要。
本研究结果显示,103 例恶性肿瘤患者中发生注射用卡瑞利珠单抗说明书中报道的不良反应共24种,其中反应性毛细血管增生症发生率最高,占52.59%;其次为甲状腺功能低下,占15.52%;未发生致死性不良反应。分析原因如下:①反应性毛细血管增生症。反应性毛细血管增生症为注射用卡瑞利珠单抗引起的皮肤不良反应中最常见的一种,以真皮层毛细血管增多及毛细血管内皮细胞增生为主要病理学特征,易破溃出血,属于一种皮肤免疫应激性反应[14]。注射用卡瑞利珠单抗治疗恶性肿瘤患者时,可过度激活机体免疫功能,破坏皮肤组织内促血管生成因子与血管生成抑制因子之间的动态平衡,从而导致局部毛细血管内皮细胞异常增生,形成反应性毛细血管增生症[15-16]。王峰等[17]研究指出,注射用卡瑞利珠单抗引起反应性毛细血管增生症的发生率约77.1%,多数患者在首次用药后2~4 周内出现,且随着用药次数增加,累及皮肤范围逐渐扩大,停药后1~2 个月可完全消退,不留明显瘢痕。本研究中,反应性毛细血管增生症发生率与上述研究结果类似,提示注射用卡瑞利珠单抗引起反应性毛细血管增生症的发生率较高。当患者出现反应性毛细血管增生症时,可根据患者病情进行局部治疗,如外科切除或激光治疗;若存在破溃出血,则予以抗感染治疗,尽可能降低不良反应对机体产生的负面影响,促进疾病转归。②甲状腺功能低下。目前认为,注射用卡瑞利珠单抗除对恶性肿瘤患者T 淋巴细胞功能产生一定影响外,还可通过对T 淋巴细胞依赖性及非依赖性活化B 淋巴细胞的调节作用促进炎症因子及趋化因子释放,引起甲状腺组织的炎症性损伤,导致甲状腺功能出现障碍,影响甲状腺组织分泌甲状腺激素,进而出现甲状腺功能减退症状[18]。此外,有研究指出[19],注射用卡瑞利珠单抗还可通过B 淋巴细胞介导的炎症反应损伤胰岛B 细胞,导致胰岛B 细胞分泌胰岛素出现障碍,从而造成机体血糖水平升高,最终引发糖尿病。但注射用卡瑞利珠单抗如何导致甲状腺组织及胰岛功能异常的具体机制仍不清楚。建议临床在恶性肿瘤患者使用注射用卡瑞利珠单抗治疗时常规检测甲状腺功能及血糖水平,对于无症状或仅有轻度甲状腺功能减退及血糖升高症状的患者给予继续观察,对于2 级及以上甲状腺功能减退及血糖升高症状的患者可给予甲状腺激素替代治疗及降糖药物治疗。③消化系统、运动及循环系统、全身不良反应。注射用卡瑞利珠单抗治疗恶性肿瘤是通过激活或改善机体免疫系统功能的方式杀伤肿瘤细胞实现的。但该药物可能会导致免疫系统过度激活,引起炎症反应,损伤胃肠道、肝脏等部位正常组织细胞,影响胃肠道及肝脏功能,从而引起免疫性肠炎、腹胀、纳差、乏力、发热等不良反应。此外,注射用卡瑞利珠单抗还会过度激活机体中的T 淋巴细胞,导致T 淋巴细胞在识别肿瘤细胞的同时也能识别正常肝细胞,损伤正常肝组织,从而诱发免疫性肝炎[20-21]。李琳等[22]研究显示,卡瑞利珠单抗可导致免疫相关骨骼肌及心肌损伤等不良反应的发生,本研究结果也与上述研究结果相似。因此,当恶性肿瘤患者在使用注射用卡瑞利珠单抗治疗期间出现消化系统、运动及循环系统、全身不良反应时,建议医生完善对患者心脏、骨骼等的影像学检查和对肝功能、血常规及心肌酶的检测,必要时可减少注射用卡瑞利珠单抗的使用量,同时给予对症治疗,以减轻不良反应对患者产生的损伤,提高用药安全性。④血液系统不良反应。骨髓抑制、白细胞减少等为注射用卡瑞利珠单抗致血液系统不良反应的常见类型。其发生机制尚未明确,可能与使用注射用卡瑞利珠单抗治疗的患者体内可产生药物依赖性抗体有关。药物依赖性抗体可通过免疫复合物激活补体,损伤骨髓造血细胞,导致血小板及白细胞减少,引起血小板减少症、白细胞减少症、贫血等血液系统疾病[23]。因此,建议临床加强对恶性肿瘤患者血小板、白细胞、血红蛋白等血液指标的监测,若患者出现严重血液系统不良反应,需及时调整注射用卡瑞利珠单抗的使用量,并给予糖皮质激素、铁剂等药物对症治疗,以减轻患者不良反应。
此外,本研究还统计了不同资料特征恶性肿瘤患者的不良反应发生情况,结果显示,女性、年龄>55 岁患者不良反应发生率分别高于男性、年龄≤55 岁患者,且随着注射用卡瑞利珠单抗联合用药种类的增多,患者不良反应的发生率也随之增加。分析原因可能为:相较于男性,女性体内雌激素含量高会在一定程度上影响机体对注射用卡瑞利珠单抗的吸收与代谢,导致其在体内蓄积,加重药物对胃肠道及其他组织器官的损伤,从而增加了不良反应的发生风险[24]。而与年龄≤55 岁的患者相比,年龄>55 岁的患者机体各项器官功能衰退程度更严重,对注射用卡瑞利珠单抗的耐受性及对药物的吸收与代谢能力相对更差,因此治疗过程中不良反应的发生率更高[25]。另外,随着注射用卡瑞利珠单抗联合用药种类的不断增多,机体胃肠道、肝脏等负担会逐渐加重,且各种药物的毒性作用会相互叠加,损伤组织器官,引发更多的不良反应。因此,临床应加强对女性、年龄>55 岁、多药联用等高风险患者的关注及相关指标的检测,并根据患者病情、耐受性及药物相互作用制定更加合理的用药方案,尽可能降低不良反应发生率。
综上所述,恶性肿瘤患者使用注射用卡瑞利珠单抗治疗所引起的不良反应类型较多,发生率较高,且不同资料特征患者的不良反应发生情况也存在一定差异,临床应进一步提高重视,加强用药监测,保障患者用药安全。然而,本研究仍存在一定局限性,如纳入样本量较少,且为单中心研究,研究结果具有一定地域局限性,今后还需开展大样本量、多中心的研究进一步分析,以提高研究结果的可信度。

