基于ERK介导C-Myc/PD-L1协同作用探讨参芪抑瘤方联合顺铂对H22肝癌荷瘤小鼠的抑瘤机制
杨玉萍 段永强 白敏 冯鑫 周楠 曹力仁 李亚荣 马兰
(甘肃中医药大学,甘肃省实验动物行业技术中心,兰州 730000)
原发性肝癌(primary liver cancer,PLC)是我国常见的恶性肿瘤之一,其病死率高居国内恶性肿瘤第二位[1]。肝癌治疗方法虽日趋成熟,但临床大多选用放化疗治疗手段,在抑制肿瘤生长的同时不可避免地损伤了免疫系统,而肿瘤免疫治疗能够提高机体免疫功能,破坏肿瘤细胞[2-4]。程序性死亡受体1(programmed death-1,PD-1)及其配体(programmed cell death 1 ligand 1,PD-L1)是免疫治疗当中较为关键的蛋白,是一种膜蛋白,其分泌至肿瘤细胞膜表面后与T细胞表面的PD-1相结合后抑制机体的免疫应答,促进肿瘤的发生和转移[5-6]。此外,原癌基因C-Myc可以直接与PD-L1基因的启动子结合,从转录水平促进PD-L1表达,从而破坏机体免疫稳态,抑制自身免疫的发展,诱导肿瘤的发生,促进细胞增殖、分化,是正常细胞转化为肿瘤细胞的中心环节[7-8]。C-Myc是MAPK/ERK通路的下游关键分子,PD-L1与C-Myc具有相协性[9]。目前从MAPK/ERK通路介导的C-Myc/PD-L1协同作用对肿瘤的抑制作用尚无文献研究。因此,本研究通过观察不同剂量的参芪抑瘤方联合顺铂靶向干预MAPK/ERK通路对H22肝癌荷瘤小鼠组织中C-Myc与PD-L1基因表达影响,探讨参芪抑瘤方联合顺铂对H22肝癌荷瘤小鼠的抑瘤作用及分子机制,为参芪抑瘤方的临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞 SPF级雄性昆明小鼠,由甘肃中医药大学SPF级动物实验中心提供,许可证号:SCXK(甘)2020-0009。本实验经甘肃中医药大学动物实验伦理委员会审批(伦理审查批准号:2021-205),70日龄,体质量18~22 g。H22肝癌细胞株,购自武汉普诺赛生命科技有限公司(BRF1A0KT 3Q)。
1.1.2 药物 参芪抑瘤方:黄芪30 g、当归20 g、山慈菇10 g、土贝母10 g、苦参15 g、八月札30 g、莪术10 g、半枝莲20 g、白术18 g、枳壳12 g、人参15 g,购自甘肃中医药大学附属医院药房。注射用顺铂(OKO554B03)购自甘肃中医药大学附属医院。
1.1.3 试剂与仪器 RIPA裂解液(Cat#R0010)、BCA蛋白浓度测定试剂盒(Cat#PC0020)、4×蛋白质上样缓冲液(P1016)、蛋白磷酸酶抑制剂(CatP126 D)购自北京索莱宝科技有限公司;p-ERKV2(GTX24819)、C-Myc(GTX31308)、PD-L1(GTX1034-36)、β-actin(YM3028);ECL化学发光超敏显色试剂盒(57105010);EGF ELISA试剂盒(2202M03),IFN-γ ELISA试剂盒(2202M16);总RNA提取试剂盒(W9414);逆转录试剂盒(G7106010);实时qPCR Mix(H9114010)。电泳仪(041BR69450)、VE-180型垂直板电泳装置(153BR111209)、酶标仪(iMark)、梯度PCR仪(T100)购自伯乐生命医学产品(上海)有限公司;GeLView 6000plus凝胶成像系统购自广州博鹭腾生物科技有限公司;实时荧光定量PCR仪(CG-05)购自杭州晶格科学仪器有限公司。
1.2 方法
1.2.1 复制H22肝癌荷瘤小鼠模型 取H22肝癌细胞株解冻,复苏H22肝癌细胞,细胞复苏后,将细胞浓度调至1×107个/ml,每只昆明小鼠腹腔接种0.2 ml。腹腔传至第3代,抽取淡黄色腹水,进行细胞计数,选取最佳细胞浓度3×106个/ml,每只0.1 ml接种于小鼠右前肢腋窝皮下。接种第5~7天小鼠右前肢腋窝下可触及黄豆大小肿块提示模型复制成功[10],可进行后续实验。
1.2.2 小鼠分组及干预 60只SPF级雄性昆明小鼠,采用随机数字表法取10只小鼠作为空白组,其50只小鼠复制H22肝癌荷瘤小鼠模型,模型复制成功后将模型小鼠随机分为模型组、顺铂组、参芪抑瘤方低、中、高剂量联合顺铂组(低、中、高剂量联合组)。顺铂和参芪抑瘤方给药均按照人与动物体质量进行折算[11],顺铂给药量为2.5×10-3g/(kg·3 d)。低、中、高剂量联合组分别在顺铂正常给药的基础上联用不同剂量[13.515 g/(kg·d)、27.030 g/(kg·d)、54.060 g/(kg·d)]参芪抑瘤方汤剂灌胃。空白组与模型组均给予相同体积生理盐水灌胃及腹腔注射,连续干预13 d,末次给药24 h后,用戊巴比妥钠(0.2 ml/只)麻醉处死小鼠,取材待检。
1.2.3 肿瘤抑制率及脏器指数测定 在无菌环境下摘取肿瘤组织、胸腺及脾脏,滤纸吸干组织表面多余水分,称重记录。抑瘤率(IR)(%)=[模型组瘤质量(g)-用药组瘤质量(g)]/模型组瘤质量(g)×100%];器官指数=器官质量(mg)/小鼠体质量(g)[12]。
1.2.4 HE染色观察各组小鼠肿瘤组织病理变化将部分肿瘤组织用4%多聚甲醛固定,石蜡包埋,切片脱蜡,再用苏木精和伊红染色,脱水封片。采用显微镜在400倍光镜下观察各组小鼠肿瘤组织病理变化。
1.2.5 ELISA试剂盒检测肿瘤组织中EGF、IFN-γ含量 称取0.1 g肿瘤组织,加入0.9 ml PBS(pH=7.2~7.4)缓冲液,充分研磨,制成组织匀浆液,3 000 r/min 离心20 min,收集上清。严格按照小鼠EGF、IFN-γ ELISA试剂盒说明书进行检测。
1.2.6 免疫组化法检测肿瘤组织中p-ERK1/2、C-Myc、PD-L1蛋白表达 石蜡切片脱蜡至水,抗原修复,阻断内源性过氧化物酶,孵育一抗、二抗,DBA显色等过程后,脱水封片。显微镜调至200倍镜下观察,细胞核和(或)细胞质为棕黄色者为阳性。采用Image J 8.0软件分析量化。
1.2.7 Western blot检测肿瘤组织中p-ERK1/2、C-Myc和PD-L1蛋白表达 称取0.1 g肿瘤组织剪碎,加入蛋白裂解液,离心取上清。BCA蛋白定量后变性,通过SDS-PAGE凝胶电泳,转膜,封闭2 h后,加入一抗4 ℃孵育过夜,1×TBST洗膜,二抗(1∶20 000)室温孵育1 h。采用1×TBST洗涤后,加入ECL发光溶液并用凝胶成像仪曝光。采用Image J 8.0分析蛋白条带灰度值。
1.2.8 RT-PCR检测肿瘤组织中ERK、C-Myc和PD-L1基因表达 称取0.1 g肿瘤组织,使用RNA提取试剂盒进行提取,超微光学分光光度计测量总RNA浓度。根据逆转录试剂盒说明书,将提取的总RNA反转录成cDNA。GAPDH为内参基因,每组相同基因设4个重复,根据RT-PCR扩充试剂盒说明扩增靶基因,并计算每个mRNA的相对表达。引物由上海百赛生物技术股份有限公司合成,序列见表1。
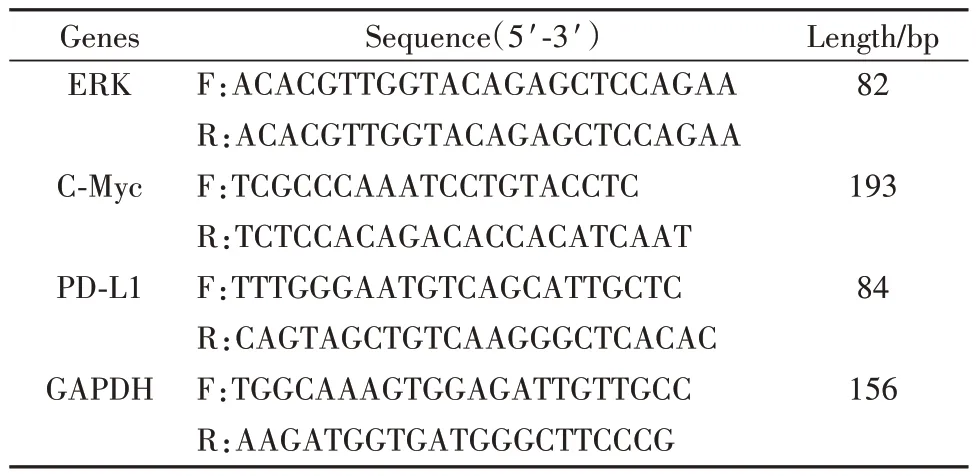
表1 引物序列Tab.1 Primer sequences
1.3 统计学分析 实验数据均用±s表示,采用SPSS24.0软件进行计量数据处理,根据方差齐性检验结果,各组间的比较采用单因素方差分析,P<0.05代表差异具有统计学意义。
2 结果
2.1 参芪抑瘤方联合顺铂对H22肝癌荷瘤小鼠肿瘤组织病理学变化的影响 HE染色结果显示,模型组肿瘤组织细胞排列紧密有规则,细胞核完整且核深染,核大浆少,细胞核之间分界清楚,未见明显细胞坏死;顺铂组及低、中、高剂量联合组肿瘤组织细胞排列疏松且不规则,细胞核固缩、破裂,界限模糊,细胞数目减少,出现不同程度的片状坏死面积,上述肿瘤坏死灶高剂量联合组最显著。见图1。

图1 各组小鼠肿瘤组织病理学变化(HE,×400)Fig.1 Histopathological changes of tumor in each group(HE,×400)
2.2 参芪抑瘤方联合顺铂对H22肝癌荷瘤小鼠体质量变化及肿瘤抑制率的影响 与空白组相比,模型组小鼠平均体质量降低(P<0.05);与模型组相比,各治疗组小鼠平均体质量均升高(P<0.05)、瘤体积均减小(P<0.05)、瘤质量均降低(P<0.05);与顺铂组相比,高剂量联合组小鼠瘤体积减小(P<0.05);中、高剂量联合组小鼠平均体质量升高(P<0.05)、平均瘤质量降低(P<0.05)。低、中、高剂量联合组及顺铂组抑瘤率分别为46.62%、53.97%、61.25%、43.15%。见图2。

图2 各组小鼠体质量、瘤质量及抑瘤率变化Fig.2 Changes of body weight, tumor weight and tumor inhibition rate in each group
2.3 参芪抑瘤方联合顺铂对H22肝癌荷瘤小鼠脾脏、胸腺指数的影响 与空白组小鼠相比,模型组小鼠脾脏指数、胸腺指数均下降(P<0.05);与模型组相比,顺铂组小鼠脾脏指数、胸腺指数均下降,但差异无统计学意义(P>0.05),而中、高剂量联合组小鼠脾脏指数、胸腺指数均升高(P<0.05),见表2。
表2 各组小鼠脾脏指数和胸腺指数的变化(±s)Tab.2 Changes of spleen index and thymus index in each group (±s)

表2 各组小鼠脾脏指数和胸腺指数的变化(±s)Tab.2 Changes of spleen index and thymus index in each group (±s)
Note:Compared with blank group, 1)P<0.05; compared with model group, 2)P<0.05; compared with cisplatin group, 3)P<0.05.
Thymus index/(mg·g-1)Groups Spleen index/(mg·g-1)2.51±0.93 0.79±0.291)1.29±0.85 1.53±0.532)3)1.75±0.902)3)0.70±0.40 Blank Model Combination with low-dose Combination with medium-dose Combination with high-dose Cisplatin 8.59±2.02 4.00±2.691)5.31±2.45 6.94±3.082)3)7.20±3.312)3)3.45±1.71
2.4 参芪抑瘤方联合顺铂对H22肝癌荷瘤小鼠肿瘤组织中EGF、IFN-γ含量的影响 与模型组相比,各治疗组小鼠肿瘤组织匀浆液中EGF和IFN-γ含量均降低(P<0.05);与顺铂组相比,中、高剂量联合组小鼠瘤组织中EGF和IFN-γ含量均降低(P<0.05),见表3。
表3 各组小鼠肿瘤组织中EGF和IFN-γ水平的变化(±s,n=6)Tab.3 Changes of EGF and IFN-γ levels in tumor tissues of mice in each group (±s,n=6)

表3 各组小鼠肿瘤组织中EGF和IFN-γ水平的变化(±s,n=6)Tab.3 Changes of EGF and IFN-γ levels in tumor tissues of mice in each group (±s,n=6)
Note:Compared with model group, 1)P<0.05; compared with cisplatin group, 2)P<0.05.
IFN-γ/(pg·ml-1)110.66±15.97 89.85±6.501)75.35±8.081)2)71.79±22.881)2)93.73±8.721)Groups Model Combination with low-dose Combination with medium-dose Combination with high-dose Cisplatin EGF/(pg·ml-1)83.51±8.88 63.139±0.991)54.95±10.601)2)52.89±9.761)2)68.96±4.871)
2.5 免疫组化法检测肿瘤组织中p-ERK1/2、C-Myc、PD-L1蛋白表达结果 p-ERK1/2、C-Myc蛋白阳性表达于细胞浆和(或)细胞核,PD-L1蛋白阳性表达于细胞质或细胞膜,染色为棕黄色。免疫组化结果显示,模型组p-ERK1/2、C-Myc、PD-L1蛋白阳性表达率最高,切片黄染占比面积较大,各用药组蛋白阳性表达率逐渐降低(P<0.05);与顺铂组相比,联合用药组蛋白阳性表达率降低(P<0.05),且中、高剂量联合组蛋白阳性表达率显著降低(P<0.01),见图3。
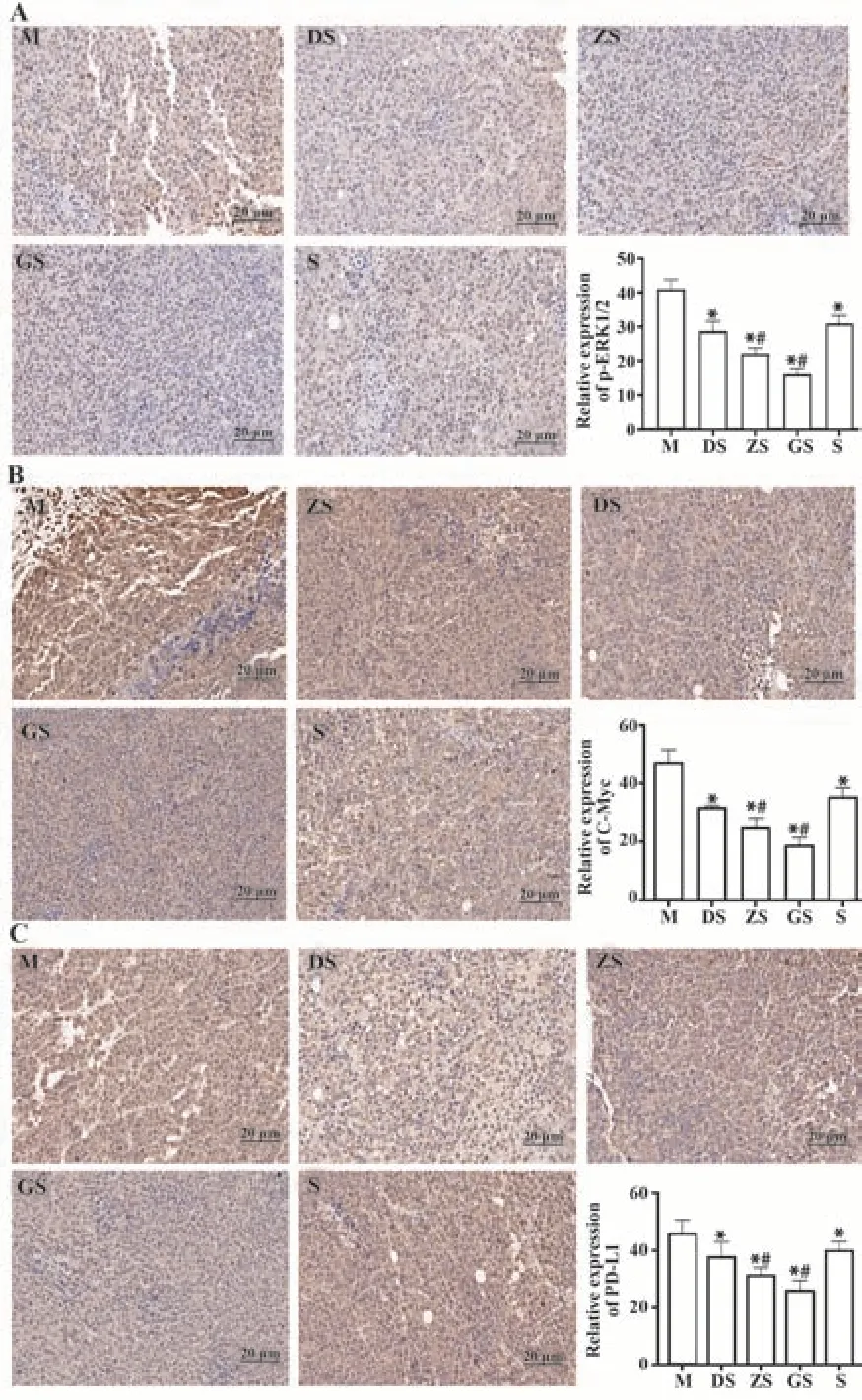
图3 肿瘤组织中免疫组化p-ERK1/2、PD-L1、C-Myc表达Fig.3 Immunohistochemical p-ERK1/2,PD-L1,C-Myc expressions in tumor tissue
2.6 参芪抑瘤方联合顺铂对H22肝癌荷瘤小鼠肿瘤组织中ERK、C-Myc、PD-L1 mRNA表达的影响RT-PCR检测结果显示,与模型组相比,各治疗组小鼠肿瘤组织中ERK、C-Myc、PD-L1 mRNA表达均降低(P<0.05);与顺铂组相比,中、高剂量联合组小鼠瘤组织中ERK、C-Myc、PD-L1 mRNA表达均明显降低,且呈剂量依赖性变化(P<0.05),见表4。
表4 各组小鼠肿瘤组织中ERK、C-Myc、PD-L1 mRNA的表达(±s,n=4)Tab.4 mRNA expressions of ERK, C-Myc and PD-L1 in tumor tissues of mice in each group (±s,n=4)

表4 各组小鼠肿瘤组织中ERK、C-Myc、PD-L1 mRNA的表达(±s,n=4)Tab.4 mRNA expressions of ERK, C-Myc and PD-L1 in tumor tissues of mice in each group (±s,n=4)
Note:Compared with model group, 1)P<0.05; compared with cisplatin group, 2)P<0.05.
Groups Model Combination with low-dose Combination with medium-dose Combination with high-dose Cisplatin ERK/GAPDH 1.00±0.00 C-Myc/GAPDH 1.00±0.00 PD-L1/GAPDH 1.00±0.00 0.60±0.221)0.63±0.091)0.67±0.171)0.43±0.101)2)0.46±0.091)2)0.42±0.071)2)0.23±0.061)2)0.78±0.121)0.31±0.101)2)0.68±0.211)0.30±0.071)2)0.65±0.141)
2.7 参芪抑瘤方联合顺铂对H22肝癌荷瘤小鼠肿瘤组织中p-ERK1/2、C-Myc、PD-L1蛋白表达的影响 Western blot结果显示,与模型组相比,各治疗组小鼠肿瘤组织中p-ERK1/2、C-Myc、PD-L1蛋白表达均降低(P<0.05);与顺铂组相比,中、高剂量联合组小鼠瘤组织中p-ERK1/2、C-Myc、PD-L1蛋白表达均明显降低,且呈剂量依赖性变化(P<0.05)。见图4、表5。
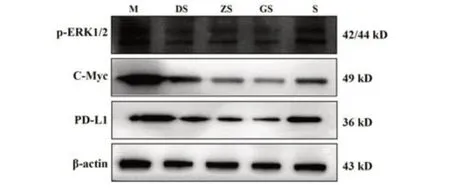
图4 各组小鼠肿瘤组织中p-ERK1/2、C-Myc、PD-L1蛋白表达Fig.4 Protein expressions of p-ERK1/2, C-Myc and PDL1 in tumor tissues of mice in each group
表5 各组小鼠肿瘤组织中p-ERK1/2、C-Myc、PD-L1蛋白表达(±s,n=3)Tab.5 Protein expressions of p-ERK1/2,C-Myc and PDL1 in tumor tissues of mice in each group (±s,n=3)
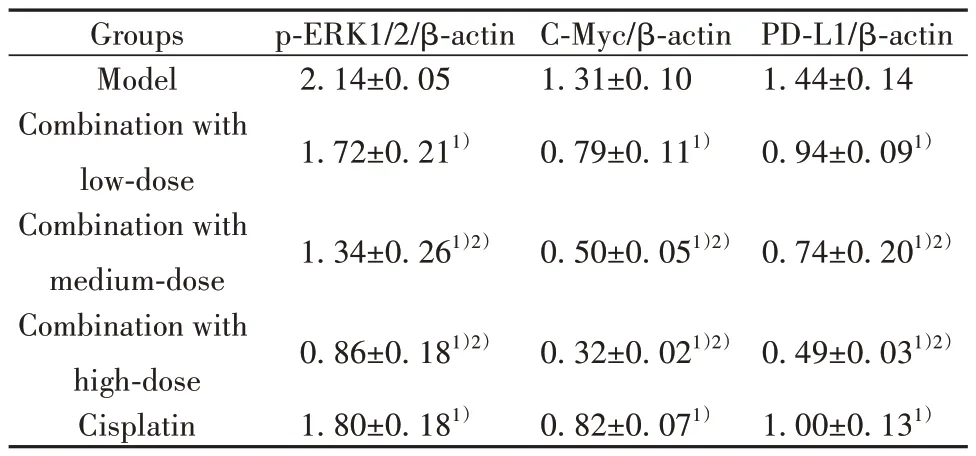
表5 各组小鼠肿瘤组织中p-ERK1/2、C-Myc、PD-L1蛋白表达(±s,n=3)Tab.5 Protein expressions of p-ERK1/2,C-Myc and PDL1 in tumor tissues of mice in each group (±s,n=3)
Note:Compared with model group, 1)P<0.05; compared with cisplatin group, 2)P<0.05.
Groups Model Combination with low-dose Combination with medium-dose Combination with high-dose Cisplatin p-ERK1/2/β-actin 2.14±0.05 1.72±0.211)C-Myc/β-actin 1.31±0.10 0.79±0.111)PD-L1/β-actin 1.44±0.14 0.94±0.091)1.34±0.261)2)0.50±0.051)2)0.74±0.201)2)0.49±0.031)2)1.00±0.131)0.86±0.181)2)1.80±0.181)0.32±0.021)2)0.82±0.071)
3 讨论
中医认为肝癌的发生病机多为本虚标实,虚、瘀、痰、毒为病理基础。正气亏虚,邪毒外扰,形成气滞、血瘀、湿热、痰毒等虚实夹杂之证。目前运用中医药辅助治疗肝癌被广泛关注,中药不仅能改善患者的临床症状,而且能减轻患者化疗后的不良反应,增强机体免疫,提高生活质量,延长生存时间。
《金匮要略·妇人妊娠病脉证并治》第二十篇中载:“妊娠,小便难,饮食如故,当归贝母苦参丸主之”。吴红彦教授结合临床探究此段文意,认识到肿瘤的核心病机与当归贝母苦参丸主治之证有诸多相似之处,只不过肿瘤患者的虚象和瘀象更加明显。故此,吴教授在当归贝母苦参丸的基础上加减化裁,创立了治疗肿瘤疾病的常用方——参芪抑瘤方。此方由黄芪、当归、贝母、苦参、山慈菇等药组成,方中重用黄芪补肺健脾,扶正益气;贝母入肝经,化痰散结;苦参清热燥湿解毒;当归补血活血;山慈菇清热化痰、软解散结,诸药相配,攻补兼施,共奏补气活血,扶正祛邪,解毒散结之功。
免疫系统在机体中占据着不可或缺的地位,其功能的紊乱导致多种疾病的发生,尤其与肿瘤的发生、发展、侵袭、转移等方面密切相关,虽机体的免疫系统能产生抗肿瘤免疫应答效应,但免疫功能的紊乱能使肿瘤逃避免疫细胞的监视及攻击而发生免疫逃逸[13]。PD-1/PD-L1通路的激活是肿瘤发生免疫逃逸的重要机制之一,肿瘤细胞膜上的PD-L1与T细胞上的PD-1结合,破坏T细胞的功能而阻止有效的肿瘤免疫反应[14]。而表皮生长因子(epidermal growth factor,EGF)和IFN-γ的表达可激活MAPK/ERK通路,同时诱导细胞膜上PD-L1表达上调,促进肿瘤细胞增殖,抑制其凋亡[15]。ERK1/2是MAPK信号通路中研究最为透彻的通路之一,活化ERK入核,启动相应的转录因子C-Myc表达[16]。研究表明,C-Myc在肿瘤组织中的过度表达,能促进肿瘤的发生发展[17]。此外,C-Myc可以直接与细胞膜上的PD-L1结合,并在肿瘤组织中高表达,诱导肿瘤发生免疫逃逸。PD-1/PD-L1的抑制剂在肿瘤治疗中应用广泛,且在临床上取得了一定的疗效,其抑制剂会影响自身免疫与免疫之间的平衡,增强免疫系统活性,攻击肿瘤细胞[18],但由于个体差异性,机体产生了耐药性反应以及一些免疫相关不良反应,腹泻、结肠炎、皮疹、肝功能异常、关节痛等较为常见[19]。中药复方在抗肿瘤免疫治疗中应用广泛,尤其是在调节免疫平衡,抑制肿瘤的免疫逃逸,降低西药毒性,减弱机体耐药性等方面优势显著,但是其具体机制尚不明晰。
因此,本实验复制H22肝癌荷瘤小鼠模型,应用参芪抑瘤方联合顺铂靶向干预ERK通路来调控肝癌小鼠瘤组织中C-Myc、PD-L1表达。结果表明,与模型组、顺铂组相比,参芪抑瘤方联合顺铂可以有效抑制肿瘤的生长,增加肿瘤坏死面积,提高小鼠脾脏指数、胸腺指数,降低肿瘤组织中EGF和IFN-γ表达,同时也降低肿瘤组织中p-ERK1/2、C-Myc、PD-L1蛋白表达和ERK、C-Myc、PD-L1 mRNA表达水平,高剂量联合组治疗效果显著(P<0.01),并呈剂量依赖性表达。以上研究表明,参芪抑瘤方联合顺铂能有效抑制H22肝癌荷瘤小鼠的肿瘤生长,抑制ERK信号通路激活,下调p-ERK1/2、C-Myc、PD-L1蛋白表达和ERK、C-Myc、PD-L1 mRNA表达水平,提高抗肿瘤免疫应答。
综上所述,参芪抑瘤方联合顺铂能有效抑制H22肝癌荷瘤小鼠的肿瘤生长,其机制可能是通过抑制ERK信号通路激活,下调C-Myc与PD-L1蛋白表达,同时也抑制了EGF和IFN-γ诱导的PD-L1 mRNA和蛋白表达。本实验为参芪抑瘤方联合顺铂治疗肝癌提供实验依据。

