膀胱癌共刺激因子相关基因预后模型的构建与验证
汤鋕城 蔡月桥 廖海琴 卢泽潮 唐福才 卢泽广 张嘉豪 赖永长 阎淑丹 何朝辉
(1.广州医科大学附属第三医院,广州 510000;2.广州医科大学第一临床学院,广州 511436;3.广州医科大学第二临床学院,广州 511436;4.中山大学附属第八医院泌尿外科,深圳 518033;5.广州医科大学第六临床学院,广州 511436)
作为中国泌尿生殖系统中最常见的恶性肿瘤,膀胱癌发病率逐年攀升,即使应用根治性膀胱切除术,仍有约50%患者复发或远处转移,带来沉重的社会负担[1]。尽管基于顺铂的新辅助化疗等新疗法被应用于临床,但仍存在疗效不确切和治疗反应差异大等难题,而基于新型生物标志物的靶向疗法和免疫疗法展现了光明的前景[2]。2016年以来,包括阿特朱单抗的5种免疫检查点抑制剂已获得美国食品和药品监督管理局批准应用于一二线治疗,标志着膀胱癌免疫治疗开启新篇章[3]。然而,仅有部分膀胱癌患者对特定的靶向治疗有效,这很可能与某些基因位点突变密切相关[4]。因此,进一步探索膀胱癌中的免疫反应机制、开发新型生物标志物以评估患者的病情进展和指导个性化治疗,对改善预后至关重要。
肿瘤微环境(tumor microenvironment,TME)是肿瘤发展、侵袭和转移的关键点,不仅与恶性表型密切相关,也显著影响治疗效果[5]。TME主要由驻留的基质细胞和被招募的免疫细胞组成。研究表明,基质细胞与肿瘤细胞间的相互作用很可能参与胰腺癌、乳腺癌和膀胱癌等肿瘤的动态发展过程,并显著影响患者预后[6-8]。WU等[9]研究表明,膀胱癌中的肿瘤浸润免疫细胞丰度与患者预后密切相关。在TME中,T细胞的活化需要双信号刺激,第一信号来自抗原,第二信号来自抗原提呈细胞,其提供的共刺激信号决定T细胞活化的方向。共刺激信号的缺失会导致T细胞不能被激活,并中止后续免疫过程,癌细胞可能通过这种方式实现肿瘤逃逸。作为潜在的治疗靶点,共刺激因子近年备受关注。ENDER等[10]通过实验表明,共刺激因子相关基因敲除显著影响了系统性红斑狼疮、非肥胖性糖尿病等自身免疫病模型小鼠的生存情况。此外,共刺激因子也在癌症的进展中起关键作用,研究证实,在肝细胞癌、头颈鳞状细胞癌中,共刺激因子相关基因与患者免疫治疗反应和预后密切相关[11-13]。泌尿系统肿瘤中也有相关报道,在透明细胞肾细胞癌中,基于CMS的预后模型已被证实为肾透明细胞癌患者的独立预后相关因素[14]。然而,目前关于膀胱癌中共刺激因子的表达模式和临床意义的研究鲜有报道。综上,课题组推测共刺激因子可能在膀胱癌进展中发挥重要作用,可能基于此开发新的生物标志物和预后模型。
本研究旨在筛选出影响膀胱癌患者预后的共刺激因子相关基因,并根据获得的基因建立模型,进一步探索其背后机制。本研究从TCGA数据库下载并分析了mRNA的表达数据集,筛选出3个具有显著预后价值的基因,并构建预后风险模型,再于多数据集中验证其有效性。此外,通过功能富集和免疫浸润分析,比较高低风险组的免疫浸润水平和生物通路差异,以探究膀胱癌发展机制。
1 资料与方法
1.1 数据的获取与整理 通过肿瘤基因组图谱(TCGA)数据库下载人类膀胱癌患者的基因表达矩阵和临床数据,剔除数据缺失样本后,包含389例膀胱癌组织样本和19例癌旁正常组织,随机分为TCGA训练组(n=287)和TCGA验证组(n=121)。通过基因表达数据库(GEO)下载GSE31684数据集的mRNA表达谱,剔除数据缺失样本后包含93例膀胱癌组织样本。
1.2 免疫评分和基质性评分的生成 免疫评分(estimate)是一种可用于评估肿瘤组织中基质细胞和免疫细胞浸润水平的算法工具,由YOSHIHARA等[15]首创,可较为准确地预测非肿瘤细胞的浸润情况。利用R包estimate进行基质和免疫微环境浸润评估,得出StromalScore和ESTIMATEScore,分别与基质细胞、免疫和基质细胞之和呈正相关,相应分数越高,提示TME中相应成分比例越大。
1.3 共刺激因子相关基因预后模型的建立 Cox回归模型是一种通过乘以风险系数解释协变量对总体效能的模型,常被用于评估诸如年龄、性别等患者临床性状对生存率的预测价值[16]。多变量Cox比例回归模型被广泛应用于确定预后相关因子,并通过确定参数β和基因表达量计算获得风险评分[17]。检索最新文献,获得60个与共刺激因子相关的编码基因。为获得预后相关基因并建立风险评分模型,使用R包Survival在TCGA验证组基因集进行单因素Cox比例风险回归分析,获得预后显著相关的基因(P<0.05)。再进行多因素Cox比例风险回归分析,获得独立预后相关基因(P<0.05),并构建风险评分公式。此公式由基因表达水平相应回归系数进行加权后的线性组合确定。
1.4 预后模型的评价 根据风险评分中位数将患者分为低风险组和高风险组。使用R包pheatmap可视化两组患者的生存情况和共刺激因子相关基因的表达量;使用R包Survminer绘制生存曲线比较两组的总生存期;使用R包Survival进行单因素及多因素Cox回归分析,并绘制森林图可视化风险评分、年龄、性别、临床分期、TMN分期与患者预后的相关性;通过R包timeROC绘制受试者工作特征(ROC)曲线,用以验证风险评分模型的准确性。
1.5 列线图的构建和验证 为建立一个预测膀胱癌患者预后的临床工具,综合考虑风险评分模型与临床特征(根据文献报道,年龄≥65岁很可能是重要预后危险因素,因此将膀胱癌患者按年龄≥65岁或<65岁分为高、低龄组[18]),并利用R包nomogramEx构建了列线图模型。该模型能够分析1年、3年和5年的生存概率。此外,为可视化实际情况与预测结果间的一致性,利用R包rms绘制校准曲线,其45°线代表最佳预测效能。
1.6 基因集合富集分析(Gene Set Enrichment Analysis,GSEA) 为分析膀胱癌患者在高风险组和低风险组之间的信号通路差异,进行功能富集分析。导入MsigDb数据库的c2.cp.kegg.v7.5.1.symbols.gmt作为参考基因集,使用GSEA软件(4.1.0)对标准化后的芯片矩阵进行分析。设置基因置换排列次数为1 000,P<0.05和错误发现率(FDR)<0.25为差异有统计学意义。
1.7 免疫浸润分析 CIBERSORT是一种通过实体肿瘤中的基因表达值评估组织细胞组成的方法[19]。利用CIBERSORT分析免疫细胞浸润的程度及不同类型免疫细胞的比例。
1.8 统计学分析 研究中的所有统计分析均采用R语言(版本4.1.1)进行。采用皮尔逊相关性算法计算相关性。采用Kaplan-Meier(KM)生存分析评估生存情况,并采用对数秩级检验评估分层组间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 临床数据与ESTIMATE免疫评分 TCGA数据集患者的临床信息见附表1(www.immune99.com),包含生存时间、生存状态、年龄、性别、癌症级别、TNM分级。为评估TME中基质组分与免疫组分的占比与膀胱癌患者临床分期的相关性,通过ESTIMATE分析免疫评分与组织学分级(grade)、临床分期(stage)的相关性。结果显示,高组织学组ESTIMATEScore评分显著增高(图1A),且临床分期Ⅱ组与临床分期Ⅳ组之间的ESTIMATEScore评分差异有统计学意义(图1B)。StromalScore评分同样与组织学分级呈正相关(图1C),不同临床分期间StromalScore评分也存在明显差异(图1D)。以上结果提示,膀胱癌患者的临床分期及组织学分级与TME中免疫细胞浸润密切相关。

表1 TCGA训练组中预后相关的共刺激因子相关基因单因素Cox分析结果Tab.1 Univariate Cox analysis of prognostic costimulatory genes in TCGA training group

图1 TCGA数据集中TME免疫评分箱型图Fig.1 Box plot of ESTIMATE score in TCGA dataset
2.2 基于CMS的风险评分的构建与验证 对60个CMS相关基因进行单因素Cox回归分析,筛选得到4个与预后显著相关的基因,结果如表1所示。利用多因素Cox比例风险回归分析确定独立预后因素并优化模型,最终筛选出3个基因:TNFRSF14、CD276、ICOS。基于3个基因的表达水平和回归系数构建风险公式:风险评分=(-0.026 040 787 258 630 7)×TNFRSF14+(0.015 842 801 886 645 3)×CD276+(-0.279 64)×ICOS。
根据中位数将患者分为高风险组和低风险组。在TCGA训练组中,散点图结果显示,高风险组患者存活率更低(图2A);基因表达热图提示,高/低风险组中这3个基因的表达量有明显差异(图2B);绘制KM曲线可视化患者的生存情况,高风险组的生存率明显较低(图2C)。在TCGA验证组和GEO组中评估患者的生存状态和基因表达情况(图2D~I)得到相同结论:低风险组患者存活率更高,3个CMSs表达水平差异显著且总生存期较长。

图2 CMS预后模型的建立与验证Fig.2 Establishment and validation of CMS prognostic model
为进一步探究风险评分及其他临床特征与膀胱癌患者预后的关系,进行单因素Cox及多因素回归分析。单因素Cox回归分析结果显示,临床分期(stage)、T分期、M分期、N分期、风险评分均与预后显著相关(图3A)。多因素Cox回归分析结果显示风险评分是膀胱癌患者的独立预后因素(图3B)。
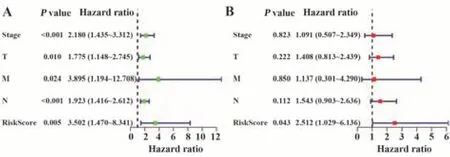
图3 风险评分与临床特征的单因素和多因素Cox回归分析森林图Fig.3 Forest map of univariate and multivariate Cox analysis of risk score and clinical characteristics
在TCGA训练组、TCGA验证组和GEO组中绘制风险评分和年龄、性别等临床特征的ROC曲线,三组的风险评分在ROC曲线中所对应的1年AUC值分别为0.698、0.706、0.620(图4),均高于其他临床特征。ROC分析结果提示,基于CMS的风险评分模型对膀胱癌患者的预后评估准确性优于传统临床特征。
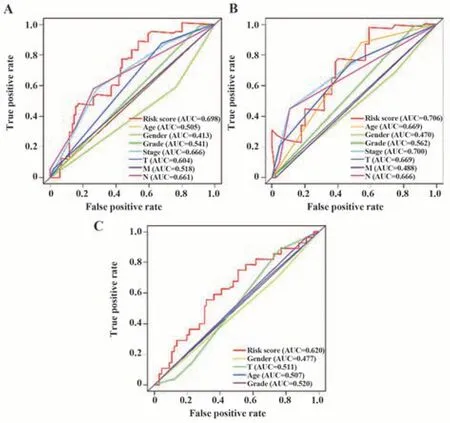
图4 TCGA训练组、TCGA验证组和GEO验证组中风险评分及其他临床特征的ROC曲线Fig.4 ROC curves of risk scores and other clinical features among TCGA training group, TCGA validation group and GEO group
2.3 预后列线图的构建与验证 综合考虑临床分期、风险评分等临床病理特征构建了预测总生存期的列线图。将预后相关因素在点轴上对应的评分相加可得到总得分,再向下绘制到1年、3年、5年的生存轴,可预测1年、3年、5年的生存率。由图5可知,大部分患者的总分为190~240分。

图5 1年,3年和5年总生存期的预后预测列线图Fig.5 Nomogram for predicting 1- ,3- and 5-year OS
为检验列线图的预后预测效能,使用校准曲线进行验证。结果显示,在TCGA训练组和GEO验证组中,预测结果与实际观测具有良好的一致性(图6A、C)。随后,对列线图预测结果的准确性进行评估,训练组在ROC曲线中对应的1年、3年、5年的AUC值分别为0.740、0.710、0.718(图6B),验证组在ROC曲线中对应的1年、3年、5年的AUC值分别为0.730、0740、0.718(图6D)。综上所述,基于CMS的列线图显示出良好的预后预测效能。

图6 TCGA组和GEO组中列线图1年、3年及5年总生存期校准曲线与ROC曲线Fig.6 1-, 3- and 5 year OS correction curve and ROC curve of bladder cancer patients in TCGA and GEO group
2.4 基因集合富集分析 通过GESA方法分析TCGA数据集和GEO数据集中高、低风险组间差异的生物功能通路。结果显示,高风险组主要富集在细胞外基质(extracellular matrix,ECM)互作受体、抗原处理与提呈、自身免疫性甲状腺病、卵母细胞成熟分裂、细胞周期等功能通路中;低风险组主要富集在1型糖尿病、产生IgA的肠道免疫网络、系统性红斑狼疮等功能通路中(图7)。

图7 基于CMS构建的预后模型得到高、低风险组基因富集通路Fig.7 Gene enrichment analysis of high and low risk groups based on CMS risk score
2.5 免疫浸润分析 为研究膀胱癌中肿瘤浸润免疫细胞含量情况,使用CIBERSORT算法计算TME浸润免疫细胞。蓝色为高风险组,红色为低风险组。如图8所示,差异浸润免疫细胞组分的箱形图显示,CD8+T细胞(P<0.001)、滤泡辅助性T细胞(P<0.01)、调节性T细胞(P<0.001)、活化的NK细胞(P<0.05)在低风险组中更丰富,M0巨噬细胞(P<0.001)则在高风险组浸润程度更高。

图8 高、低风险组间不同免疫细胞组成的小提琴图Fig.8 Violin plot of different immune cell components between high and low risk groups
3 讨论
作为全球范围内常见癌症之一,膀胱癌2020年报告新增病例约573 000例,男性患者多见,病死率居高不下,造成巨大社会负担[20]。因其早期诊断困难,易远处转移和复发的特点,膀胱癌患者的预后始终较差[2]。近年来,免疫治疗展现出光明前景,促使与之密切相关的TME重回大众视野[21]。ZHOU等[22]研究提示,在膀胱癌中,肿瘤浸润性B淋巴细胞的长链非编码RNA可能成为TME中的免疫细胞浸润指标,用以预测免疫治疗疗效;CHEN等[23]则从细胞焦亡方面证实了TME浸润对膀胱癌免疫治疗策略的指导意义重大。
作为TME的重要调控分子,共刺激因子已成为时下研究热点。其被证实在不同肿瘤的发展中发挥双向调控作用:TNFRSF14高表达淋巴瘤患者往往预后较差,而TNFRSF14过表达与膀胱癌细胞凋亡和增殖减慢相关[24-25]。作为预后评估指标,其已在肺腺癌、神经胶质瘤和头颈部鳞状细胞癌等恶性肿瘤中有相关研究,并取得一定进展[26-28]。而在膀胱癌中,相关研究鲜有报道。综上所述,课题组设计本研究以筛选潜在预后生物标志物,并探究共刺激因子在膀胱癌进展的可能机制。
免疫评分结果显示,TME中免疫和基质成分比例与患者临床与组织学分期密切相关:免疫评分越高,组织学分级、临床分期越高,患者预后越差,表明免疫细胞浸润在膀胱癌的进展中发挥重要作用。随后,从相关文献中选取60个与共刺激因子相关的编码基因,通过单因素和多因素Cox回归分析,筛选预后相关基因并优化模型,最终得到TNFRSF14、CD276、ICOS 3个基因,并开发了一种新的生存预测风险评分。生存分析显示,高风险组患者总生存期明显较短,存活率较低。该模型在TCGA验证组和GEO组中均得到了良好的验证。多因素Cox分析也证明,该风险评分模型是膀胱癌患者的独立预后因素。以上结果提示,基于CMS的预后模型有较好的预测准确性,筛选出的TNFRSF14、CD276、ICOS可能成为膀胱癌诊断或免疫治疗的潜在靶点。
TNFRSF14又称疱疹病毒进入介质(HVEM),作为TNFRSF家族成员之一,可与TNF家族成员LIGHT交联刺激T细胞,从而促进T细胞增殖和细胞因子产生,也可与BTLA结合,触发T细胞的抑制信号[29]。文献报道,在黑色素瘤等肿瘤中,HVEM在肿瘤细胞中的表达比PD-L1更广泛,有作为预后标志物的潜在价值[30]。WANG等[31]发现TNFRSF14可能通过Wnt-β-catenin依赖途径在膀胱癌进展中发挥作用,其可能是一种肿瘤抑制因子,与本研究结果一致。CD276也称B7-H3,是上皮-间质转化途径中的免疫检查点因子。LIU等[32]研究表明,在膀胱癌、乳腺癌等癌组织中,CD276的表达水平较癌旁组织显著上调。研究证实,CD276与CTLA-4具有协同作用,可在乳腺癌肿瘤、黑色素瘤、肝细胞癌和宫颈癌等癌症的增殖和进展方面起到关键作用[33-34]。此外,CD276也在膀胱癌中的研究取得一定进展:ZHENG等[35]研究表明,在膀胱癌中,CD276高表达者免疫治疗后预后显著优于低表达者。ICOS(CD278、AILIM、H4)属于B7-CD28/CTLA-4家族成员,在多种癌症进展发挥作用:AMATORE等[36]指出,一方面,ICOS促进细胞毒性T细胞激活,发挥抗肿瘤作用;另一方面,ICOS通过调节性T细胞增加肿瘤免疫逃逸的机会,促进肿瘤发展。数据研究表明,在非小细胞肺癌中,ICOS可显著增强CTLA-4抑制剂的疗效[37];但在黑色素瘤患者中,ICOS扩增预示着更差的预后[38]。而ICOS与膀胱癌的关系鲜有研究,LIAKOU等[39]设计术前临床试验发现,应用抗CTLA-4的单克隆抗体后,患者外周血和肿瘤组织中ICOS浓度显著增加,可反映治疗进展。本研究侧面验证ICOS可能是CTLA-4单抗发挥抗肿瘤活性的重要一环,具有用于监测和指导用药的潜在价值。
通过GSEA探索相关生物通路,结果主要富集在以下3个功能通路:ECM-受体相互作用、卵母细胞减数分裂、细胞周期。ECM是一种非细胞的三维大分子网络,由胶原蛋白,蛋白聚糖/糖胺聚糖、弹性蛋白、纤连蛋白、层状体和糖蛋白组成,其在细胞的生长、分化、存活和形态转换的过程中举足轻重[40]。ECM在TME中含量丰富,据RIEGLER等[41]研究,胶原蛋白和ECM与肿瘤细胞生物行为方面的功能密切相关。ECM在癌症等疾病中呈现混沌状态,ECM异常将促进细胞分化与转移,加速癌症进程[42]。文献报道,ECM微环境Ⅰ型胶原蛋白的变化可能会促进非肌层浸润性膀胱癌的进展[43]。细胞周期是所有生物体细胞生长和繁殖的共有过程,包括在有丝分裂期间染色体DNA的复制[44]。大量实验已证实,诱导白血病细胞的G2/M期的细胞周期停滞,可发挥抗肿瘤作用[45]。此外,多项研究表明,卵母细胞的减数分裂和细胞周期通路是膀胱癌的显著富集信号通路[46-47]。综上,课题组推测,膀胱癌细胞可能通过影响减数分裂过程,改变正常细胞周期,并诱导ECM,促进ECM-受体相互作用,完成其增殖和侵袭,而阻断细胞周期和抑制黏附信号转导可能成为膀胱癌的潜在治疗方法。
膀胱癌发生发展与免疫密不可分,免疫浸润分析结果显示,高危患者很可能处于免疫抑制状态。CD8+T细胞及滤泡辅助性T细胞浸润程度低,M0巨噬细胞浸润程度高,对肿瘤抑制力弱,且难以刺激B细胞增殖产生后续抗体。低危患者的CD8+T细胞浸润程度高,提示这些患者的抗肿瘤免疫应答可能处于相对活跃的状态,与理论分析一致。
本研究所建立的基于CMS的预后模型具有较好的预后预测准确性,但仍然具有局限之处。首先,本研究的病例均为回顾性样本,未获得前瞻性研究验证。其次,本研究主要基于TCGA和GEO在线数据库的相关数据进行研究,亚裔样本量小,分析结果具有一定的提示作用,但结论尚需结合实际情况和临床成果进一步验证。
综上所述,本研究筛选出TNFRSF14、CD276、ICOS 3个基因,它们有可能成为膀胱癌潜在的预后标志物和治疗靶点;基于CMS建立了膀胱癌患者的预后模型和临床列线图,可较为准确地预测膀胱癌患者的预后,并反映癌组织中不同免疫细胞的浸润程度,有助于膀胱癌患者早期预后评估和治疗方案选择。

