淫羊藿低糖苷组分安全性评价及其5 种主要成分的药代动力学研究
林婷婷,李小翠,邱华伟,刘中秋,朱丽君(广州中医药大学,中药学院国际中医药转化医学研究所,教育部中医药防治肿瘤转化医学研究国际合作联合实验室,广东省中医药防治肿瘤转化药学研究重点实验室,广东 广州 510006)
淫羊藿(Epimedium brevicornuMaxim.)始载于《神农本草经》,是小檗科淫羊藿属的多年生草本植物,味辛性温,归肝肾二经,为补命门、益精气、强筋骨、补肾壮阳之要药[1-2],具有极高的药用价值,临床主要用于治疗肾阳虚衰、风湿痹痛等证[3-4]。淫羊藿含有黄酮、多糖、生物碱、木脂素、萜类化合物、微量元素、脂肪酸、植物甾醇等多种成分,其中黄酮苷类成分是其最主要的活性成分[5-7]。淫羊藿黄酮苷类化合物主要有多糖苷和低糖苷两大类,其中多糖苷一般连接3个及以上糖基,低糖苷连接1个或2个糖基。
低糖苷是淫羊藿在体内的主要暴露形式。多糖苷在体内通常需经肠道菌与代谢酶作用脱去部分糖基转化为低糖苷才能被吸收入血[8-9],而且低糖苷比多糖苷具有更强的药理活性。如有研究[10]报道,与主要含多糖苷的淫羊藿提取物给药组相比,骨质疏松模型大鼠口服淫羊藿低糖苷组分后,大鼠股骨内骨保护素相对蛋白表达量增加约2倍,血清中抗酒石酸酸性磷酸酶活力显著下降约15%。在对单体成分的抗骨质疏松药效研究中,同样发现淫羊藿低糖苷药效强于多糖苷[11]。另有研究[12]表明,多糖苷朝藿定C 不能诱导成骨细胞MC3TC-E 分泌碱性磷酸酶,但低糖苷宝藿苷I、宝藿苷II、箭藿苷B、箭藿苷C均可以促进碱性磷酸酶分泌。然而,淫羊藿低糖苷组分的安全性及其成分的药代动力学特征尚未阐明。本研究旨在阐明淫羊藿低糖苷组分的安全性及组分中5种主要低糖苷成分宝藿苷Ⅰ、宝藿苷Ⅱ、箭藿苷A、箭藿苷B、箭藿苷C 的药代动力学特征,为淫羊藿的药理学研究提供参考,也为其临床安全有效应用提供理论依据。
1 材料
1.1 仪器1290 超高效液相色谱仪、6460 三重四极杆液相质谱联用仪(美国Agilent 公司);5810R 型冷冻离心机(德国Eppendorf 公司);VXE380 型超低温冰箱(美国Thermo 公司);BSA2245-CW 电子分析天平(德国Sartorius 公司);Elix Essential 15(UV)超纯水系统(美国Millipore 公司);MS3 digital 涡旋振荡器(德国IKA 集团);真空离心浓缩仪(美国Thermo公司);正置白光拍照显微镜(日本Nikon 公司);磁力搅拌器(上海舍岩仪器有限公司);超声细胞破碎仪(广州浩轩仪器设备有限公司);KH-250SP 超声清洗器(昆山禾创超声仪器有限公司)。
1.2 药物与试剂宝藿苷Ⅰ,上海源叶生物科技有限公司,纯度>98%,批号:T19D9Z77828;箭藿苷A、箭藿苷B、箭藿苷C、宝藿苷Ⅱ均购自成都普菲德生物技术有限公司,纯度均>97%,批号分别为:21051802、21051803、21051804、20071006;甘草苷,中国食品药品检定研究院,纯度>95%,批号:111610-200604;淫羊藿低糖苷组分制剂,纯度为55.65%,中国药科大学封亮教授课题组制备[13];谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate transaminase ,AST)检测试剂盒,南京建成生物工程研究所,批号分别为:20210506、20210511;色谱级乙腈、甲酸,德国Merck 公司,批号分别为:JB113430、H1913009;玉米油,上海麦克林生化科技股份有限公司,批号:C11094437;氯化钠,广州化学试剂厂,批号:P1926416;4%多聚甲醛,北京白鲨易科技有限公司,批号:21362542。
1.3 动物4~6 周龄SPF 级雄性KM 小鼠24 只(动物实验伦理编号:2021W0022)、4~6 周龄SPF 级雄性C57BL/6J 小鼠50 只(动物实验伦理编号:2021W0017 和20211106),均购于浙江维通利华实验动物技术有限公司,实验动物生产许可证:SCXK-(浙)2019-0001。实验前所有小鼠均适应性喂养1 周,给予充足的饲料和水,昼夜各半循环照明。实验前禁食12 h,自由饮水。
2 方法
2.1 淫羊藿低糖苷组分的安全性评价24 只KM 小鼠分为4组,即淫羊藿低糖苷组分低、中、高剂量组及空白对照组,每组6只。低、中、高剂量组分别灌胃1 968、2 625、3 500 mg·kg-1淫羊藿低糖苷组分(用玉米油配制),空白对照组按10 mL·kg-1灌胃玉米油。灌胃方式为一天内给药2次,时间间隔为12 h,仅灌胃1 d。连续观察7 d,记录小鼠的生理情况(精神、活动、进食、排泄等异常或死亡情况)并称量体质量。第7 天采血后,处死小鼠,解剖取肝、心、脾、肺、肾、脑和胸腺并称质量。按公式(1)和(2)分别计算各脏器的脏体比、脏脑比。血样以956g离心10 min 后分离血浆,用于ALT 和AST 含量测定。肝脏进行苏木精-伊红(HE)染色切片,在光学显微镜下观察各组小鼠肝脏组织病理变化。
2.2 5 种淫羊藿低糖苷的超高效液相色谱-串联质谱(UHPLC-MS/MS)定量方法
2.2.1色谱条件 Agilent 1290 infinity LC system 超高液相色谱系统;色谱柱为Waters ACQUITY UPLC HSS®T3 色谱柱(2.1 mm×100 mm,1.8 μm);流动相为0.1%甲酸-超纯水溶液(A)和乙腈(B);梯度洗脱:0~1 min,20%~40% B;1~2.5 min,40%~80% B;2.5~3.5 min,80%~90% B;3.5~4.5 min,90%~20% B;柱温为30 ℃;流速为0.4 mL·min-1;进样体积为5 μL。
2.2.2质谱条件 Agilent 6460 三重四级杆质谱;电喷雾离子源;采用正、负离子切换模式;多重反应监测(MRM)模式采集数据;毛细管电压为3.5 kV;干燥气温度为300 ℃;喷嘴电压为500 V;鞘气温度为250 ℃;氮气体积流量为5 mL·min-1;鞘气体积流量为12 mL·min-1。定量分析的离子对:宝藿苷Ⅰ(m/z515.5→369.4),宝藿苷Ⅱ(m/z501.5→355.5),箭藿苷A(m/z677.6→369.6),箭藿苷B(m/z647.6→369.6),箭藿苷C(m/z661.1→369.1),及内标甘草苷(m/z417.4→255.4)。宝藿苷Ⅰ、宝藿苷Ⅱ、箭藿苷A、箭藿苷B、箭藿苷C 及甘草苷的碎裂电压分别为112、135、118、114、52 和140 eV,碰撞能分别为8、8、14、8、8和18 eV。
2.2.3方法学考察 按照文献方法[14-15]对测定血浆中5 种低糖苷含量的UHPLC-MS/MS 方法进行方法学验证。小鼠空白血浆、小鼠空白血浆加入5种低糖苷混合对照品溶液以及小鼠灌胃5种低糖苷60 min后的血浆,3 种样品经过沉淀蛋白、离心、挥干、复溶、进样后,获得3个血浆样品的色谱图,用以考察方法的专属性。再取空白小鼠血浆加入5种淫羊藿低糖苷混合对照品溶液,配制成1 250、625、312.5、156.25、78.12、39.09、19.53、9.76、4.88、2.44、1.22 ng·mL-1系列浓度的血浆样品,经前处理后,应用UHPLCMS/MS 进行分析,建立标准曲线并计算回归方程和相关系数。同法配制1.22、78.125 和1 250 ng·mL-13 个浓度的低糖苷质控样品,用于精密度、准确度、基质效应、提取回收率、稳定性(室温环境放置4 h,-20 ℃储存1周及反复冻融3次)考察。
2.3 淫羊藿低糖苷组分中5 种低糖苷的含量测定精密称取淫羊藿低糖苷组分175 mg,用2 mL 玉米油溶解,超声30 min,再超声破碎2~3 min,磁力搅拌过夜。用甲醇稀释成1.00 mg·mL-1,再用50%乙腈溶液分别稀释成100 倍和1 000 倍,分别取10 μL 稀释液加入90 μL 含500 nmol·L-1甘草苷的纯乙腈溶液,涡旋30 s,4 ℃、20 817g离心30 min 后取上清应用UHPLC-MS/MS进行含量测定。
2.4 5 种淫羊藿低糖苷在C57BL/6J 小鼠上的药代动力学研究C57BL/6J小鼠50只,分为10组,每组5 只,其中5组分别尾静脉注射0.15 mg·kg-1宝藿苷Ⅰ和1 mg·kg-1宝藿苷Ⅱ、箭藿苷B、箭藿苷C 以及2 mg·kg-1箭藿苷A,另外5 组分别灌胃52.5 mg·kg-1宝藿苷Ⅰ、宝藿苷Ⅱ、箭藿苷A、箭藿苷B及40 mg·kg-1箭藿苷C。注射或灌胃后于0、5、15、30、60、120、180、240、360、480、720 min 时间点采血,存于含1 000 U 肝素钠的1.5 mL 管中,956g离心10 min后分离血浆,贮存于-20 ℃备用。
2.5 血浆样品处理取10 μL 血浆加入10 μL 50%乙腈溶液涡旋30 s,再加入180 μL 含500 nmol·L-1甘草苷的纯乙腈溶液,涡旋4 min 后4 ℃、20 817g离心15 min,取180 μL 上清真空干燥。加入50 μL 50%乙腈溶液复溶,涡旋4 min 后4 ℃、20 817g离心30 min,取上清液进行UHPLC-MS/MS定量分析。
2.6 数据处理与统计学分析使用WinNonlin®3.3(Pharsight Corp,USA)软件拟合药时曲线,计算药代动力学参数。采用GraphPad Prism 8 软件作图。采用SPSS 21.0 软件对实验数据进行统计学分析,各组的计量资料用均数±标准差(±s)表示,计量资料采用正态分布及方差齐性检验,若符合正态分布且方差齐,则采用独立样本t检验;若符合正态分布但方差不齐,则采用校正t’检验;若不符合正态分布,则采用非参数Mann-WhitneyU检验。P<0.05 为差异有统计学意义。
3 结果
3.1 淫羊藿低糖苷组分安全性评价
3.1.1各组小鼠的生理情况 实验结果显示灌胃不同剂量淫羊藿低糖苷组分或玉米油后,各组小鼠均没有出现明显中毒或者死亡现象。第1 到第3 天各组小鼠进食减少,各实验组小鼠会出现活动减少、粪便干涩的情况;第4 天到第7 天各组小鼠的进食和活动情况均能恢复正常。7 d内各组小鼠体质量都呈现正常增长趋势,3 个实验组与空白对照组比较均无显著性差异。见图1。

图1 灌胃低、中、高剂量淫羊藿低糖苷组分或玉米油后小鼠第1 到第7 天的体质量Figure 1 Body mass of mice at day 1 to 7 after administration of low-,medium-and high-doses of low glucoside composites of Epimedii Folium or corn oil
3.1.2各组小鼠的脏器质量、脏体比和脏脑比 灌胃后各组小鼠的脏器质量、脏体比、脏脑比结果如图2所示。与空白对照组相比,灌胃后淫羊藿低糖苷中、高剂量组(2 625 和3 500 mg·kg-1)小鼠的脏器质量、脏体比和脏脑比差异均无统计学意义(P>0.05)。低剂量药物组的肝脏质量、肝体比、肝脑比与空白对照组相比差异有统计学意义(P<0.05),但仅有肝脏存在差异,且不呈剂量依赖,故考虑与动物个体差异或操作误差有关。

注:与空白对照组相比,*P<0.05图2 灌胃低、中、高剂量淫羊藿低糖苷组分或玉米油第7 天后,各组小鼠的脏器质量(A)、脏体比(B)、脏脑比(C)(±s,n=6)Figure 2 The organ mass(A),the visceral/body ratio(B)and the visceral/brain ratio(C)in each group of mice after intragastric administration of corn oil and low-,medium-and high-doses of low glucoside composites of Epimedii Folium for 7 days(±s,n=6)
3.1.3各组小鼠的肝损伤情况 各组小鼠血浆中ALT和AST 含量结果如图3 所示,3 个不同剂量实验组小鼠血浆中的ALT、AST 含量与空白对照组相比差异均无统计学意义(P>0.05)。肝脏的HE染色切片结果如图4 所示,空白对照组小鼠的肝组织细胞大小正常、排列紧密,胞核呈圆形,肝索结构清晰,界限明显,着色均匀。与空白对照组相比,3 个不同剂量实验组小鼠肝脏切片中细胞大小一致,胞核呈圆球形,肝索结构及肝细胞排列情况均无明显变化。

图3 灌胃低、中、高剂量淫羊藿低糖苷组分或玉米油第7 天后,血浆中ALT(A)和AST(B)的含量(±s,n=6)Figure 3 The content of ALT(A)and AST(B)enzymes in plasma of mice after intragastric administration of low-,medium-,and high-doses of low glucoside composites of Epimedii Folium or corn oil for 7 days(±s,n=6)
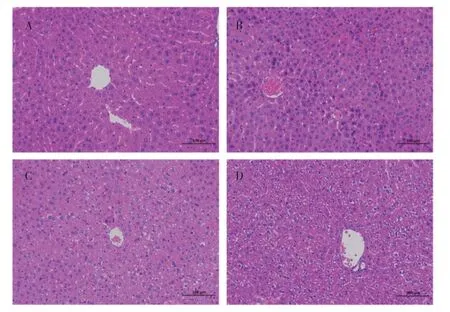
图4 灌胃玉米油(A)和低(B)、中(C)、高(D)剂量淫羊藿低糖苷组分7 d 后小鼠肝脏HE 染色切片图(×200)Figure 4 HE staining slice diagrams of mice livers after intragastric administration of corn oil or low-,medium-,and high dose of low glucoside composites of Epimedii Folium for 7 days(×200)
3.2 方法学考察
3.2.1专属性 小鼠血浆中5 种淫羊藿低糖苷及内标甘草苷的色谱图见图5。色谱图中显示,各化合物的检测均不受小鼠血浆中物质的干扰。宝藿苷Ⅰ、宝藿苷Ⅱ、箭藿苷A、箭藿苷B、箭藿苷C 及甘草苷的保留时间分别为2.9、2.5、2.6、2.7、2.7、1.6 min。5 种低糖苷与内标分离良好,且各化合物的峰形对称,无拖尾现象。
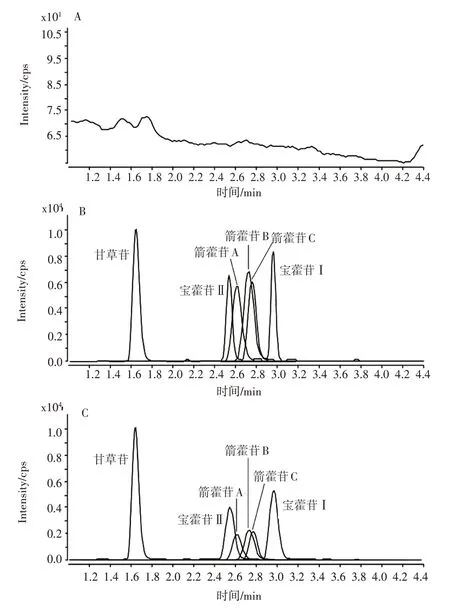
图5 空白血浆(A)、空白血浆加5 种低糖苷及甘草苷(内标)标准品(B)、小鼠灌胃5 种淫羊藿低糖苷60 min 后血浆样品(C)的MRM 色谱图Figure 5 MRM chromatograms of blank plasma(A), blank plasma spiked with five low glycosides standard and liquiritin internal standard(B),plasma samples of mice after gavage of five low glycoside composites of Epimedii Folium for 60 min(C)
3.2.2定量下限与线性范围 5种淫羊藿低糖苷的标准曲线、线性范围及定量下限见表1。结果表明5 种淫羊藿低糖苷的定量下限均为1.22 ng·mL-1,并且在1.22~1 250.00 ng·mL-1浓度范围内5种低糖苷线性良好,相关系数(r)均大于0.99。

表1 血浆中5 种淫羊藿低糖苷的标准曲线、线性范围及定量下限Table 1 The regression equations,linear range,the lower limit of quantitation of five low glycoside components of Epimedii Folium in plasma
3.2.3精密度和准确度 结果见表2。5种淫羊藿低糖苷的日内精密度在1.67%~13.53%之间,日间精密度在4.17%~13.34% 之间;日内准确度在89.14%~113.31%之间,日间准确度在92.85%~112.17%之间。5 种低糖苷的日内精密度、准确度和日间精密度、准确度都在标示值的±15%以内,表明方法的重复性和准确度良好。
表2 血浆中5 种淫羊藿低糖苷UHPLC-MS/MS 方法的精密度、准确度(±s,n=6)Table 2 Precision and accuracy of UHPLC-MS/MS method for 5 low glucosides of Epimedii Folium in plasma(±s,n=6)
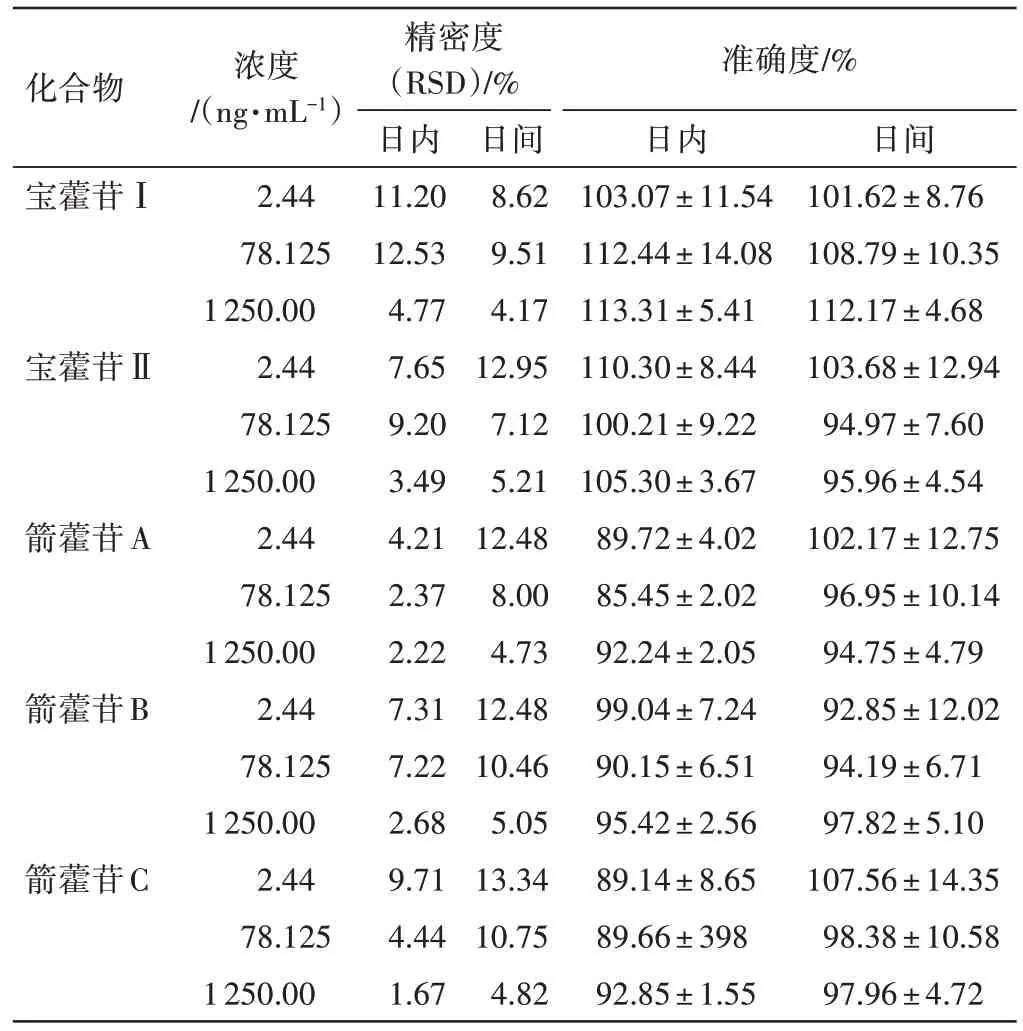
表2 血浆中5 种淫羊藿低糖苷UHPLC-MS/MS 方法的精密度、准确度(±s,n=6)Table 2 Precision and accuracy of UHPLC-MS/MS method for 5 low glucosides of Epimedii Folium in plasma(±s,n=6)
化合物宝藿苷Ⅰ宝藿苷Ⅱ箭藿苷A箭藿苷B箭藿苷C浓度/(ng·mL-1)2.44 78.125 1 250.00 2.44 78.125 1 250.00 2.44 78.125 1 250.00 2.44 78.125 1 250.00 2.44 78.125 1 250.00精密度(RSD)/%日内11.20 12.53 4.77 7.65 9.20 3.49 4.21 2.37 2.22 7.31 7.22 2.68 9.71 4.44 1.67日间8.62 9.51 4.17 12.95 7.12 5.21 12.48 8.00 4.73 12.48 10.46 5.05 13.34 10.75 4.82准确度/%日内103.07±11.54 112.44±14.08 113.31±5.41 110.30±8.44 100.21±9.22 105.30±3.67 89.72±4.02 85.45±2.02 92.24±2.05 99.04±7.24 90.15±6.51 95.42±2.56 89.14±8.65 89.66±398 92.85±1.55日间101.62±8.76 108.79±10.35 112.17±4.68 103.68±12.94 94.97±7.60 95.96±4.54 102.17±12.75 96.95±10.14 94.75±4.79 92.85±12.02 94.19±6.71 97.82±5.10 107.56±14.35 98.38±10.58 97.96±4.72
3.2.4提取回收率及基质效应 结果见表3。血浆中5 种淫羊藿低糖苷的提取回收率和基质效应分别在92.01%~113.81%、94.75%~113.71%之间,均在标示值的±15%以内。
表3 血浆中5 种淫羊藿低糖苷UHPLC-MS/MS 方法的提取回收率及基质效应(±s,n=4)Table 3 The matrix effects,extraction recoveries of UHPLC-MS/MS method for 5 low glucosides of Epimedii Folium in plasma(±s,n=4)

表3 血浆中5 种淫羊藿低糖苷UHPLC-MS/MS 方法的提取回收率及基质效应(±s,n=4)Table 3 The matrix effects,extraction recoveries of UHPLC-MS/MS method for 5 low glucosides of Epimedii Folium in plasma(±s,n=4)
化合物宝藿苷Ⅰ宝藿苷Ⅱ箭藿苷A箭藿苷B箭藿苷C浓度/(ng·mL-1)2.44 78.125 1 250.00 2.44 78.125 1 250.00 2.44 78.125 1 250.00 2.44 78.125 1 250.00 2.44 78.125 1 250.00提取回收率/%112.78 ± 21.43 95.94 ± 48.19 113.81 ± 12.41 103.07 ± 12.66 96.26 ± 13.62 112.18 ± 13.81 93.33 ± 8.42 92.01 ± 7.07 112.19 ± 10.10 103.72 ± 19.42 104.31 ± 25.06 110.55 ± 6.89 98.86 ± 15.92 92.95 ± 6.86 113.92 ± 12.99基质效应/%94.75 ± 17.87 108.35 ± 13.78 107.37 ± 8.80 103.83 ± 17.96 110.06 ± 11.04 100.55 ± 11.48 112.30 ± 16.25 107.97 ± 6.28 97.95 ± 10.41 109.78 ± 18.06 109.20 ± 7.81 101.31 ± 10.9 113.71 ± 17.33 109.49 ± 5.91 99.24 ± 10.01
3.2.5稳定性 5种淫羊藿低糖苷在3种不同条件下的稳定性结果见表4。5 种低糖苷的不同浓度样品分别放置室温4 h、-20 ℃储存1 周和反复冻融3 次后的RSD 都小于15%,说明5 种低糖苷在这3 种情况下有足够的稳定性,不影响样品的后续含量测定。
表4 血浆中5 种淫羊藿低糖苷UHPLS-MS/MS 检测方法的稳定性(±s,n=4)Table 4 The stability of UHPLC-MS/MS method for 5 low glucosides of Epimedii Folium in plasma(±s,n=4)

表4 血浆中5 种淫羊藿低糖苷UHPLS-MS/MS 检测方法的稳定性(±s,n=4)Table 4 The stability of UHPLC-MS/MS method for 5 low glucosides of Epimedii Folium in plasma(±s,n=4)
化合物宝藿苷Ⅰ宝藿苷Ⅱ箭藿苷A箭藿苷B箭藿苷C浓度/(ng·mL-1)2.44 78.125 1 250.00 2.44 78.125 1 250.00 2.44 78.125 1 250.00 2.44 78.125 1 250.00 2.44 78.125 1 250.00 RSD/%室温(4 h)12.50 7.58 9.87 12.79 6.25 7.71 5.14 3.80 2.89 4.80 7.30 4.02 7.42 5.60 3.39-20 ℃储存1周12.24 7.45 8.53 9.70 10.26 7.65 7.14 2.70 2.33 6.98 11.44 4.51 11.44 2.05 3.52 3个冻融循环14.40 9.42 9.26 6.80 5.64 8.19 6.02 3.18 9.80 6.99 11.72 3.83 8.37 1.90 3.37
3.3 淫羊藿低糖苷组分中5 种低糖苷的含量5 种低糖苷在淫羊藿低糖苷组分中的含量及占比见图6。宝藿苷Ⅰ、宝藿苷Ⅱ、箭藿苷A、箭藿苷B 和箭藿苷C在淫羊藿低糖苷组分中的含量分别为243.85、5.72、31.21、179.60、96.12 mg·g-1,5种低糖苷总含量占淫羊藿低糖苷组分总量的55.65%。

图6 宝藿苷Ⅰ、宝藿苷Ⅱ、箭藿苷A、箭藿苷B、箭藿苷C 在淫羊藿低糖苷组分中的含量(A)及占比(B)(±s,n=4)Figure 6 The content(A)and proportion(B)of baohuoside I,baohuoside Ⅱ,sagittatoside A,sagittatoside B,and sagittatoside C in low glucoside componsites of Epimedii Folium(±s,n=4)
3.4 5 种淫羊藿低糖苷在C57BL/6J 小鼠上的药代动力学小鼠尾静脉注射5种淫羊藿低糖苷单体后平均血药浓度-时间曲线如图7 所示,药动学参数如表5 所示。尾静脉注射宝藿苷Ⅰ0.15 mg·kg-1和宝藿苷Ⅱ、箭藿苷B、箭藿苷C 各1 mg·kg-1以及箭藿苷A 2 mg·kg-1后,它们的血浆暴露量低,药时曲线下面积(AUC0-t)值分别为4.82、82.54、276.64、88.77、178.02 min·μg·mL-1;且它们的消除快,仅15 min 内血浆中的浓度分别下降86.5%、96.3%、94.4%、96.7%、93.4%,半衰期(t1/2)分别为60.42、115.27、67.63、131.61、129.87 min,平均驻留时间(MRT0-t)分别为31.95、60.05、15.64、35.52、30.09 min。
表5 小鼠静脉注射5 种淫羊藿低糖苷的药代动力学参数(±s,n=5)Table 5 Pharmacokinetic parameters of five low glycosides of Epimedii Folium in mice after intravenous injection(±s,n=5)
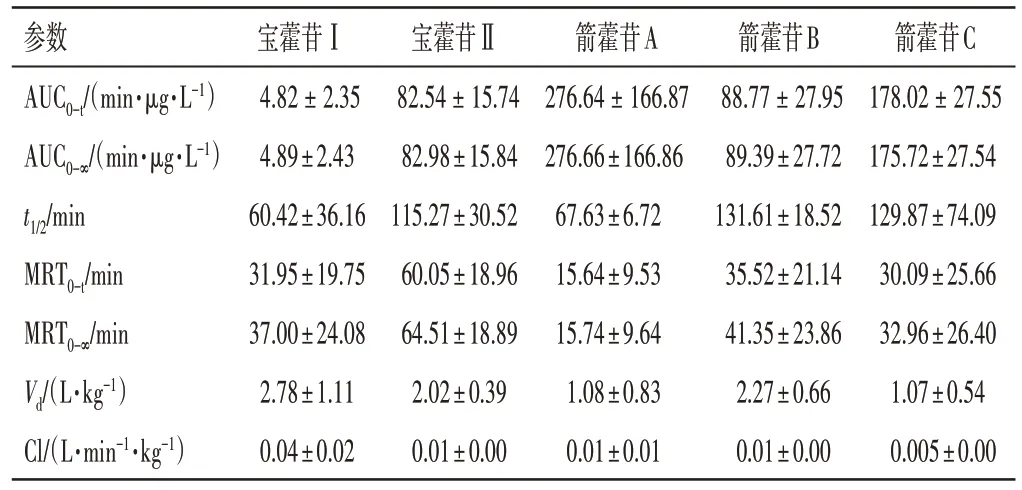
表5 小鼠静脉注射5 种淫羊藿低糖苷的药代动力学参数(±s,n=5)Table 5 Pharmacokinetic parameters of five low glycosides of Epimedii Folium in mice after intravenous injection(±s,n=5)
参数AUC0-t/(min·μg·L-1)AUC0-∞/(min·μg·L-1)t1/2/min MRT0-t/min MRT0-∞/min Vd/(L·kg-1)Cl/(L·min-1·kg-1)宝藿苷Ⅰ4.82±2.35 4.89±2.43 60.42±36.16 31.95±19.75 37.00±24.08 2.78±1.11 0.04±0.02宝藿苷Ⅱ82.54±15.74 82.98±15.84 115.27±30.52 60.05±18.96 64.51±18.89 2.02±0.39 0.01±0.00箭藿苷A 276.64±166.87 276.66±166.86 67.63±6.72 15.64±9.53 15.74±9.64 1.08±0.83 0.01±0.01箭藿苷B 88.77±27.95 89.39±27.72 131.61±18.52 35.52±21.14 41.35±23.86 2.27±0.66 0.01±0.00箭藿苷C 178.02±27.55 175.72±27.54 129.87±74.09 30.09±25.66 32.96±26.40 1.07±0.54 0.005±0.00

图7 小鼠静脉注射(iv)5 种淫羊藿低糖苷后的体内血药浓度-时间曲线(±s,n=5)Figure 7 Mean plasma concentration-time profiles of five low glycosides of Epimedii Folium in mice after intravenous injection(±s,n=5)
小鼠灌胃5 种淫羊藿低糖苷单体后平均血药浓度-时间曲线如图8 所示,药动学参数如表6 所示。灌胃后,宝藿苷Ⅰ、宝藿苷Ⅱ、箭藿苷A、箭藿苷B、箭藿苷C 可被小鼠迅速吸收,达峰时间(tmax)分别为21.00、78.00、78.00、30.00、28.00 min,但它们的吸收程度较低,峰浓度(Cmax)值分别为147.23、86.76、15.58、24.34、26.12 ng·mL-1,AUC0-t值分别为31.64、18.59、3.48、2.41、2.42 min·μg·mL-1。5 种低糖苷的口服生物利用度分别为1.91%、0.51%、0.05%、0.06%、0.04%。
表6 小鼠灌胃5 种淫羊藿低糖苷的药代动力学参数(±s,n=5)Table 6 Pharmacokinetic parameters of the five low glycosides of Epimedii Folium in mice after oral administration(±s,n=5)

表6 小鼠灌胃5 种淫羊藿低糖苷的药代动力学参数(±s,n=5)Table 6 Pharmacokinetic parameters of the five low glycosides of Epimedii Folium in mice after oral administration(±s,n=5)
参数AUC0-t/(min·μg·L-1)AUC0-∞/(min·μg·L-1)tmax/min Cmax/(ng·mL-1)t1/2/min MRT0-t/min MRT0-∞/min Vd/(L·kg-1)Cl//(L·min-1·kg-1)F/%宝藿苷Ⅰ31.64±3.61 32.79±3.03 21.00±8.21 147.23±19.03 133.44±51.46 224.15±12.13 251.17±41.15 314.73±3.03 1.61±0.15 1.91±0.17宝藿苷Ⅱ18.59±7.56 22.24±8.52 78.00±58.48 86.76±47.46 288.84±158.01 258.86±37.35 437.10±214.98 1 216.31±1 155.67 2.64±0.97 0.51±0.19箭藿苷A 3.48±0.27 4.11±0.42 78.00±40.25 15.58±2.93 251.12±86.59 237.69±38.63 363.59±105.03 4 537.98±1 252.54 12.87±1.41 0.05±0.01箭藿苷B 2.41±0.26 2.84±0.36 30.00±0.00 24.34±12.29 285.73±94.96 221.48±18.63 364.35±104.89 7 563.27±1 911.00 18.68±2.30 0.06±0.01箭藿苷C 2.42±1.56 2.75±1.64 28.00±20.79 26.12±8.21 171.40±80.65 144.13±84.76 230.15±86.86 4 137.80±2 282.28 19.02±9.71 0.04±0.02
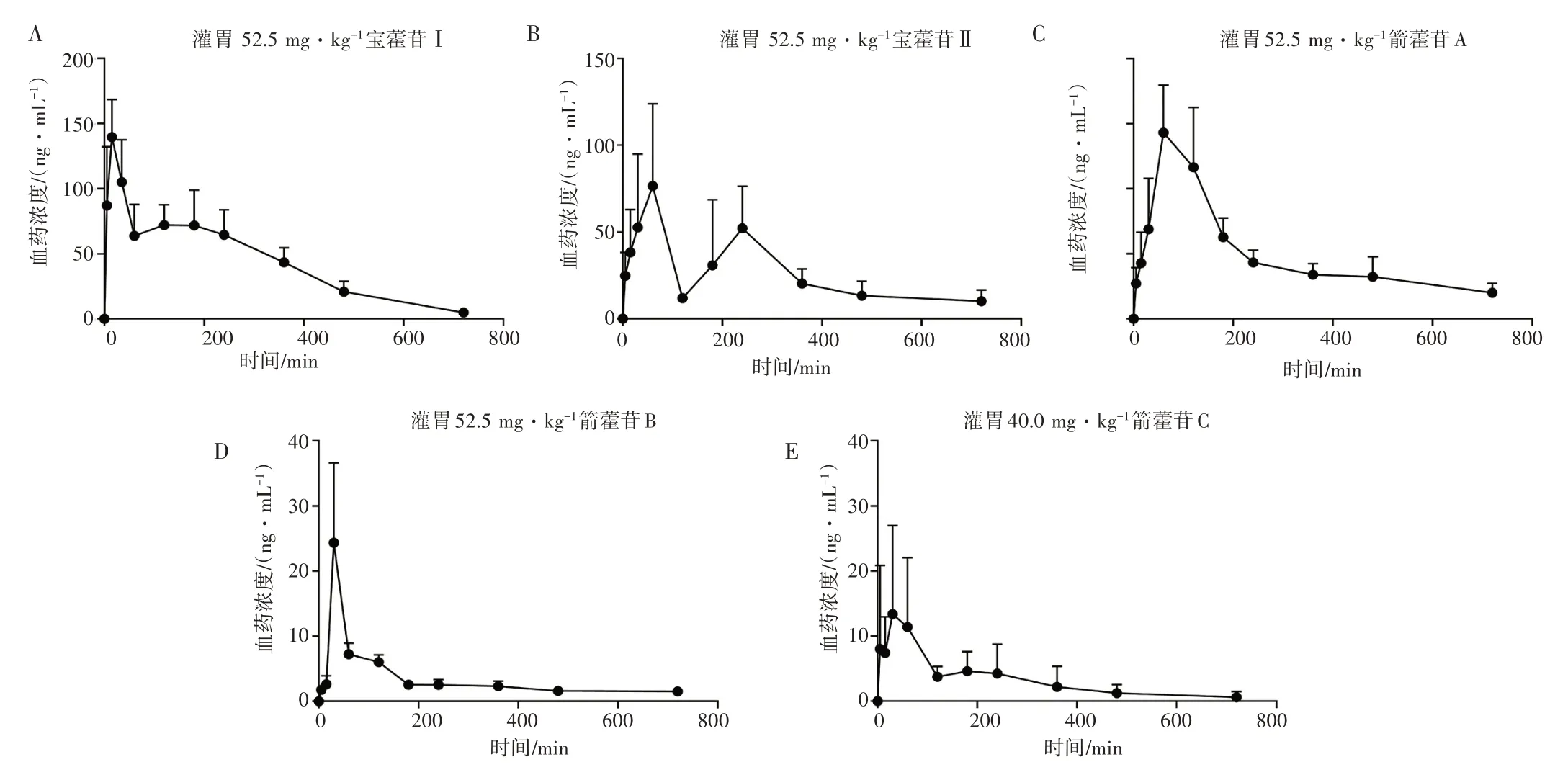
图8 小鼠灌胃5 种淫羊藿低糖苷后体内血药浓度-时间曲线(±s,n=5)Figure 8 Mean plasma concentration-time profiles of five low glycosides of Epimedii Folium in mice after oral administration(±s,n=5)
4 讨论
淫羊藿低糖苷是淫羊藿在体内的主要暴露形式。本研究主要考察淫羊藿低糖苷组分的安全性及其5种低糖苷成分宝藿苷Ⅰ、宝藿苷Ⅱ、箭藿苷A、箭藿苷B、箭藿苷C 的药代动力学特征。本实验结果表明,淫羊藿低糖苷组分的安全性高,在1 968、2 625、3 500 mg·kg-1剂量下,均没有观察到明显肝毒性。现代药理学认为,中药或其组分的安全性以小鼠能耐受人用量的100 倍以上为安全[16]。本实验考察了淫羊藿低糖苷组分在1 968、2 625、3 500 mg·kg-1剂量下的安全性,分别相当于50 kg 成人每日用量的231、308、411倍。在这3个剂量下,小鼠整体上均无明显中毒反应和死亡情况,生长状况良好,体质量增长情况与空白对照组相比无显著性差异。脏体比在一定程度上能反映药物对机体内某种脏器的影响,脏体比增大表示脏器充血、水肿或增生肥大等;脏体比减小表示脏器萎缩及其他退行性改变[17]。在2 625 和3 500 mg·kg-1剂量下小鼠各脏器的质量、脏体比和脏脑比与空白对照组相比均无显著性差异。但灌胃1 968 mg·kg-1淫羊藿低糖苷组分小鼠的肝脏质量、肝体比、肝脑比与空白对照组存在差异,提示淫羊藿低糖苷组分可能存在潜在肝毒性,因此本研究进一步考察了淫羊藿低糖苷的肝毒性。血浆中ALT和AST的含量是判断药物是否具有肝损伤的敏感及特异性指标[18],若机体出现肝损伤现象肝细胞会将转氨酶排出,血浆中ALT 和AST 的含量将升高,而病理切片能直观反映靶器官的损伤情况。结果表明,与空白对照组相比,小鼠灌胃3 个不同剂量淫羊藿低糖苷组分后血浆中ALT 和AST 含量均无显著性差异,同时肝组织切片均无明显病理变化。这表明淫羊藿低糖苷组分具有较高的安全性,在3 500 mg·kg-1剂量下无明显毒性,也没有观察到肝损伤现象。综上,低剂量组的肝脏质量等出现显著差异,可能是由于小鼠个体差异、操作误差所产生,并无实际意义。
本研究建立并验证了一种能快速、灵敏定量5 种淫羊藿低糖苷成分的UHPLC-MS/MS 方法,并成功应用于药代动力学研究。实验结果表明,5 种低糖苷成分在小鼠体内吸收快、消除迅速,但吸收程度低,口服生物利用度不高。口服后5种淫羊藿低糖苷在小鼠体内的血药浓度-时间曲线均呈现经典的“双峰”现象,表明这5种淫羊藿低糖苷经肠道吸收后在体内经历肠肝循环[19]。宝藿苷Ⅰ、宝藿苷Ⅱ、箭藿苷A、箭藿苷B、箭藿苷C 灌胃后均可被小鼠迅速吸收,血药浓度达峰时间分别为21.00、78.00、78.00、30.00、28.00 min。此外,静脉注射15 min内5种低糖苷的血药浓度就下降了86.5%~96.7%,消除半衰期分别为60.42、115.27、67.63、131.61、129.87 min。5 种低糖苷的吸收程度较低,Cmax值分别为147.23、86.76、15.58、24.34、26.12 ng·mL-1,AUC0-t值分别为31.64、18.59、3.48、2.41、2.42 min·μg·mL-1。宝藿苷Ⅰ、宝藿苷Ⅱ、箭藿苷A、箭藿苷B、箭藿苷C 的口服生物利用度分别为1.91%、0.51%、0.05%、0.06%、0.04%。黄酮苷类化合物结构上连接的糖基数越少,极性越小,越容易被吸收入血。在这5个低糖苷成分中,宝藿苷Ⅰ和宝藿苷Ⅱ结构上只连接1个糖基,而箭藿苷A、箭藿苷B 和箭藿苷C 结构上均连接2 个糖基,这也是宝藿苷Ⅰ和宝藿苷Ⅱ的口服生物利用度显著高于箭藿苷A、箭藿苷B和箭藿苷C的原因。
综上,本研究表明淫羊藿低糖苷组分安全性高,在3 500 mg·kg-1剂量下无明显毒性,也没有观察到肝损伤现象。同时发现5种淫羊藿低糖苷成分在小鼠体内吸收迅速,消除快、生物利用度不高。研究结果可为淫羊藿的药理学研究提供参考,也为其临床安全有效应用提供理论依据。

