基于PPAR-γ/NF-κB 信号通路探讨肺心汤对野百合碱诱导肺动脉高压大鼠模型的作用及机制
谭骏岚,易健,曹闲雅,王飞英,丁蓉珍,戴爱国,5
(1.湖南中医药大学中西医结合学院,湖南 长沙 410208;2.血管生物学与转化医学湖南省重点实验室,湖南 长沙 410208;3.湖南中医药大学第一附属医院医学创新实验中心,湖南 长沙 410021;4.湖南中医药大学医学院呼吸疾病研究室,湖南 长沙 410208;5.湖南中医药大学第一附属医院呼吸科,湖南 长沙 410021)
肺动脉高压(Pulmonary arterial hypertension,PAH)是一种进行性的血管闭塞性疾病,可导致肺血管阻力和肺动脉压进行性增加,最终引起患者右心室功能衰竭和死亡[1]。肺血管重塑是PAH 的主要病理特征,而炎症反应的过度激活是诱导肺血管重塑发生的关键。过氧化物酶体增殖物激活受体γ(Peroxisome proliferator-activated receptor-γ,PPAR-γ)属于核受体超家族的配体激活转录因子,在调节炎症反应中发挥重要作用[2]。PPAR-γ 激活可抑制核因子κB(Nuclear factor kappa-B,NF-κB)的转录激活,从而抑制炎症反应[3-4]。研究[5-7]表明,PPAR-γ/NF-κB 信号通路在PAH 的发生发展中发挥了重要作用,与细胞增殖、炎症反应及肺血管重塑密切相关。因此,基于PPAR-γ/NF-κB 信号通路探讨炎症反应和肺血管重塑有助于阐明PAH的发病机制。
目前PAH 尚缺乏特效治疗手段,而中医药在治疗PAH 方面具有独特优势[8]。PAH 属于中医“肺胀”“胸痹”范畴,属本虚标实之证,其本为肺气亏虚,其标在于痰阻、饮停、瘀血,治宜补肺、化痰、祛瘀、利水。肺心汤是本课题组基于PAH“本虚标实”的核心病机所创立的经验方,具有益气补肺、活血祛瘀、化痰利水之功效。前期临床研究[9-10]显示,肺心汤能改善PAH 患者的临床症状及体征,同时降低其血清炎症因子水平,但具体作用机制有待深入研究。故本研究拟采用百合碱诱导PAH 大鼠模型,基于PPAR-γ/NF-κB 信号通路探讨肺心汤抗PAH 的效应及调控机制。
1 材料与方法
1.1 动物雄性SD 大鼠48 只,6~7 周龄,SPF 级,体质量(200±20)g ,购自湖南斯莱克景达实验动物公司,实验动物生产许可证号:SCXK(湘)2019-0004。动物饲养于湖南中医药大学第一附属医院动物实验中心,实验动物使用许可证号:SYXK(湘)2020-0010;饲养条件:温度25 ℃,湿度40%~60%,大鼠自由进食、饮水,适应性饲养1周。本动物实验经湖南中医药大学第一附属医院动物实验伦理委员会批准,批文号:ZYFY20211008-57。
1.2 药物及试剂肺心汤处方:桃仁10 g、红花10 g、葶苈子10 g、赤芍10 g、知母9 g、茯苓15 g、白术12 g、白参6 g、生黄芪18 g、制附子4 g、车前子15 g、麦冬12 g,中药饮片购自湖南中医药大学第一附属医院,经湖南中医药大学第一附属医院龙红萍副研究员鉴定合格。肺心汤按传统水提法浓缩成生药含量分别为1.17、2.34、4.68 g·mL-1的药液,4 ℃冰箱冷藏、备用。枸橼酸西地那非片(批号:20210411),美国辉瑞制药公司,用蒸馏水配制成2.5 mg·mL-1的药液,冷藏备用。野百合碱(批号:HY-N075),美国MCE 公司,用无水乙醇-生理盐水(2∶8)溶解,配制成1%浓度备用。白细胞介素1β(IL-1β,批号:ERC007)、IL-6(批号:ERC003)、肿瘤坏死因子α(TNF-α,批号:ERC102a)ELISA 检测试剂盒,均购自深圳欣博盛生物科技公司;α 平滑肌肌动蛋白(α-SMA,批号:67735-1-Ig)、PPAR-γ(批号:66936-1-Ig)、IκB-α(批号:10268-1-AP)、NF-κB(批号:10745-1-AP)、β-actin抗体(批号:66009-1-Ig),均购自武汉三鹰生物公司;p-NF-κB 抗体(批号:AF2006),江苏亲科生物科技公司;二抗羊抗小鼠IgG-HRP(批号:BL001A)、羊抗兔IgG-HRP(批号:BL003A),均购自合肥白鲨生物科技公司。
1.3 主要仪器MP160 型多通道电生理记录仪,美国BIOPAC公司;小动物B超机,苏州飞依诺科技公司;SP5 Ⅱ型共聚焦显微镜,德国Leica 公司;Mini-PROTEAN®Tetra 电泳槽、ChemiDoc XRS+Imager 型化学发光系统,美国Bio-Rad公司;Enspire型多功能酶标仪,美国Perkinelmer公司;RWD510型小动物麻醉机,深圳瑞沃德科技公司;Micro 21R 型微量低温高速离心机,美国赛默飞世尔科技公司;BX43 型正置显微镜,日本奥林巴斯公司。
1.4 模型复制、分组及给药将48 只大鼠随机分为正常组(8只)和造模组(40只)。造模组大鼠单次腹腔注射60 mg·kg-1野百合碱溶液[11]诱导PAH 模型,正常组大鼠注射等体积的乙醇-生理盐水。将造模后的大鼠再随机分为模型组、西地那非组、肺心汤低剂量组、肺心汤中剂量组和肺心汤高剂量组,每组8 只。根据70 kg人体表面积比值换算动物给药剂量,肺心汤低、中、高剂量组大鼠给予11.7、23.4、46.8 g·kg-1肺心汤药液灌胃;西地那非组大鼠给予0.025 g·kg-1(成人等效剂量)西地那非药液灌胃[12];正常组及模型组给予等体积蒸馏水灌胃;分别于造模后1 h 开始灌胃给药(10 mL·kg-1),每日1次,连续28 d。
1.5 超声心动图指标检测末次灌胃1 h 后,采用异氟烷吸入麻醉大鼠。采用小动物B超机检测大鼠肺动脉加速时间(Pulmonary artery acceleration time,PAAT)、肺动脉射血时间(Pulmonary ejection time,PET)、三尖瓣环缩期位移(Tricuspid annular plane systolic excursion,TAPSE)、右心室舒张末期内径(Right ventricular internal dimension,RVIDd)、右心室前壁厚度(Right ventricular anterior wall thickness,RVAWT)等心功能指标。
1.6 血流动力学指标及右心肥厚指数检测采用经颈外静脉右心导管法[13]检测大鼠右心室收缩压(Right ventricle systolic pressure,RVSP)及平均肺动脉压(Mean pulmonary arterial pressure,mPAP)。预先调试多导生理仪,选择压力通道,连接PE-50 导管并调试设备归零;分离颈外静脉,结扎远心端;用肝素生理盐水预冲导管,从颈外静脉开一“V”字型切口,将导管经上腔静脉缓慢插至右心室,再至肺动脉;用生理记录仪记录实验结果,测得RVSP 及mPAP。测量结束后,打开大鼠腹腔,使用肝素抗凝管进行腹主动脉采血,离心后收集血浆,-80 ℃保存、备用。处死大鼠后分离心脏,称定右心室(RV)及左心室(LV)加隔膜(S)质量,计算:右心肥厚指数(RVHI,%)=RV/(LV+S)×100%。
1.7 HE 染色法观察肺小动脉病理改变取各组大鼠的左肺组织,用4%多聚甲醛溶液固定24 h,经脱水、石蜡包埋后,制备5 μm 厚度切片;进行常规苏木素-伊红(HE)染色后,在光学显微镜下(×400)观察肺小动脉病理改变。选取直径在50~100 μm 的肺小动脉进行观察、拍照,使用Image-Pro Plus 6.0 软件测量并计算:肺小动脉管壁厚度占血管直径的百分比(WT,%)=2×内壁厚度/血管直径×100%;血管壁面积占小动脉总横截面积的百分比(WA,%)=横截面内血管壁面积/血管总横截面面积×100%。
1.8 免疫荧光法检测大鼠肺动脉中α-SMA 表达水平肺组织切片脱蜡后,经过微波加热、冷却后置于硼氢化钠溶液中(室温,30 min);清洗后置于苏丹黑染液中(室温,5 min);用5% BSA 封闭60 min;添加α-SMA 一抗(1∶200),4 ℃下孵育过夜;加入山羊抗鼠IgG 荧光标记二抗(红色),于37 ℃下孵育90 min;用DAPI 工作液在37 ℃下染10 min;缓冲甘油封片,避光保存,在激光共聚焦荧光显微镜下观察,计算荧光表达阳性率(%)。
1.9 ELISA 法检测大鼠血浆IL-1β、IL-6、TNF-α水平按照ELISA试剂盒说明步骤操作,检测各组大鼠血浆IL-1β、IL-6、TNF-α 水平。采用多功能酶标仪检测各血浆样本在450 nm 波长下的光密度(OD)值,通过标准品的线性回归曲线来计算待测样本的浓度。
1.10 免疫组化法检测肺组织中PPAR-γ、NF-κB阳性表达情况每组取5 张肺组织石蜡切片(3 μm),按照免疫组化检测常规步骤处理后,分别滴加一抗PPAR-γ(1∶100)、NF-κB(1∶100),37 ℃下孵育1 h;滴加二抗工作液,37 ℃下孵育20 min;DAB 显色,苏木素复染,分化、返蓝,封片。于光学显微镜下(×200)观察,并选取阳性表达不重复的5个视野拍照记录;采用Image-Pro Plus 6.0 软件分析PPAR-γ、NF-κB阳性表达的平均光密度(OD)值。
1.11 Western Blot 法检测肺组织中PPAR-γ/NF-κB通路相关蛋白表达水平取各组大鼠适量肺组织样本,加入含RIPA、磷酸酶抑制剂及蛋白酶抑制剂的完全裂解液,充分研磨后,以4 ℃、12 000 r·min-1(离心半径=10 cm)离心15 min,取上清。采用BCA法对蛋白进行定量,上样量为50 μg 蛋白。经SDSPAGE 电泳后,转移至PVDF 膜;用5%脱脂牛奶封闭1 h 后,TBST 洗涤3 次,每次10 min。加入一抗PPAR-γ(1∶1 000)、IκB-α(1∶1 000)、NF-κB(1∶500)、p-NF-κB(1∶500)、β-actin(1∶10 000)后,在4 ℃下孵育过夜;次日,TBST 洗涤3 次,每次10 min;分别加入山羊抗兔IgG 抗体(1∶10 000)、山羊抗小鼠IgG 抗体(1∶10 000)二抗,室温下孵育1 h;TBST 洗涤3 次,每次10 min,采用ECL 发光液对蛋白进行曝光、显影;扫描蛋白条带,进行灰度值分析,以β-actin为内参,对目的蛋白进行半定量分析。
1.12 统计学处理方法采用Graphpad Prism 8.0 统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD 检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 肺心汤对PAH 大鼠血流动力学指标及RVHI 的影响结果见图1。与正常组相比,模型组大鼠的RVSP、mPAP 和RVHI 显著升高(P<0.01)。与模型组比较,各给药组大鼠的RVSP、mPAP、RVHI 均显著降低(P<0.05,P<0.01)。结果表明,肺心汤能降低野百合碱诱导的PAH 大鼠的RVSP、mPAP,并改善右心肥厚。

注:RVSP 为右心室收缩压;mPAP 为平均肺动脉压;RVHI 为右心肥厚指数;1 mm Hg=0.133 kPa。与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01图1 肺心汤对肺动脉高压大鼠RVSP、mPAP 及RVHI 的影响(±s,n=8)Figure 1 Effects of Feixin Decoction on RVSP,mPAP and RVHI of rats with pulmonary arterial hypertension(±s,n=8)
2.2 肺心汤对PAH 大鼠超声心动图指标的影响结果见图2。与正常组相比,模型组大鼠的PAAT、PAAT/PET、 TAPSE 均显著降低(P<0.01), RVIDd 及RVAWT显著升高(P<0.01)。与模型组相比,各给药组大鼠的PAAT、PAAT/PET、TAPSE均显著升高(P<0.05,P<0.01),RVIDd 和RVAWT 显著降低(P<0.05,P<0.01)。结果表明,肺心汤能改善野百合碱诱导的PAH大鼠右心功能障碍。
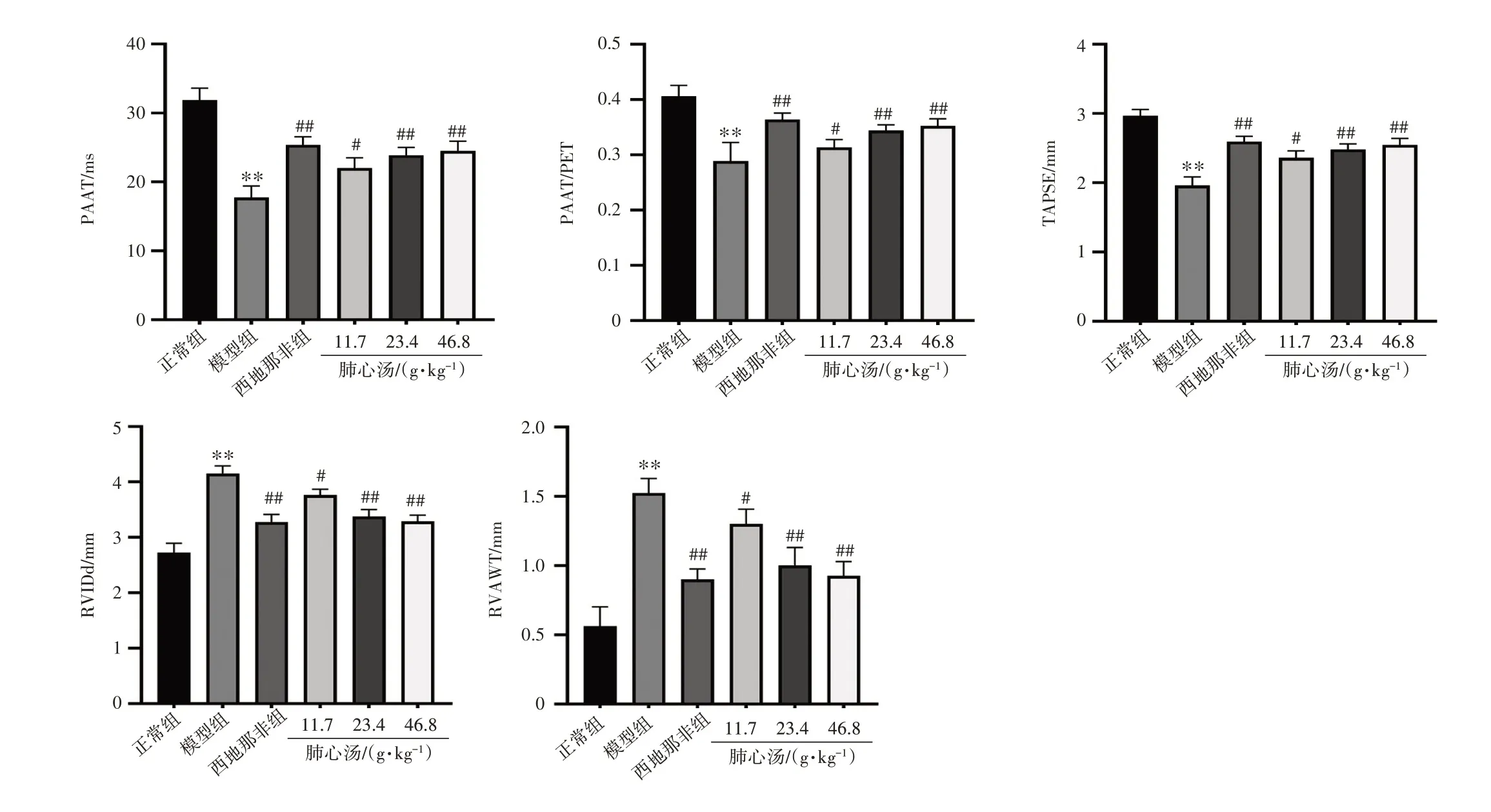
注:PAAT为肺动脉加速时间;PET为肺动脉射血时间;TAPSE为三尖瓣环缩期位移;RVIDd为右心室舒张末期内径;RVAWT 为右心室前壁厚度。与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01图2 肺心汤对肺动脉高压大鼠超声心动图指标的影响(±s,n=8)Figure 2 Effect of Feixin Decoction on echocardiographic indices of rats with pulmonary arterial hypertension(±s,n=8)
2.3 肺心汤对PAH 大鼠肺小动脉病理变化的影响结果见图3。正常组大鼠肺小动脉血管壁平滑且无异常增厚。与正常组相比,模型组大鼠的肺小动脉血管壁明显增厚,肺小动脉管壁厚度占血管直径的百分比、血管壁面积占小动脉总横截面积的百分比均显著升高(P<0.01)。与模型组相比,各给药组大鼠的血管壁厚度明显降低,肺小动脉管壁厚度占血管直径的百分比、血管壁面积占小动脉总横截面积的百分比均显著降低(P<0.05,P<0.01)。结果表明,肺心汤能改善野百合碱诱导的PAH大鼠肺血管重塑。

注:WT 为肺小动脉管壁厚度占血管直径的百分比;WA 为血管壁面积占小动脉总横截面积的百分比。与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01图3 肺心汤对肺动脉高压大鼠肺小动脉病理变化的影响(HE 染色,×400;±s,n=8)Figure 3 Effect of Feixin Decoction on pathological changes of pulmonary arteriole in rats with pulmonary arterial hypertension(HE staining,×400;±s,n=8)
2.4 肺心汤对PAH 大鼠肺动脉中α-SMA 蛋白表达的影响结果见图4。与正常组相比,模型组大鼠肺动脉中α-SMA 蛋白免疫荧光的阳性表达率显著升高(P<0.01)。与模型组相比,各给药组大鼠肺动脉中α-SMA 蛋白免疫荧光的阳性表达率显著降低(P<0.05,P<0.01)。结果表明,肺心汤能改善野百合碱诱导的PAH大鼠肺小动脉肌化。

注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01图4 肺心汤对肺动脉高压大鼠肺动脉中α-SMA 蛋白表达的影响(免疫荧光,×200;±s,n=5)Figure 4 Effect of Feixin Decoction on α-SMA protein expression in the pulmonary artery of rats with pulmonary arterial hypertension(IF,×200;±s,n=5)
2.5 肺心汤对PAH 大鼠血浆IL-1β、IL-6、TNF-α水平的影响结果见图5。与正常组相比,模型组大鼠的血浆IL-1β、IL-6、TNF-α 水平显著升高(P<0.01)。与模型组相比,各给药组大鼠的血浆IL-1β、IL-6、TNF-α 水平均显著降低(P<0.05,P<0.01)。结果表明,肺心汤能降低野百合碱诱导的PAH 大鼠血浆炎症因子IL-1β、IL-6、TNF-α水平,抑制炎症反应。
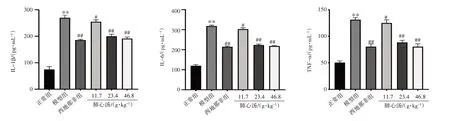
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01图5 肺心汤对肺动脉高压大鼠血浆IL-1β、IL-6、TNF-α 水平的影响(±s,n=5)Figure 5 Effects of Feixin Decoction on plasma IL-1β,IL-6 and TNF-α levels of rats with pulmonary arterial hypertension(± s,n=5)
2.6 肺心汤对PAH 大鼠肺组织中PPAR-γ、NF-κB蛋白阳性表达的影响结果见图6。与正常组相比,模型组大鼠肺组织中的PPAR-γ蛋白阳性表达率显著降低(P<0.01),NF-κB 蛋白阳性表达率显著升高(P<0.01)。与模型组相比,各给药组大鼠肺组织中的PPAR-γ 蛋白阳性表达率显著升高(P<0.05,P<0.01),NF-κB 蛋白阳性表达率显著降低(P<0.05,P<0.01)。

注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,P<0.01图6 肺心汤对肺动脉高压大鼠肺组织中PPAR-γ、NF-κB 蛋白阳性表达的影响(免疫组化,×200;±s,n=5)Figure 6 Effects of Feixin Decoction on protein positive expressions of PPAR-γ and NF-κB in lung tissue of rats with pulmonary arterial hypertension(IHC,×200;±s,n=5)
2.7 肺心汤对PAH 大鼠肺组织中PPAR-γ、IκB-α、p-NF-κB 蛋白表达的影响结果见图7。与正常组相比,模型组大鼠肺组织中PPAR-γ、IκB-α 蛋白表达显著下调(P<0.01);p-NF-κB/NF-κB 蛋白表达比值显著升高(P<0.01)。与模型组相比,各给药组大鼠肺组织中PPAR-γ蛋白表达显著上调(P<0.05,P<0.01),p-NF-κB/NF-κB 蛋白表达比值显著降低(P<0.01);肺心汤高剂量组大鼠肺组织中IκB-α 蛋白表达显著上调(P<0.01)。结果表明,肺心汤能上调野百合碱诱导的PAH 大鼠肺组织中PPAR-γ、IκB-α表达,抑制NF-κB转录激活,从而改善炎症反应。
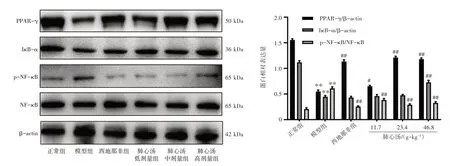
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01图7 肺心汤对肺动脉高压大鼠肺组织中PPAR-γ、IκB-α、p-NF-κB 蛋白表达的影响(±s,n=3)Figure 7 Effects of Feixin Decoction on protein expressions of PPAR-γ,IκB-α and p-NF-κB in lung tissue of rats with pulmonary arterial hypertension(±s,n=3)
3 讨论
PPAR-γ 属于转录因子核激素受体超家族成员之一,具有转录活性,在调节炎症方面起着重要作用。PPAR-γ 在肺组织细胞中广泛表达[14],其在调节炎症反应过程中的主要功能是抑制NF-κB 活性,从而发挥抗炎功能。PPAR-γ一方面可通过直接结合NF-κB(p65)蛋白使其失活[15],另一方面能诱导NF-κB(p65)泛素化,导致NF-κB 亚基蛋白水解[16]。NF-κB 蛋白通常由p65和p50形成同源/异源二聚体,在胞质中因与抑制蛋白IκB 如IκB-α 结合,形成三聚体复合物而处于失活状态[17]。研究[18]表明,在PAH 动物模型中药理激活PPAR-γ,可通过抑制NF-κB转录激活,从而改善肺血管重塑和炎症反应。同时,在低氧诱导的肺动脉平滑肌细胞(PASMCs)中激活PPAR-γ,可通过抑制NF-κB 的转录活性,从而抑制PASMCs 增殖[7]。因此,PPAR-γ/NF-κB 信号通路可能是PAH 潜在的治疗靶点。
PAH 动物造模方法常涉及慢性低氧诱导、化学药物(博来霉素和野百合碱)诱导、复合因素诱导等,其中野百合碱诱导是目前较为常用的模型复制方法[19]。野百合碱能够引发大鼠的肺血管炎症、肺血管重塑、右心功能障碍以及肺动脉压升高[20]。本研究结果表明,与正常组大鼠比较,模型组大鼠的RVSP、mPAP、RVHI、RVIDd 和RVAWT 显著升高,PAAT、PAAT/PET 和TAPSE 显著降低;HE 染色观察发现血管壁明显增厚,肺小动脉管壁厚度占血管直径的百分比、血管壁面积占小动脉总横截面积的百分比均显著升高,肺动脉中α-SMA 免疫荧光染色阳性表达率显著升高,说明野百合碱诱导的PAH 大鼠模型复制成功。此外,模型组大鼠的血浆IL-1β、IL-6、TNF-α 水平显著升高,肺组织中PPAR-γ、IκB-α 蛋白表达显著下调,p-NF-κB/NF-κB 蛋白表达比值显著升高。
肺朝百脉,肺气虚则宗气虚损,推动津液血液之力不足,津液不运则生水饮,气不化饮久则生痰,血液不行则脉络积瘀。“饮、痰、瘀”互结为本病的主要病理因素,久之则肺心脉络瘀塞,肺动脉压力升高。因此,PAH 的治疗宜扶正祛邪、标本兼治。肺心汤中黄芪、白参,补元气、益脾肺,共为君药;制附子温心阳、补肾阳以扶正,茯苓、白术健脾化痰利水,葶苈子泻肺平喘利水,桃仁、 红花、赤芍活血祛瘀,为臣药;麦冬养阴生津、润肺止咳,可防温燥利水太过而损肺阴,知母润肾清热滋阴,与附子相制为用,以防辛燥伤正;全方共奏补益心肺、活血利水之功效。肺心汤能有效改善肺心病患者的临床症状,并可减少患者血小板聚集,降低血液黏稠度,调节炎症因子水平,改善血管内皮细胞功能[9-10]。其还可抑制PAH 大鼠的HIF-1α、VEGF 表达,改善肺血管重塑[21-22]。此外,研究[23]发现,黄芪的主要活性成分黄芪甲苷能显著改善低氧诱导的PAH 小鼠肺血管重塑。本研究结果显示,与模型组比较,肺心汤各剂量组大鼠的PAT、 PAAT/PET 和TAPSE 显著升高,RVIDd 、RVAWT、RVSP、mPAP和RVHI 不同程度降低;HE 染色观察可见血管壁增厚不同程度降低,肺小动脉管壁厚度占血管直径的百分比、血管壁面积占小动脉总横截面积的百分比均显著降低;肺动脉中α-SMA 蛋白免疫荧光的阳性表达率显著降低,说明肺心汤能改善野百合碱诱导的PAH 大鼠血流动力学异常、右心功能障碍及肺血管重塑。此外,各给药组大鼠的血浆IL-1β、IL-6、TNF-α 水平均显著降低,肺组织p-NF-κB/NF-κB 蛋白表达比值有不同程度的下降,PPAR-γ、IκB-α 蛋白表达有不同程度的上调。
综上所述,肺心汤可上调野百合碱诱导的PAH大鼠肺组织的PPAR-γ、IκB-α 表达,抑制NF-κB 转录激活,进而抑制促炎细胞因子IL-1β、IL-6、TNF-α释放,从而改善PAH 大鼠肺血管重塑及右心功能障碍。肺心汤治疗PAH 的作用可能与调节PPAR-γ/NF-κB 通路所介导的炎症反应有关,但其调控PPAR-γ激活的上游分子机制仍有待进一步探究。

