苦参碱调节RhoA-ROCK 信号通路对冠心病模型大鼠Th17/Treg细胞平衡的影响
哈斯高娃,乌吉斯古楞(.内蒙古医科大学附属医院老年医学中心,内蒙古 呼和浩特 00050;. 内蒙古医科大学附属医院肝胆外科,内蒙古 呼和浩特 00050)
冠心病(coronary heart disease,CHD)主要由冠脉粥样硬化引起血管腔狭窄、堵塞或者痉挛,从而形成血栓,最终导致冠状动脉血流受阻,严重时可发展为心肌梗死、脑卒中等不良心血管疾病,是最常见的心血管疾病之一,在老年人中发病率和死亡率较高,但最近几年其发病年龄逐渐减小[1]。
辅助T 细胞17(helper T cell 17,Th17)、调节性T 细胞(regulatory T cells,Treg)在免疫系统中占据重要地位,Th17/Treg 的失衡普遍存在于冠心病患者中。其比值越高,冠心病症状越严重,所以维持Th17/Treg 的平衡或可成为冠心病研究的新方向[2]。有研究[3]显示,RhoA/ROCK 信号通路参与心肌损伤的发生发展,而且其免疫系统的激活在心肌细胞和免疫细胞中起着重要的作用。黄芩苷可以通过调节Ras同源基因家族成员A(Ras homolog gene family member A,RhoA)-Rho 相关的卷曲螺旋激酶(Rho associated coiled-coil forming protein kinase,ROCK)信号通路维持Th17/Treg细胞平衡,改善胰腺损伤[4]。
苦参碱是从中药苦参中提取出来的一种喹诺嗪类生物碱,具有抗炎、免疫调节等多种作用。有研究[5]显示,苦参碱可以通过抑制RhoA/ROCK1信号通路活性明显改善心力衰竭大鼠的心功能,减轻心肌纤维化程度。但苦参碱是否可以通过抑制RhoA-ROCK 信号通路稳定冠心病大鼠Th17/Treg 细胞平衡还有待进一步研究。本研究拟探究苦参碱对冠心病大鼠Th17/Treg 细胞平衡及RhoA-ROCK 信号通路的影响,以期为冠心病的治疗提供新的途径。
1 材料与方法
1.1 动物12周龄SPF级雄性大鼠,体质量(200±10)g,大连医科大学提供,动物生产许可证号:SCXK(辽)2018-0003,动物质量合格证号:1108262111002129。动物饲养在环境温度18~22 ℃、昼夜节律光照(12 h∶12 h)、环境湿度40%~70%的房间中,可自由进食和饮水。动物实验经内蒙古医科大学动物伦理委员会批准,批准号:20220301。
1.2 药物及试剂苦参碱(纯度:98%,批号:217-06-13),购于成都瑞芬思德丹生物公司。戊巴比妥钠(批号:P3761),购于北京北实纵横科技有限公司;TUNEL 染色试剂盒(批号:C1088)、IL-17 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(批号:PI545),均购于碧云天生物公司;Masson 染色试剂盒(批号:BTN131272-HUP)、转化生长因子(transforming growth factor β,TGF-β;批号:EK-R38958)ELISA 试剂盒,购于北京百奥莱博公司;TTC 染色液(批号:B1105),购于北京普利莱公司;RIPA 裂解液(批号:EX6020),购于北京金克隆生物公司;内皮素1(endothelin 1,ET-1)(批号:sc-517436)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS;批号:sc-376751)抗体,购于圣克鲁斯生物公司;B 细胞淋巴瘤因子2(B-cell lymphoma factor 2,Bcl-2;批号:ab185002)、半胱氨酸天冬氨酸蛋白酶3(cysteine aspartate proteinase-3,Caspase - 3; 批号: ab197202)、 RhoA(批号:ab187027)、ROCK1(批号:ab134181)、ROCK2(批号:ab125025)抗体,购于英国Abcam 公司;Bcl-2相关X 蛋白(Bcl-2 associated X protein,Bax)抗体(批号:5023),购于美国CST公司。
1.3 仪器Vevo 2100 超高分辨率小动物彩色多普勒超声仪,加拿大VisualSonics 公司;BX51型光学显微镜,日本OLYMPUS 公司;iMark680 多功能酶标仪,美国Bio-Rad 公司;FACSCalibur 流式细胞仪,美国Becton-Dickinson 公司;LSM 510 激光共聚焦显微镜,德国蔡司公司。
1.4 冠心病模型建立所有实验大鼠自由饮食和饮水,适应性饲养1 周后腹腔注射0.3%戊巴比妥钠(40 mg·kg-1)进行麻醉,连接呼吸机进行心电图监测,待呼吸平稳后,打开胸腔暴露心脏,对大鼠的左心室回旋支末梢进行结扎;观察到结扎下方的心肌组织颜色变为灰白色,ST 段明显抬高,表明冠心病建模成功[6];随后缝合伤口,置于笼中饲养,连续3 d 注射青霉素钠预防感染。对照组与冠心病模型操作相同但是不结扎。
1.5 分组造模成功后,随机将所有大鼠分为对照组、模型组、苦参碱低剂量(50 mg·kg-1)组、苦参碱高剂量(200 mg·kg-1)组及苦参碱高剂量(200 mg·kg-1)+LPA 组(10 mg·kg-1),每组24 只。本实验药物的给药剂量参考了有关研究[7-8]。苦参碱低剂量组、苦参碱高剂量组在造模成功1周后,分别灌胃50、200 mg·kg-1的苦参碱(生理盐水稀释至2 mL),苦参碱高剂量+LPA组灌胃200 mg·kg-1苦参碱(生理盐水稀释至2 mL)并腹腔注射10 mg·kg-1LPA(生理盐水稀释至1 mL),对照组和模型组均灌胃等量的生理盐水,每日1 次,实验持续4周。
1.6 心功能检测采用彩色多普勒超声诊断仪对所有的大鼠进行心功能检测。记录大鼠3个心动周期的左室射血分数(left ventricular ejection fraction,LVEF)、左室缩短分数(left ventricular shortening fraction,LVFS)、左室舒张末期容积(left ventricular enddiastolic volume,LVEDV)、左室收缩末期容积(left ventricular end-systolic volume,LVESV)。
1.7 ELISA 法检测大鼠IL-17、TGF-β 水平大鼠腹腔注射戊巴比妥钠(30 mg·kg-1)麻醉后,采集大鼠腹主动脉血液,静置离心(1 000×g,10 min)后得到血清。按照IL-17、TGF-β ELISA 试剂盒操作,酶标仪检测各组大鼠心肌组织中IL-17、TGF-β水平。
1.8 流式细胞术检测大鼠Th17、Treg、Th17/Treg指标随机选择6 只大鼠,腹腔注射戊巴比妥钠(150 mg·kg-1)处死,无菌条件下打开胸腔和腹部,迅速收集心肌组织及脾脏。将心肌组织置于4%多聚甲醛固定24 h,乙醇脱水、石蜡包埋。脾脏置入RPMI-1640 培养基中,研磨收集滤液,将细胞悬液置于6 孔板,37 ℃、 5% CO2环境下孵育4 h,以便后续实验。Th17 细胞检测:先用PMA、离子霉素、莫能菌素刺激脾细胞,然后在37 ℃、5% CO2环境下培养4 h;FITC-CD4 抗体表面标记,PE-IL-17 抗体胞内染色,24 h内流式细胞仪检测分析。Treg细胞检测:在上述细胞悬液中分别加入FITC-CD4 抗体和APC-CD25 抗体表面染色,PE-Foxp3 抗体胞内染色,流式细胞仪检测分析。
1.9 大鼠心肌组织病理形态观察将“1.8”项下石蜡包埋的心肌组织切片,脱蜡、复水后用Masson 染色,然后脱水、封片,光学显微镜下进行观察各组大鼠的心肌组织病理形态特征。
1.10 大鼠心肌梗死情况观察随机选择6 只大鼠按“1.8”项下方法处死取出心肌组织,冷冻切片,随后将心肌组织冷冻切片,置于TTC 溶液中,37 ℃恒温孵育15 min。再用4%多聚甲醛固定12 h,光学显微镜下观察并拍照,以Image ProPlus 6.0 分析计算心肌梗死面积。心肌梗死面积(%)=[梗死区面积/(梗死区面积+缺血区面积)]×100%。
1.11 TUNEL 染色检测细胞凋亡取“1.10”项下心肌组织切片,依照TUNEL 试剂盒说明书进行操作,加入TUNEL 染色液避光孵育1 h,DAPI 避光染核10 min。封片液封片,荧光显微镜观察切片,其中绿色荧光为凋亡细胞,计算细胞凋亡率。细胞凋亡率(%)=(TUNEL阳性细胞数/总细胞数)×100%。
1.12 免疫组化检测eNOS、ET-1取“1.8”项下心肌组织的石蜡切片,脱蜡复水,加eNOS、ET-1一抗4 ℃孵育过夜,再加二抗室温孵育30 min;PBS 冲洗后进行DAB 显色,苏木精染核,再冲洗、脱水、透明、封片;ImageJ软件分析光密度值。
1.13 RhoA 活性检测随机选择6 只大鼠麻醉处死,取出心肌组织,加入预先准备好的含有PBS溶液的离心管中,制成匀浆,离心(1 000×g,10 min)取上清,参照RhoA试剂盒说明检测RhoA活性。
1.14 Western Blot 印迹法收集剩余6 只大鼠的心肌组织,裂解液裂解蛋白并提取总蛋白。随后电泳分离,转膜,脱脂奶粉封闭,加入Bax(1∶1 000)、Bcl-2(1∶1 000)、Caspase-3(1∶500)、RhoA(1∶1 000)、ROCK1(1∶100)、ROCK2(1∶1 000)、GAPDH(1∶2 000)一抗后4 ℃孵育过夜。次日TBST 洗涤3 次,加入二抗(1∶4 000)室温孵育1 h。再次用TBST 洗涤3次,凝胶电泳仪拍照并分析灰度值。
1.15 统计学处理方法采用SPSS 25.0 进行统计分析,实验数据均符合正态分布,以均数±标准差(±s)表示,用单因素方差分析进行多组间样本均数比较,用LSD-t检验进行组间两两比较。以P<0.05 表示差异有统计学意义。
2 结果
2.1 苦参碱对冠心病大鼠心功能的影响结果见图1、表1。与对照组比较,模型组LVEF、LVFS 明显下降,LVEDV、LVESV 明显增大(P<0.05);与模型组比较,苦参碱低、高剂量组LVEF、LVFS依次明显上升,LVEDV、LVESV 明显减小(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+LPA 组LVEF、LVFS明显下降,LVEDV、LVESV明显增大(P<0.05)。
表1 苦参碱对冠心病大鼠心功能的影响(±s,n=18)Table 1 Effects of matrine on cardiac function in rats with coronary heart disease(±s,n=18)
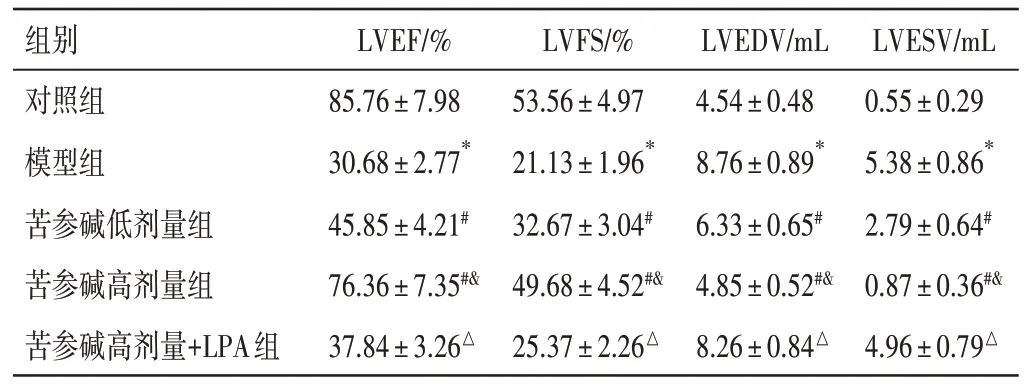
表1 苦参碱对冠心病大鼠心功能的影响(±s,n=18)Table 1 Effects of matrine on cardiac function in rats with coronary heart disease(±s,n=18)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦参碱低剂量组比较,&P<0.05;与苦参碱高剂量组比较,△P<0.05
组别对照组模型组苦参碱低剂量组苦参碱高剂量组苦参碱高剂量+LPA组LVEF/%85.76±7.98 30.68±2.77*45.85±4.21#76.36±7.35#&37.84±3.26△LVFS/%53.56±4.97 21.13±1.96*32.67±3.04#49.68±4.52#&25.37±2.26△LVEDV/mL 4.54±0.48 8.76±0.89*6.33±0.65#4.85±0.52#&8.26±0.84△LVESV/mL 0.55±0.29 5.38±0.86*2.79±0.64#0.87±0.36#&4.96±0.79△
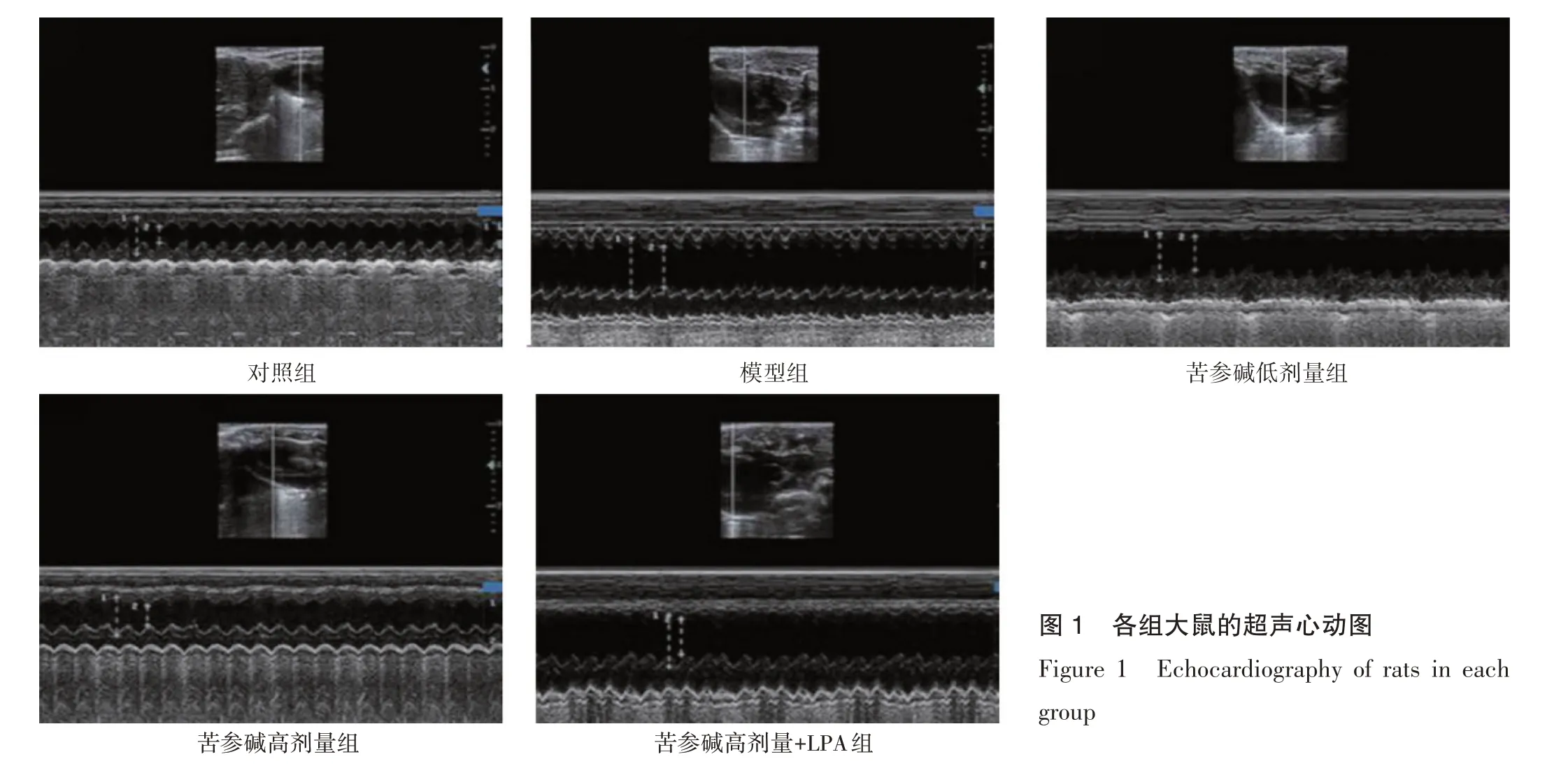
图1 各组大鼠的超声心动图Figure 1 Echocardiography of rats in each group
2.2 苦参碱对冠心病大鼠IL-17、TGF-β 水平的影响结果见表2。与对照组比较,模型组IL-17 水平明显上调,TGF-β 水平明显下调(P<0.05);与模型组比较,苦参碱低、高剂量组IL-17 水平依次明显下调,TGF-β 水平依次明显上调(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+LPA 组IL-17 水平明显上调,TGF-β水平明显下调(P<0.05)。
表2 苦参碱对冠心病大鼠IL-17、TGF-β 水平的影响(±s,n=18)Table 2 Effects of matrine on IL-17 and TGF-β levels in rats with coronary heart disease(±s,n=18)
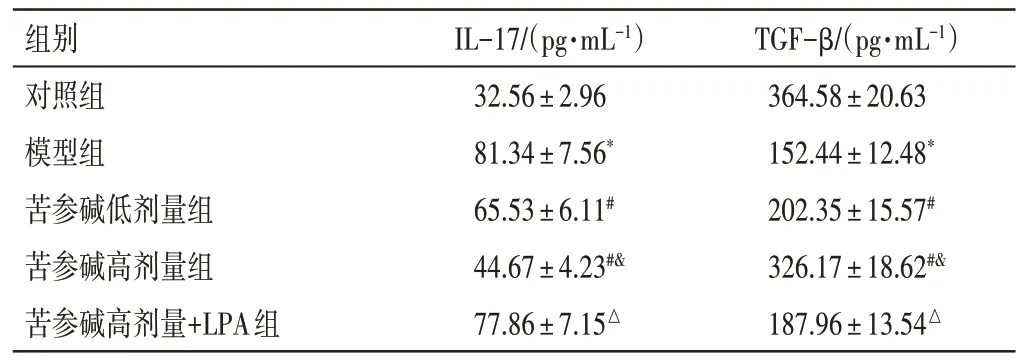
表2 苦参碱对冠心病大鼠IL-17、TGF-β 水平的影响(±s,n=18)Table 2 Effects of matrine on IL-17 and TGF-β levels in rats with coronary heart disease(±s,n=18)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦参碱低剂量组比较,&P<0.05;与苦参碱高剂量组比较,△P<0.05
组别对照组模型组苦参碱低剂量组苦参碱高剂量组苦参碱高剂量+LPA组IL-17/(pg·mL-1)32.56±2.96 81.34±7.56*65.53±6.11#44.67±4.23#&77.86±7.15△TGF-β/(pg·mL-1)364.58±20.63 152.44±12.48*202.35±15.57#326.17±18.62#&187.96±13.54△
2.3 苦参碱对冠心病大鼠Th17、Treg、Th17/Treg 的影响结果见图2、表3。与对照组比较,模型组Th17 细胞比例上调,Treg 细胞比例下调,Th17/Treg比值增大(P<0.05);与模型组比较,苦参碱低、高剂量组Th17细胞比例依次明显下调,Treg细胞比例依次明显上调,Th17/Treg 比值依次减小(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+LPA 组Th17细胞比例上调,Treg 细胞比例下调,Th17/Treg 比值增大(P<0.05)。
表3 苦参碱对冠心病大鼠Th17、Treg、Th17/Treg 的影响(±s,n=6)Table 3 Effects of matrine on Th17,Treg and Th17/Treg in rats with coronary heart disease(±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦参碱低剂量组比较,&P<0.05;与苦参碱高剂量组比较,△P<0.05
组别对照组模型组苦参碱低剂量组苦参碱高剂量组苦参碱高剂量+LPA组Th17/%3.55±0.31 26.74±2.32*18.65±1.51#7.33±0.68#&23.46±1.95△Treg/%27.48±2.44 8.56±0.79*14.67±1.23#25.91±2.20#&10.63±0.92△Th17/Treg 0.13±0.02 3.12±0.29*1.27±0.13#0.28±0.03#&2.21±0.22△
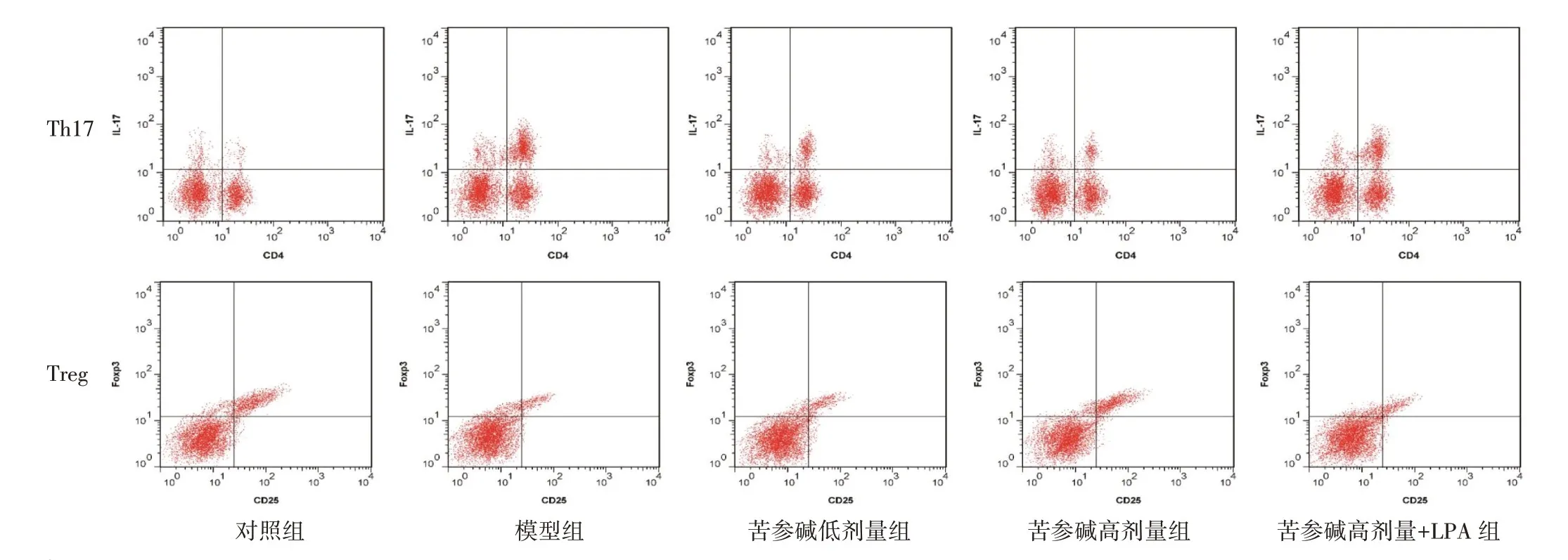
图2 各组大鼠Th17、Treg 细胞流式细胞图Figure 2 Flow cytometry of Th17 and Treg cells in each group
2.4 苦参碱对冠心病大鼠内皮功能的影响结果见图3、表4。根据光密度值,与对照组比较,模型组eNOS 水平下降,ET-1 水平升高(P<0.05);与模型组比较,苦参碱低、高剂量组eNOS 水平依次明显升高,ET-1 水平依次明显下降(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+LPA 组eNOS 水平下降,ET-1水平升高(P<0.05)。
表4 苦参碱对冠心病大鼠内皮功能的影响(±s,n=6)Table 4 Effects of matrine on endothelial function in rats with coronary heart disease(±s,n=6)
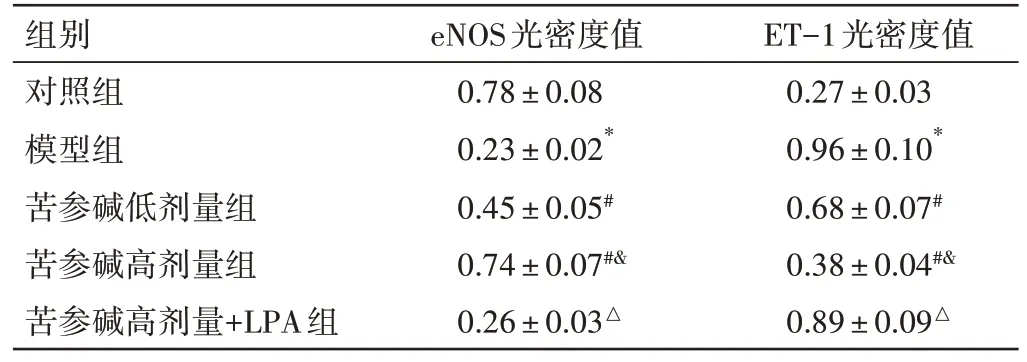
表4 苦参碱对冠心病大鼠内皮功能的影响(±s,n=6)Table 4 Effects of matrine on endothelial function in rats with coronary heart disease(±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦参碱低剂量组比较,&P<0.05;与苦参碱高剂量组比较,△P<0.05
组别对照组模型组苦参碱低剂量组苦参碱高剂量组苦参碱高剂量+LPA组eNOS光密度值0.78±0.08 0.23±0.02*0.45±0.05#0.74±0.07#&0.26±0.03△ET-1光密度值0.27±0.03 0.96±0.10*0.68±0.07#0.38±0.04#&0.89±0.09△
注:阳性表达呈棕黄色胞核和淡黄色胞浆图3 免疫组化法观察大鼠心肌细胞eNOS、ET-1 表达(×200)Figure 3 Immunohistochemical observation of eNOS and ET-1 expressions in rat cardiomyocytes(×200)
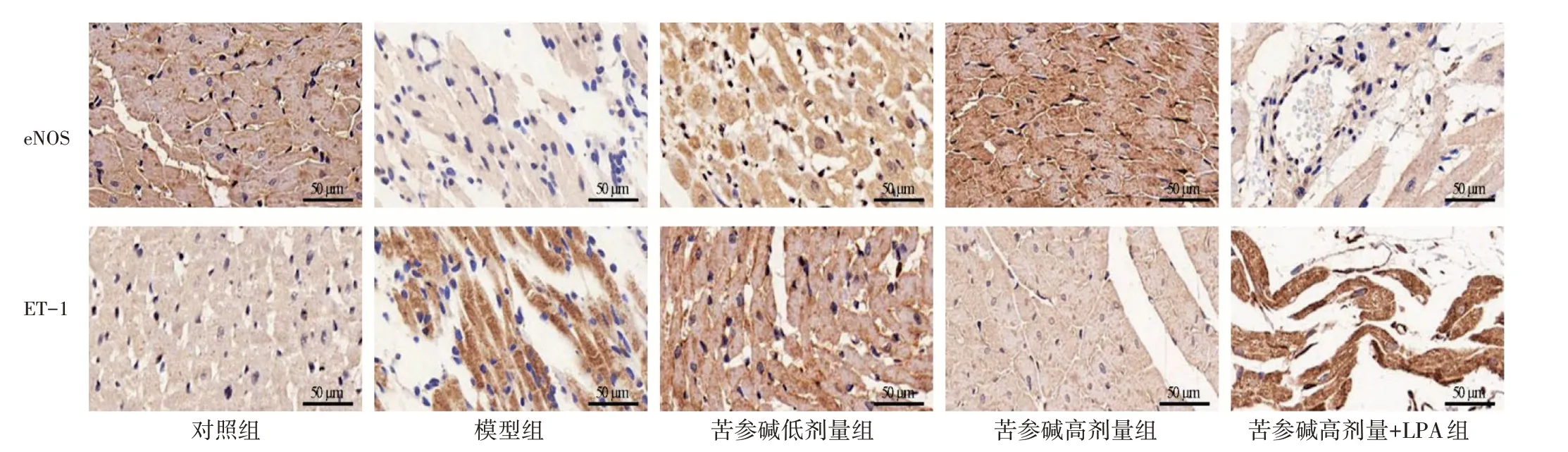
2.5 苦参碱对冠心病大鼠心肌组织的影响结果见图4。对照组心肌组织染色后基本无蓝色胶原纤维出现;与对照组比较,模型组心肌组织有大量的蓝色胶原纤维沉积;与模型组比较,苦参碱低剂量组、苦参碱高剂量组心肌组织蓝色胶原纤维依次逐渐减少;与苦参碱高剂量组比较,苦参碱高剂量+LPA 组心肌组织蓝色胶原纤维增多。
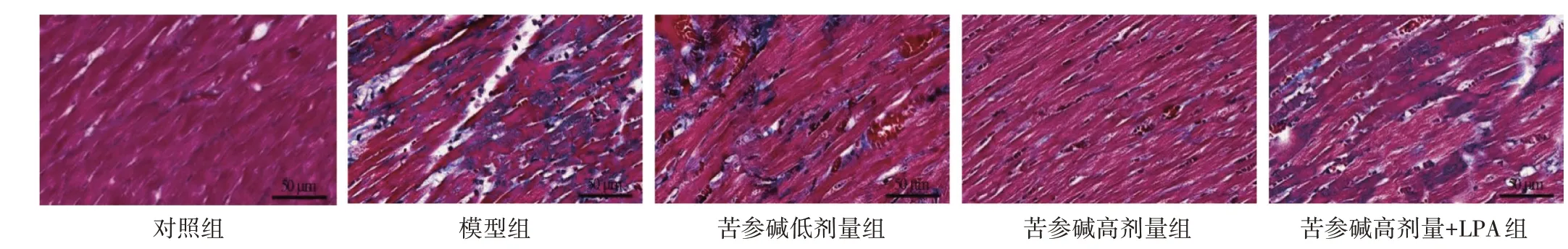
图4 Masson 染色观察各组大鼠心肌病理状况(×200)Figure 4 Pathological status of rat myocardium by Masson staining in each group(×200)
2.6 苦参碱对冠心病大鼠心肌梗死的影响结果见图5、表5。与对照组比较,模型组大鼠心肌梗死面积明显增大(P<0.05);与模型组比较,苦参碱低、高剂量组大鼠心肌梗死面积依次明显减小(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+LPA 组大鼠心肌梗死面积明显增大(P<0.05)。
表5 苦参碱对冠心病大鼠心肌梗死的影响(±s,n=6)Table 5 Effects of matrine on myocardial infarction in rats with coronary heart disease(±s,n=6)

表5 苦参碱对冠心病大鼠心肌梗死的影响(±s,n=6)Table 5 Effects of matrine on myocardial infarction in rats with coronary heart disease(±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦参碱低剂量组比较,&P<0.05;与苦参碱高剂量组比较,△P<0.05
组别对照组模型组苦参碱低剂量组苦参碱高剂量组苦参碱高剂量+LPA组心肌梗死面积/%5.24±0.68 31.78±2.70*21.65±1.97#10.54±0.89#&17.26±1.59△
图5 TTC 染色观察各组大鼠心肌梗死状况Figure 5 Observation of myocardial infarction by TTC staining in rats of each group
2.7 苦参碱对冠心病大鼠心肌细胞凋亡的影响结果见图6、图7 和表6。TUNEL 染色的细胞呈绿色,DAPI 染色细胞核呈蓝色。与对照组比较,模型组心肌细胞凋亡率、TUNEL 阳性率、Bax、Caspase-3 蛋白表达水平明显升高,Bcl-2 蛋白表达水平明显降低(P<0.05);与模型组比较,苦参碱低、高剂量组心肌细胞凋亡率、TUNEL 阳性率、Bax 及Caspase-3 蛋白表达水平依次明显降低,Bcl-2 蛋白表达水平依次明显升高(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+LPA 组心肌细胞凋亡率、TUNEL 阳性率、Bax 及Caspase-3 蛋白表达水平明显升高,Bcl-2 蛋白表达水平明显降低(P<0.05)。
表6 苦参碱对冠心病大鼠心肌细胞凋亡及相关蛋白的影响(±s,n=6)Table 6 Effects of matrine on cardiomyocyte apoptosis and related proteins in rats with coronary heart disease(±s,n=6)
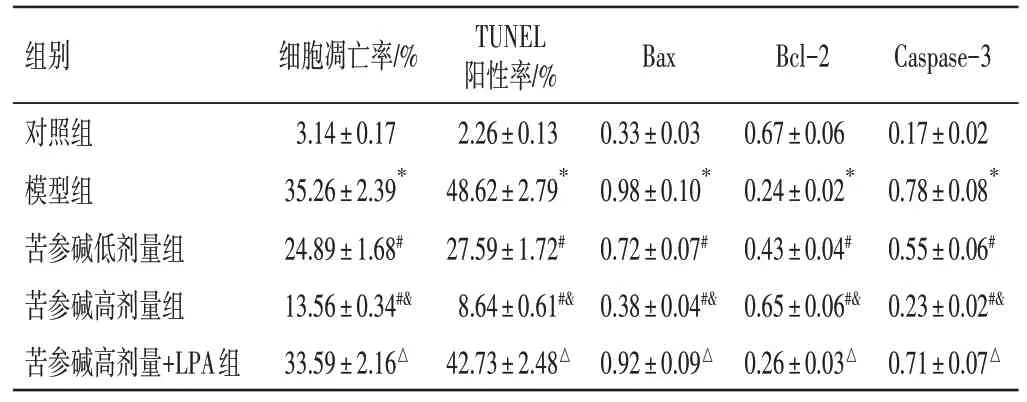
表6 苦参碱对冠心病大鼠心肌细胞凋亡及相关蛋白的影响(±s,n=6)Table 6 Effects of matrine on cardiomyocyte apoptosis and related proteins in rats with coronary heart disease(±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦参碱低剂量组比较,&P<0.05;与苦参碱高剂量组比较,△P<0.05
组别对照组模型组苦参碱低剂量组苦参碱高剂量组苦参碱高剂量+LPA组细胞凋亡率/%3.14±0.17 35.26±2.39*24.89±1.68#13.56±0.34#&33.59±2.16△TUNEL阳性率/%2.26±0.13 48.62±2.79*27.59±1.72#8.64±0.61#&42.73±2.48△Bax 0.33±0.03 0.98±0.10*0.72±0.07#0.38±0.04#&0.92±0.09△Bcl-2 0.67±0.06 0.24±0.02*0.43±0.04#0.65±0.06#&0.26±0.03△Caspase-3 0.17±0.02 0.78±0.08*0.55±0.06#0.23±0.02#&0.71±0.07△

图6 各组大鼠心肌细胞凋亡情况(×200)Figure 6 Apoptosis of cardiomyocytes in rats of each group(×200)
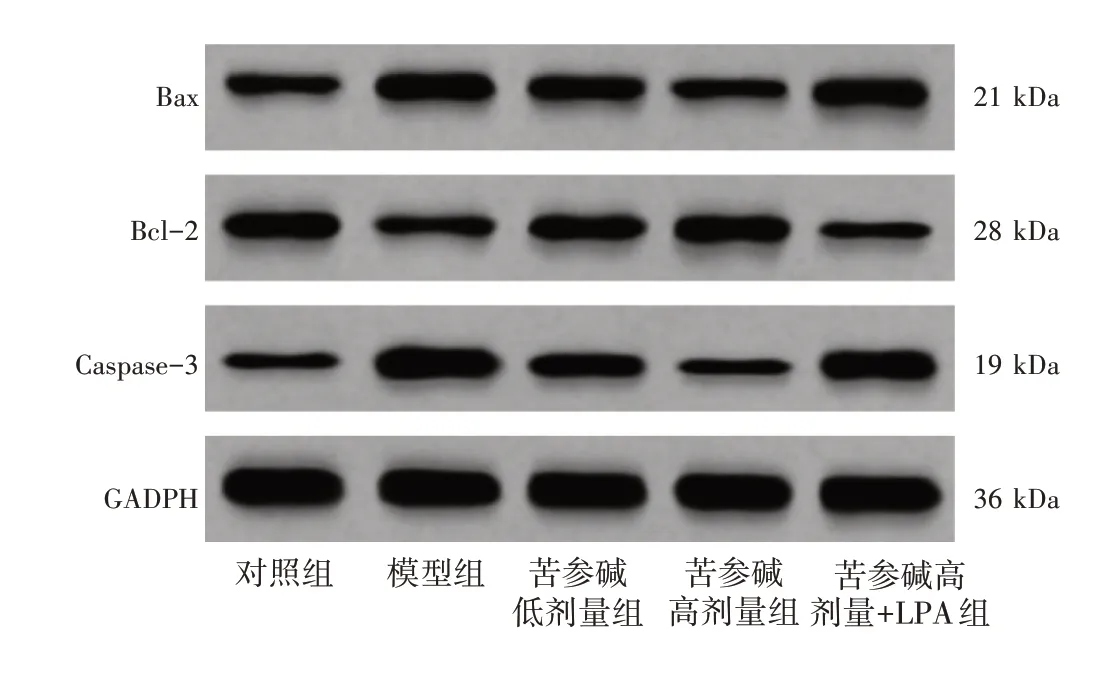
图7 Western Blot检测Bax、Bcl-2、Caspase-3蛋白表达水平Figure 7 Protein expression levels of Bax,Bcl-2 and Caspase-3 by Western Blot analysis
2.8 苦参碱对冠心病大鼠心肌细胞RhoA 活性的影响结果见表7。与对照组比较,模型组心肌细胞RhoA 活性明显升高(P<0.05);与模型组比较,苦参碱低、高剂量组心肌细胞RhoA 活性明显降低(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+LPA组心肌细胞RhoA活性明显升高(P<0.05)。
表7 苦参碱对冠心病大鼠心肌细胞RhoA 活性的影响(±s,n=6)Table 7 Effects of matrine on RhoA activity in cardiomyocytes of rats with coronary heart disease(±s,n=6)

表7 苦参碱对冠心病大鼠心肌细胞RhoA 活性的影响(±s,n=6)Table 7 Effects of matrine on RhoA activity in cardiomyocytes of rats with coronary heart disease(±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦参碱低剂量组比较,&P<0.05;与苦参碱高剂量组比较,△P<0.05
组别对照组模型组苦参碱低剂量组苦参碱高剂量组苦参碱高剂量+LPA组RhoA/(ng·mL-1)254.17±14.68 375.58±20.25*324.29±18.73#271.34±15.42#&351.46±19.64△
2.9 苦参碱对冠心病大鼠心肌细胞RhoA-ROCK 信号通路的影响结果见图8、表8。与对照组比较,模型组心肌细胞RhoA、ROCK1、ROCK2 蛋白表达明显升高(P<0.05);与模型组比较,苦参碱低、高剂量组心肌细胞RhoA、ROCK1、ROCK2 蛋白表达依次明显降低(P<0.05);与苦参碱高剂量组比较,苦参碱高剂量+LPA 组心肌细胞RhoA、ROCK1、ROCK2 蛋白表达均明显升高(P<0.05)。
表8 苦参碱对冠心病大鼠心肌细胞RhoA、ROCK1、ROCK2 蛋白表达的影响(±s,n=6)Table 8 Effects of matrine on protein expressions of RhoA,ROCK1 and ROCK2 in cardiomyocytes of rats with coronary heart disease(±s,n=6)
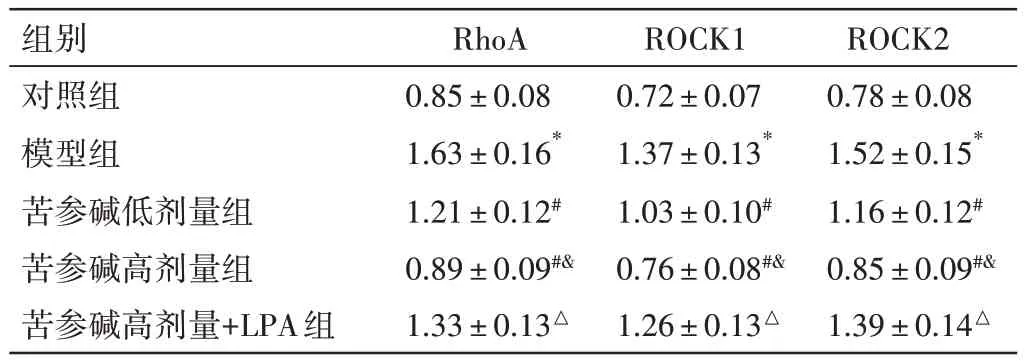
表8 苦参碱对冠心病大鼠心肌细胞RhoA、ROCK1、ROCK2 蛋白表达的影响(±s,n=6)Table 8 Effects of matrine on protein expressions of RhoA,ROCK1 and ROCK2 in cardiomyocytes of rats with coronary heart disease(±s,n=6)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与苦参碱低剂量组比较,&P<0.05;与苦参碱高剂量组比较,△P<0.05
组别对照组模型组苦参碱低剂量组苦参碱高剂量组苦参碱高剂量+LPA组RhoA 0.85±0.08 1.63±0.16*1.21±0.12#0.89±0.09#&1.33±0.13△ROCK1 0.72±0.07 1.37±0.13*1.03±0.10#0.76±0.08#&1.26±0.13△ROCK2 0.78±0.08 1.52±0.15*1.16±0.12#0.85±0.09#&1.39±0.14△
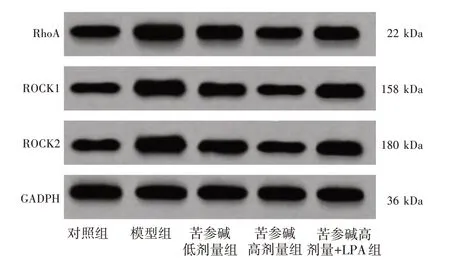
图8 Western Blot 检测RhoA、ROCK1、ROCK2 蛋白表达Figure 8 Protein expressions of RhoA,ROCK1 and ROCK2 by Western Blot analysis
3 讨论
冠心病又称为缺血性心脏病,心肌缺血会对心肌组织、心肌活动代谢及心脏功能等造成严重损伤。LVEF、LVFS、LVEDV、LVESV 与心脏的收缩、舒张功能相关。另外,内皮功能在冠心病的发生发展中发挥着至关重要的作用,eNOS、ET-1 是检测内皮功能常用的因子[9-10]。eNOS 是心血管系统中的一种重要酶,广泛分布在心脏、血管内皮细胞等部位,调节各种生理功能。ET-1 是由血管内皮细胞分泌的血管收缩肽,可以起到收缩血管的作用。研究[11]显示,在检测冠心病大鼠的血管内皮功能相关指标时,发现eNOS的水平下降,ET-1的水平上升,影响两者的水平可以改善大鼠的血管内皮。本研究显示,冠心病模型大鼠的心肌细胞大量坏死,纤维组织增生,炎性细胞浸润及组织水肿明显,LVEF、LVFS明显下降,eNOS 水平下调,LVEDV、LVESV 明显增大,ET-1 水平上调,说明大鼠造模成功。苦参碱具有有效的抗纤维化、心脏保护、抗炎等作用[12-14]。本研究显示,苦参碱可以明显抑制心肌细胞坏死,减轻炎性细胞的浸润程度,改善组织水肿症状,升高LVEF、LVFS,提高eNOS水平,减小LVEDV、LVESV,降低ET-1水平。
冠心病是一种由免疫失衡引起的慢性炎症性疾病,很多免疫细胞、细胞因子参与了冠心病的各个环节,因此控制炎症反应和免疫调节对于冠心病的防治极其重要[15-16]。Th17、Treg 参与免疫调节,在自身免疫性疾病、感染性疾病甚至恶性肿瘤中均发挥重要作用。在冠心病的研究进展中发现,Treg 与Th17 比例失衡,使炎症与免疫的平衡被破坏,影响冠心病的进程[17]。Th17 细胞分泌的IL-17 主要发挥致炎作用,促进炎症发生,而Treg主要通过分泌TGF-β细胞因子,抑制炎症反应,从而抑制自身免疫病、阻碍炎症相关的癌症的发展[18-19]。通过维持机体内这两种细胞的平衡,以维持免疫环境的稳定,而IL-17A和TGF-β 水平可以间接反映Th17/Treg 的平衡状态。本研究显示,苦参碱可以上调Th17 细胞,下调Treg细胞,减小Th17/Treg 比值,从而降低IL-17 水平,升高TGF-β水平,改善冠心病大鼠的炎症。
细胞凋亡指多基因共同调控细胞自主的有序性死亡,可以维持内环境稳定。其中Bax蛋白是促凋亡蛋白,促进细胞凋亡,Bcl-2抑制细胞凋亡,Caspase-3是凋亡执行因子[20]。心肌细胞凋亡参与冠心病的发生、发展,并在其中发挥不可或缺的作用,抑制心肌细胞凋亡可以有效改善冠心病病症。本研究显示,苦参碱可以降低心肌细胞凋亡率,降低Bax、Caspase-3蛋白表达,促进Bcl-2蛋白表达。
RhoA/ROCK 信号通路是T 淋巴细胞(Th17、Treg等)发育、激活和分化的关键调节因子,在心血管疾病中起着重要的作用。其中RhoA 属于GTPase-Rho小家族,可以通过与下游底物发生相互作用,从而引发各种细胞反应。ROCK 作为RhoA 下游效应物参与细胞的收缩、黏附、凋亡等多种功能。有研究[21]显示,STAT3 参与Th17 细胞的分化,STAT5 可以诱导Treg 细胞的发育和功能,抑制RhoA-ROCK 通路,通过调节STAT3 和STAT5 的磷酸化可以调节Th17/Treg细胞的失衡。LPA 是一种RhoA-ROCK 激活剂,在血管损伤反应和动脉粥样硬化中,可以调节急性血栓形成和血小板功能,加重纤维化[22]。本研究显示,RhoA 活性及RhoA、ROCK1、ROCK2 蛋白均在冠心病大鼠中高表达,苦参碱可以降低RhoA 活性,下调RhoA、ROCK1、ROCK2 蛋白表达,从而调节冠心病大鼠体内Th17/Treg 平衡。LPA 可以逆转苦参碱对冠心病大鼠心肌损伤的保护作用,说明苦参碱可以通过抑制RhoA-ROCK 信号通路调节冠心病大鼠Th17/Treg平衡,改善冠心病大鼠心肌损伤。
综上所述,苦参碱通过抑制RhoA-ROCK 信号通路调节冠心病大鼠Th17/Treg 平衡,改善大鼠心肌损伤。本研究还有不足之处,苦参碱调控RhoA-ROCK信号通路的作用机制还有待进一步验证。

