肝细胞癌和动脉粥样硬化共表达基因的筛选和验证
马玉玉, 张 丽, 王炫峥, 乃菲沙·买买提, 米叶沙尔·安尼娃尔, 马秀敏
(新疆医科大学1第三临床医学院/附属肿瘤医院, 2第一附属医院检验科, 乌鲁木齐 830011)
肝细胞癌是临床常见的恶性肿瘤之一,约90%的原发性肝癌是肝细胞癌(Hepatocellular carcinoma, HCC)[1]。动脉粥样硬化(Atherosclerosis, AS)长期以来被认为是一种主要的脂质驱动疾病,其特征在于动脉壁中的脂质沉积[2]。目前有相关研究表明,肝脏脂肪生成过多可能会导致非酒精性脂肪性肝病、AS性血脂异常、胰腺β细胞功能障碍、胰岛素抵抗和高危表型相关AS,并且衰老、吸烟习惯、缺乏运动和饮酒相关的几个风险因素被认为是HCC和AS的常见因素[3-5]。相关研究表明,在病理学上,AS性血脂异常的脂蛋白变化主要是由肝脏脂质代谢异常引起的[6]。HCC和AS样本有限,并且缺乏来自于与公共数据库相结合的综合研究分析。鉴于此,本研究的目的是结合基因表达数据库(Gene expression omnibus,GEO)对HCC和AS进行新型标志物的鉴定和探索。
1 资料与方法
1.1 数据来源GEO数据库 (http://www.ncbi.nlm.nih.gov/geo/)下载微阵列数据集。以HCC和AS为关键词,检索相关表达数据集,下载编号为GSE84402、GSE28829、GSE25097、GSE100927的数据集。
1.2 WGCNA识别HCC与AS中共表达基因利用基因表达谱,分别计算了每个基因的中位数绝对偏差 (Median absolute deviation, MAD),剔除MAD最小的前50%的基因,利用R软件加权基因共表达网络分析(Weighted gene co-expression networkanalysis,WGCNA)去除GSE84402数据集和GSE22829数据集中离群的基因和样本,根据截断标准(|MM|>0.8)确定关键基因。
1.3 筛选差异基因采用R软件Limma标准化矩阵数据并分别鉴定GSE25097和GSE100927数据集中HCC和AS组织与正常组织间的差异基因。以校正后的P<0.05和|logFC|>1为差异基因筛选条件,本研究使用 Venny(https://www.bioinformatics.com.cn)映射筛选出共表达的差异基因。
1.4 功能和通路的富集分析利用R软件clusterProfiler进行共表达差异基因的基因本体(Gene ontology,GO)富集分析和基因组百科全书(Kyoto encyclopedia of genes and genomes ,KEGG)。P<0.05为阈值,鉴定GO的生物学过程 和KEGG通路分析 。
1.5 HCC和AS患者血液标本收集收集2022年5月至9月在新疆医科大学第三附属医院的HCC和AS患者的血液样本,用EDTA抗凝真空采血管分别收集15名HCC患者以及AS患者和15名健康体检者的约3 mL新鲜外周血。本研究由新疆医科大学第三附属医院伦理委员会批准(批准号G-201737),所有患者都提供了知情同意书。
1.6 外周血单核细胞(Peripheral blood mononuclear cells,PBMCs)提取采集HCC和AS患者及健康人新鲜外周血约3 mL于EDTA抗凝的真空采血管中加入等量的磷酸缓冲盐溶液进行1∶1稀释形成外周全血稀释液。低温高速离心,4℃,2 000 r/30 min,用1 mL枪头吸出单个核细胞层,取Trizol 1 mL充分吹打混匀,后续进行RNA提取。
1.7 RNA的提取与转录用Trizol法从PBMCs中提取 mRNA。经聚合酶链式反应(Polymerase chain reaction,PCR)反转录成 cDNA。使用实时定量PCR仪与RT-PCR试剂盒测定基因表达量,GAPDH为内参基因。RT-PCR引物序列见表1。2-ΔΔCT方法分析基因的相对表达。

表1 RT-qPCR验证使用的引物信息
1.8 免疫组织化学及免疫荧光验证取肝脏病理诊断证实HCC病变附近2 cm范围内和病变外2 cm范围的近、远样本,进行免疫组织化学分析。免疫荧光验证。免疫荧光验证。制备包埋组织的切片(4 μm厚),将切片与一级抗体一起孵育小鼠抗人HIF1A(1︰250 Abcam)、小鼠抗人CASP8(1︰200 Abcam)、小鼠抗人LEF1(1︰250 Abcam)、小鼠抗人BCAT1(1︰200 Abcam) 和小鼠抗人 LPL(1︰300 Abcam)。以辣根过氧化物酶和3′-二氨基联苯胺为底物标记适当的抗IgG二级抗体,观察免疫反应蛋白。石蜡包埋切片用第一抗体染色配置一抗工作液稀释浓度如下:小鼠抗人HIF1A一抗1︰2 000(Abcam), 小鼠抗人CASP8一抗1︰2 000(Abcam), 小鼠抗人LEF1一抗1︰2 000(Abcam), 小鼠抗人BCAT1一抗1︰2 000(Abcam), 小鼠抗人LPL一抗1︰2 000(Abcam)然后用相应的荧光第二抗体染色(山羊抗小鼠IgG H&L Alexa Fluor® 488, 1︰200, 山羊抗兔IgG H&L Alexa Fluor® 647, 1︰200)滴加于肝脏组织上室温避光孵育2 h。共聚焦显微镜检测阳性细胞。
2 结果
2.1 GEO数据库中HCC和AS信息GSE84402和GSE28829配对用于WGCNA分析,GSE25097和GSE100927配对用于差异基因分析(表2)。

表2 GEO数据库详细信息
2.2 WGCNA识别HCC与AS中共表达基因WGCNA分析确定MEblue模块(r=0.85,p=9e-0.9)与HCC呈正相关(图1A), MEyellow模块与AS呈正相关(r=0.67,p=6e-0.5)(图1B)。MEblue与MEyellow模块的关键基因提取出来用韦恩图取交集发现HCC与AS中共有227个共表达基因(图2)。
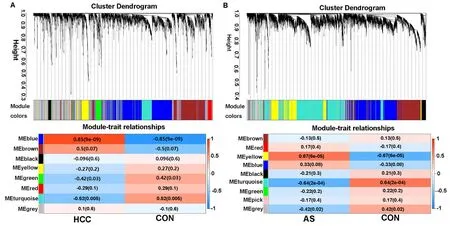
注: A, HCC的模块特征关系热图; B, AS中模块特征关系的热图。
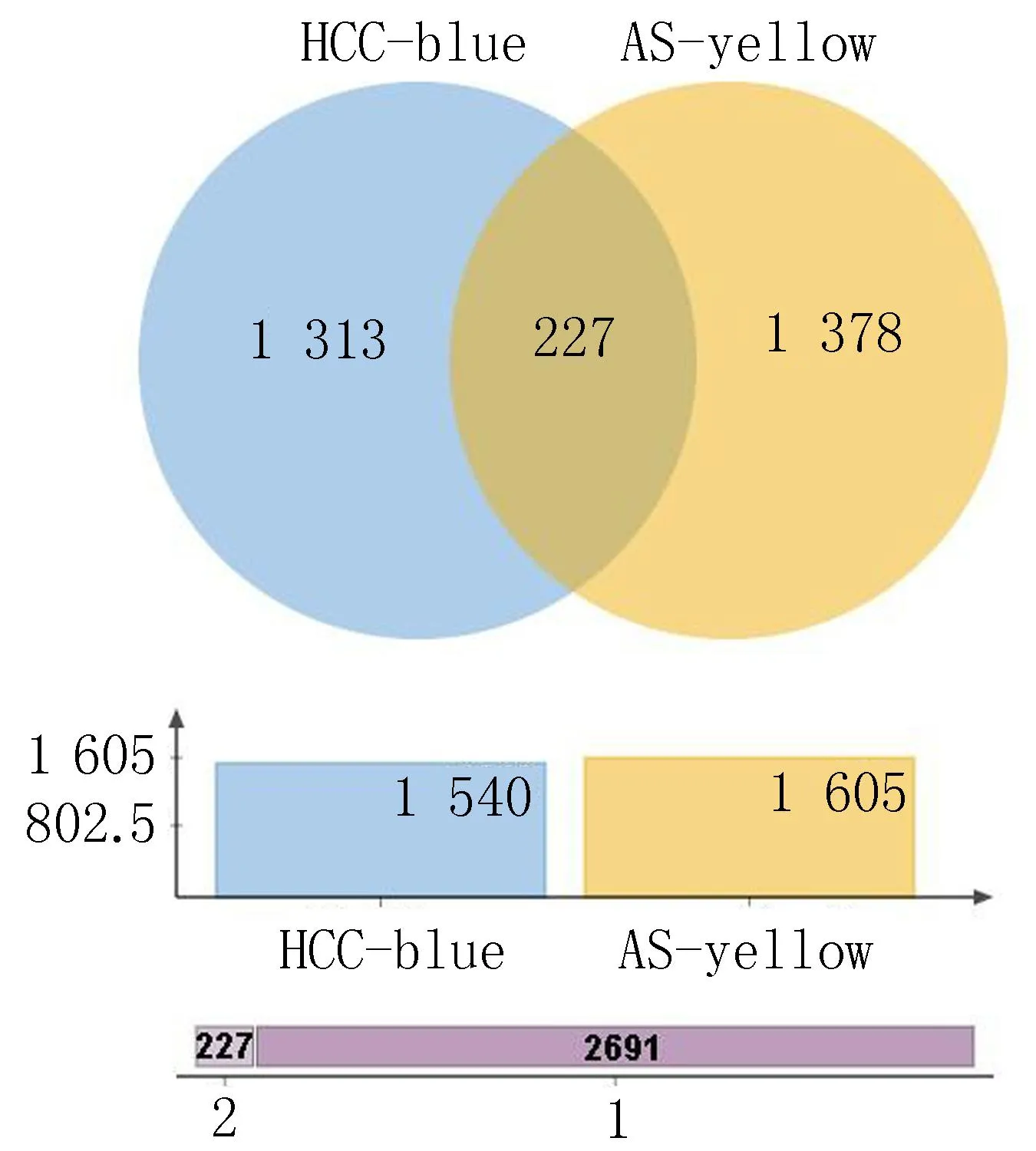
注: HCC的MEblue模块和AS的MEyellow模块之间的共表达基因。
2.3HCC与AS共表达基因的鉴定在GSE25097数据集中共鉴定出1 702个差异表达基因(Differential gene express,DEGs),其中598个上调基因,1 104个下调基因。GSE100927数据集共鉴定506个差异表达基因,其中398个上调基因,108个下调基因,韦恩图取交集后获得了5个共表达差异基因(图3A)。将WGCNA中共表达的227个基因与差异表达的5个共表达基因取交集获得5个共表达基因(图3B)。

注: A, GSE25097和GSE100927差异基因交集韦恩图; B, WGCNA与差异基因的共表达基因。
2.4 差异共表达基因和WGCNA共表达基因的富集分析将WGCNA与差异基因的共表达基因进行富集分析发现HCC与AS生物过程主要作用于RNA聚合酶II启动子转录的负调控(图4A),细胞组分主要存在于细胞核(图4A),分子功能主要为蛋白质结合(图4A),其KEGG信号通路主要富集在MAPK信号通路以及细胞周期通路(图4B)。

注: A, GO 功能富集分析; B, KEGG信号通路富集分析。
2.5 qPCR实验证实了共表达基因在HCC和AS患者PBMCs中的表达收集了15例HCC和AS患者的血液,发现在HCC中,共表达基因mRNA表达和对照组差异有统计学意义(图5)。在AS患者中共表达基因mRNA表达和对照组差异有统计学意义(图6)。
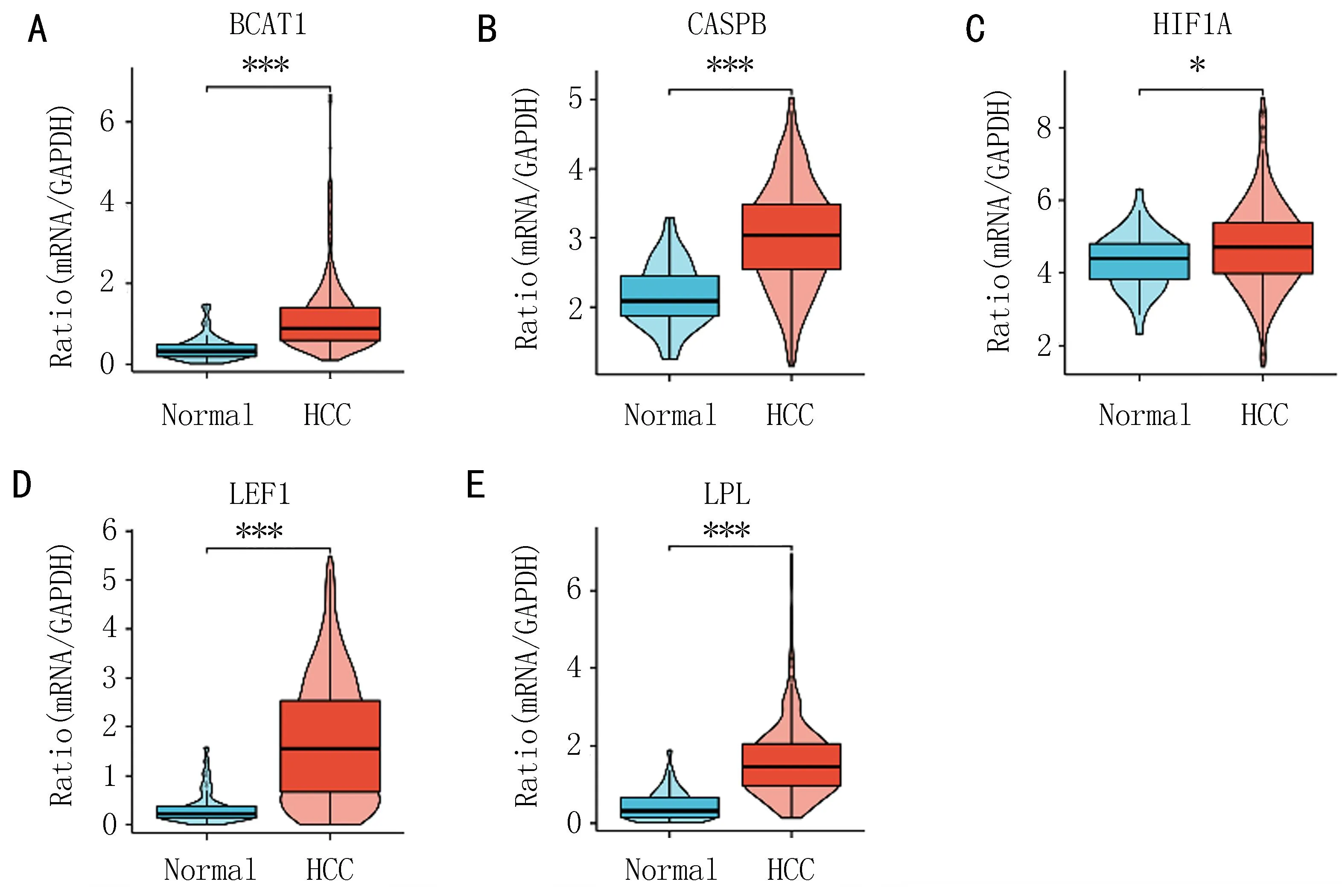
注: ***P<0.001。

注: *P<0.05, **P<0.01, ***P<0.001。
2.6 免疫组织化学和免疫荧光实验验证共表达基因在HCC的表达从7名HCC患者中获取肝组织进行免疫组织化学技术(Immunohistochemistry, IHC)分析,结果显示病灶组织中的共表达基因(HIF1A、CASP8、LEF1、BCAT1 和 LPL)阳性区域均高于远端组织(图7A-E),统计结果显示在HCC中共表达基因在病灶组织中表达高于对照组织 (图7F-J),免疫荧光共定位(Immunofluorescence, IF)结果显示共表达基因的病灶区域阳性细胞均高于远端对照组织(图8A-E)。
3 讨论
HCC是原发性肝癌的主要形式,占所有肝癌发病率的70%至90%[7-8]。AS是一种大中型动脉的慢性炎症性疾病,可引起缺血性心脏病、中风和外周血管疾病,统称为心血管疾病,给社会带来重大的医疗和经济负担[9]。研究表明,AS增加了HCC患者的死亡率[10-11]。
本研究通过整合多源数据库最终确定了HIF1A、CASP8、LEF1、BCAT1、LPL5个共表达基因。有研究表明,CASP8突变与癌症风险增加有关,CASP8高表达与癌症患者预后不良密切相关[12],同时,CASP8还是急性心肌梗死的关键基因[13]。HIF1A下调抑制USF1与ATF2启动子区域的结合,随后抑制ATF2表达,从而抑制AS炎症[14]。HIF1A在HCC的进展中起关键作用,可能是HCC药物开发过程中有希望的治疗靶点[15]。
本研究结果表明,细胞周期过程,在HCC和AS中发挥重要作用。细胞周期失调是人类癌症的共同特征,靶向治疗针对细胞周期阶段可能是癌症治疗的有效方法[16]。有研究表明,非甾体抗炎药通过对细胞周期干预作用抑制血管平滑肌细胞增殖从而达到治疗AS的目的[17]。同时,本研究发现MAPK信号通路在两种疾病中也起到重要的作用。MAPK信号通路,作用于丝裂原活化蛋白激酶,通过磷酸化核转录因子、细胞骨架蛋白及酶类等方式,参与细胞增殖、分化、转化及凋亡的调节,并与炎症、肿瘤等多种疾病的发生密切相关。缺氧诱导的 HIF1A 激活 MAPK14去磷酸化,促进HCC细胞迁移和侵袭[18]。C 反应蛋白可通过 MAPK信号通路激活 HIF1A,在AS中上调脂肪来源干细胞表达以促进血管新生成[19]。脂类沉积和炎症也可能导致这两种疾病的发生,慢性炎症和纤维化被认为是驱动HCC发展的既定因素[20]。炎症在心血管疾病(包括AS)的发病机制中也起着重要作用[21]。有研究表明,异位脂肪沉积(尤其是肝脏脂肪)可能导致AS和心脏代谢风险增加[22],同时过度的肝脏脂肪堆积会导致脂肪肝的形成,中度或重度脂肪肝意味着进行性肝损伤,可导致肝硬化和HCC[23]。因此,炎症和过度脂肪堆积同样可能是HCC和AS病理生理学的共同特征。
本研究的局限性如下:由于缺少AS患者组织的样本,没能在其组织中进行相关实验验证;本研究临床资料不全面,可能导致分析结果出现偏差;HIF1A、CASP8、 LEF1、BCAT1、LPL组成的HCC与AS的共表达基因标志物的预测能力需要更大的样本量进一步研究和验证其有效性。
综上,HIF1A、CASP8、 LEF1、BCAT1、LPL 5个共表达基因可能是HCC与AS的潜在生物学标志物。同时,MAPK信号通路及细胞周期通路在HCC和AS的发生发展中起到关键作用。

