长链非编码RNA-P21在过氧化氢诱导的人晶状体上皮细胞损伤中的表达
董晓鸣 刘雨轩 纪力旸 王静,2 张劲松
1沈阳爱尔卓越眼科医院 爱尔集团眼科医院集团白内障与人工晶状体研究所 沈阳爱尔眼科精准医疗研究所 中国医科大学附属第四医院眼科 中国医科大学眼科医院 辽宁省晶状体研究重点实验室,沈阳 110000;2中南大学爱尔眼科学院,长沙 410000
白内障是世界上首要的致盲眼病,全球范围内有2 000万人因白内障而致盲,年龄相关性白内障(age-related cataract,ARC)是其中常见的一类,占比达50%以上[1]。房水的成分、晶状体囊的通透性、代谢紊乱等多种原因都可引起晶状体蛋白变性,导致晶状体混浊[2]。目前普遍认为氧化应激损伤所致的晶状体上皮细胞(lens epithelial cells,LECs)凋亡是除先天性白内障以外其他所有类型白内障形成的细胞学基础。本研究团队在前期研究中发现正常LECs中p53的mRNA及蛋白表达水平低,而在ARC的LECs中呈高表达,miRNA-125b靶向p53促进LECs凋亡,导致晶状体发生混浊,表明p53在ARC的发生发展中具有重要调控作用[3]。p53作为一种重要的转录因子,是氧化应激反应中调节细胞周期、凋亡的重要分子[4-5]。近年来,随着分子生物学技术的发展,已经发现长链非编码RNA(long-chain non-coding RNA,lncRNA)在眼部疾病中起着重要的调节作用,与LECs的增殖、迁移、分化、凋亡和晶体蛋白修饰密切相关[6-9]。2010年,Huarte等[10]在p53缺失型和野生型小鼠胚胎成纤维细胞DNA损伤模型中通过lncRNAs高通量筛选首次克隆出一种与p53表达密切相关的lncRNA,lncRNA-p21。p53可直接结合于lncRNA-p21的上游调控区,并正向调控lncRNA-p21转录水平。然而,关于lncRNA-p21在白内障发生和发展中的生物学功能及调控机制研究报道较少见。本研究拟以人LECs系HLE-B3细胞为研究对象,通过过氧化氢诱导体外构建氧化损伤模型,验证lncRNA-p21在ARC细胞模型中的表达,明确其在增生凋亡、氧化应激中的生物学功能。
1 材料与方法
1.1 材料
1.1.1细胞来源 人LECs系HLE-B3由中国医科大学附属第四医院眼科晶状体实验室提供。
1.1.2主要试剂及仪器 总蛋白提取试剂盒(P0013B,上海碧云天生物技术股份有限公司);PVDF膜(IPVH00010)、ECL发光液(WBKLS0100)(美国Millipore公司);兔抗Bax抗体(5023S)、兔抗Bcl-2抗体(3498T)(美国CST公司);鼠抗GAPDH抗体(TA-08,北京中杉金桥生物技术有限公司);辣根过氧化物酶标记山羊抗鼠二抗(31430)、辣根过氧化物酶标记山羊抗兔二抗(31460)(美国Thermo Fisher Scientific公司);细胞周期检测试剂盒(BHCK004)(辽宁佰昊生物科技有限公司);DMEM培养基(01-100-1ACS)、磷酸盐缓冲液(phosphate buffer saline,PBS)(C3580-0500)(上海VivaCell公司);胰蛋白酶(03-050-1A)、胎牛血清(04-002-1A)(上海逍鹏生物科技有限公司);3%过氧化氢溶液(88497,瑞士Sigma公司);Caspase-3活性试剂盒(G015-1,南京建成科技有限公司);异丙醇(101636,成都艾科达化学试剂有限公司);氯仿(10006818)、多聚甲醛(80096618)(上海国药集团化学试剂有限公司);无水乙醇(868,沈阳瑞丰科技有限公司);RNAiso Plus裂解液(9108,日本TAKARA公司);GoScriptTM逆转录试剂盒(A5001)、GoTaq®qPCR Master Mix试剂盒(A6001)(美国Promega公司);活性氧检测试剂盒(S0033S)、EdU-555细胞增殖试剂盒(C0075S)、TritonX-100(ST795)(上海碧云天生物技术股份有限公司);Annexin V-FITC凋亡检测试剂盒(BMS500FI,美国eBioscience公司);DAPI染色液(C0060)、抗荧光衰减封片剂(S2100)(北京索莱宝科技有限公司);荧光原位杂交试剂盒(Lnc1031589,广州市锐博生物科技有限公司)。流式细胞仪(EC201827C1,美国Luminex公司);PCR仪(QuantStudioTM3,美国ABI公司);化学发光成像仪(Tanon 5200,上海天能生命科学有限公司)。
1.2 方法
1.2.1MTS比色法检测不同浓度过氧化氢处理细胞活力 收集对数生长期HEL-B3细胞于15 ml离心管中,1 000 r/min(离心半径为7 cm)离心5 min,弃上清;PBS清洗,低速离心后用培养基重悬,制备单细胞悬液,按照1×104/孔接种至96孔板中,每组设4个复孔;置于37 ℃培养箱中培养6 h至细胞贴壁。分别更换0、25、50、100、200、400 μmol/L过氧化氢浓度的培养基。培养24 h后,每孔加入20 μl MTS检测试剂,于5% CO2、37 ℃条件下孵育0.5~1.0 h;于492 nm下读取吸光度(absorbance,A)值。细胞活力=(A实验组-A空白孔)/(A对照组-A空白孔)×100%。
1.2.2MTS比色法检测200 μmol/L过氧化氢处理不同时间点细胞活力 取单细胞悬液,按照1×104/孔接种至96孔板中,每组设4个复孔;置于37 ℃培养箱中培养6 h至细胞贴壁。更换200 μmol/L过氧化氢的培养基。分别培养0、6、12、24、48 h后测量吸光度A值并计算细胞活力。
1.2.3细胞培养和分组 取冻存的LECsHLE-B3,加入含体积分数10%胎牛血清的培养基中,置于37 ℃、含体积分数5% CO2的培养箱中培养48 h。将细胞分为正常对照组和过氧化氢组,过氧化氢组细胞用含200 μmol/L过氧化氢的培养基作用24 h,正常对照组细胞自然生长不做处理。
1.2.4DCFH-DA活性氧荧光探针法检测各组细胞内活性氧水平 参照活性氧检测试剂盒说明,细胞进行分组培养,每组设3个复孔,用预温的PBS洗涤细胞2次,加入现配的无血清培养液稀释的DCFH-DA(终浓度10 μmol/L)200 μl,37 ℃孵育20 min。设置荧光酶标仪激发波长为488 nm,检测525 nm处A值,并计算各组相对正常对照组的活性氧簇(reactive oxygen species,ROS)水平。
1.2.5流式细胞法检测各组细胞的凋亡 取对数生长期细胞按照2×105/孔接种至6孔板中,1 ml每孔,分组处理细胞,每组设3个复孔。另设置不加染色剂的细胞样本作为阴性对照,再设置分别加Annexin V-FITC染液和PI染液的细胞样本作为单染对照。培养48 h,收集细胞,用PBS洗2次,1 000 r/min离心5 min,收集细胞;加入200 μl Binding buffer制备单细胞悬液,每管加入5 μl Annexin V-FITC混匀后,室温避光孵育10 min;用200 μl Binding buffer清洗细胞,1 000 r/min离心5 min,收集细胞,加入190 μl Binding buffer重悬细胞,加入10 μl PI染色液混匀,室温下避光孵育15 min,流式细胞仪上机检测。计算各组细胞凋亡率=早期凋亡细胞百分比+晚期凋亡细胞百分比。
1.2.6Caspase-3活性试剂盒法检测各组细胞中Caspase-3的活性 细胞分组培养,每组设3个复孔。PBS洗涤1次,低速离心,弃去上清;按照每2×106个细胞加入50 μl裂解液的比例添加裂解液,重悬并冰浴裂解30 min,期间涡旋振荡3~4次,每次10 s;12 000 r/min 4 ℃离心10~15 min;小心吸取上清并转移至新1.5 ml离心管中,并放置冰上待用。采用Bradford法测定蛋白浓度,吸取含100 μg蛋白的细胞上清,用裂解液补足至50 μl,加入5 μl Ac-DEVD-pNA后混匀;37 ℃孵育6 h后,测定405 nm下A值,即各组Caspase-3活性。
1.2.7Western blot法检测各组细胞中Bax和Bcl-2蛋白表达 收集各组细胞,利用蛋白快速提取试剂盒提取总蛋白,使用BCA法测定总蛋白浓度。利用SDS-PAGE电泳分离蛋白,并通过湿转膜方式将蛋白质转印到PVDF膜上。取PVDF膜,用5%脱脂奶粉室温封闭1 h,加入Bax、Bcl-2或GAPDH一抗(均1∶1 000稀释)4 ℃孵育过夜,用TBST洗膜3次,每次10 min;加入相应二抗(1∶10 000稀释)室温摇床上孵育1 h,TBST洗膜3次,每次10 min;ECL超敏显色液显色,采用化学发光成像仪进行拍照。采用ImageJ软件分析蛋白条带灰度值,以GAPDH为内参照,计算各组Bax和Bcl-2蛋白相对表达水平。
1.2.8流式细胞法检测各组细胞的周期分布 取对数生长期细胞,按照3×105/孔的密度接种至6孔板中进行分组处理,每组设3个复孔。处理48 h后,收集细胞悬液,1 000 r/min离心5 min,弃掉上清;加入1 ml PBS重悬细胞,转移至1.5 ml EP管中,1 000 r/min离心5 min,弃掉上清;加入1 ml预冷的70%乙醇,离心沉淀细胞,用100 μl PBS重悬细胞。将细胞悬液逐滴加入70%乙醇中,轻轻吹打混匀,-20 ℃固定过夜;1 000 r/min低速离心5 min,弃上清,加入1 ml PBS室温涡旋混匀1 min;1 000 r/min低速离心5 min,弃上清;每管分别加入475 μl PBS,25 μl的20×PI染色液,再加入1 μl RNaseA,混合均匀,室温避光孵育30 min,流式细胞仪上机检测。
1.2.9EDU实验法检测HEL-B3细胞的增殖能力 取对数生长期细胞,按照1×105/孔接种在含有专用细胞爬片的24孔板中,分组培养,每组设9个复孔。按照1∶500稀释比例,配置2×EdU工作液;然后加入等体积37 ℃预热的2×EdU工作液,孵育细胞2 h;4%多聚甲醛溶液室温固定15 min,PBS漂洗3次,每次5 min;配制Click反应液(24孔板每孔量:Click Reaction Buffer 107.5 μl;CuSO45 μl;Azide 555 0.25 μl;Click Additive Solution 12.5 μl),室温避光孵育30 min,PBS漂洗3次,每次5 min;DAPI复染核,PBS漂洗3次,每次5 min;应用抗荧光淬灭剂封片,使用荧光显微镜进行拍照。
1.2.10实时荧光定量PCR法检测HEL-B3细胞lncRNA-p21表达水平 细胞分组培养,每组设3个复孔。收集各组细胞,按照RNA提取试剂盒说明书步骤提取总RNA并测定浓度。使用逆转录试剂盒逆转录成cDNA。PCR反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火及延伸60 s,共40个循环。lncRNA-p21正向引物为5'-GAGGGAGAGTTTTCACTG AATAGCC-3',反向引物为5'-GTAGTTTAGTCAAAA GTGCAGAGCG-3';GAPDH正向引物为5'-TCAAGGC TGAGAACGGGAAG-3',反向引物为5'-TGGACTCCACG ACGTACTCA-3'。以GAPDH为内参,采用2-ΔΔCt法计算各组lncRNA-p21相对表达量。
1.2.11荧光原位杂交实验法检测细胞中LncRNA-p21的定位 细胞分组培养,每组设3个复孔。取各组细胞,多聚甲醛固定1 h,PBS漂洗3次,每次5 min;滴加0.5% TritonX-100室温孵育10 min,PBS漂洗3次,每次5 min;滴加20 μl预杂交液于样本上,盖膜后37 ℃孵育封闭30 min;将探针与杂交液按1∶39比例配制杂交反应液,充分混匀,迅速置于冰上,滴加20~40 μl杂交反应液于待测样本上,盖膜后73 ℃共变性5~8 min,快速转移至37 ℃杂交过夜(16~20 h);甩净残液,放入蒸馏水中,浸泡5 min,53 ℃预热的25%甲酰胺/2×SSC洗涤2次,每次5 min,42 ℃预热的含0.1% TritonX-100/2×SSC洗涤2次,每次5 min,42 ℃预热的0.5×SSC洗涤5 min,42 ℃预热的0.2×SSC洗涤5 min;滴加10~20 μl DAPI避光染色10 min,PBS洗涤2次,每次5 min,避光晾干,滴加10~20 μl抗荧光衰减封片剂封片,于正置荧光显微镜下观察并拍照。
1.3 统计学方法

2 结果
2.1 过氧化氢诱导人LECs氧化损伤模型的构建
MTS实验结果显示,空白对照组,25、50、100、200和400 μmol/L过氧化氢组细胞的存活率总体比较差异有统计学意义(F=204.10,P<0.001),呈浓度依赖的下降趋势,400 μmol/L过氧化氢组细胞活力显著降低,将200 μmol/L作为本研究的后续实验浓度(表1)。200 μmol/L的过氧化氢处理细胞不同时间点组细胞存活率总体比较,差异有统计学意义(F=47.49,P<0.001),细胞的存活率呈时间依赖的下降趋势,其中处理6、12、24和48 h组细胞的存活率均明显低于未处理组,差异有统计学意义(均P<0.05),以24 h作为本研究后续的处理时间(表2)。
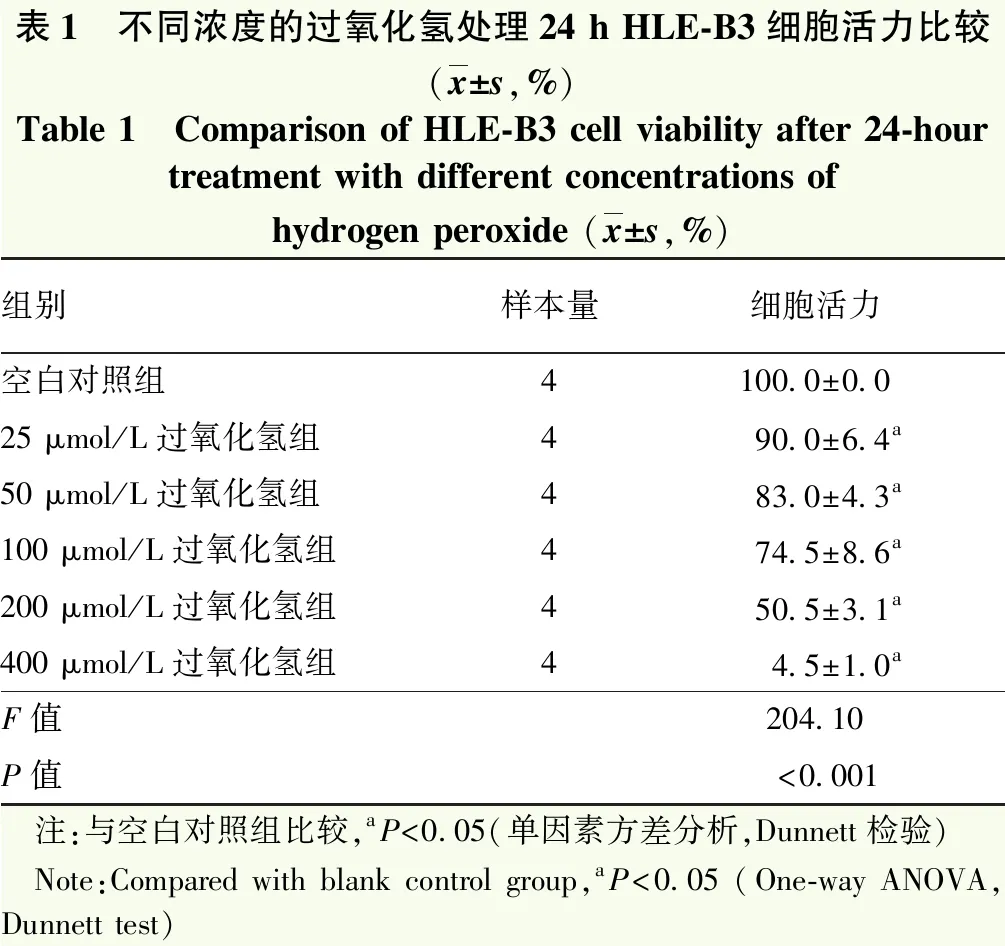
表1 不同浓度的过氧化氢处理24 h HLE-B3细胞活力比较(x±s,%)Table 1 Comparison of HLE-B3 cell viability after 24-hour treatment with different concentrations of hydrogen peroxide (x±s,%)组别样本量细胞活力空白对照组4100.0±0.025 μmol/L过氧化氢组490.0±6.4 a50 μmol/L过氧化氢组483.0±4.3 a100 μmol/L过氧化氢组474.5±8.6 a200 μmol/L过氧化氢组450.5±3.1a400 μmol/L过氧化氢组44.5±1.0 aF值204.10P值<0.001 注:与空白对照组比较,aP<0.05(单因素方差分析,Dunnett检验) Note:Compared with blank control group,aP<0.05 (One-way ANOVA,Dunnett test)

表2 200 μmol/L过氧化氢处理不同时间点HLE-B3细胞活力比较(x±s,%)Table 2 Comparison of HLE-B3 cell viability at different time points after 200 μmol/L hydrogen peroxide induction (x±s,%)组别样本量细胞活力未处理组492.55±1.40处理6 h组479.28±8.39a处理12 h组468.35±4.38 a处理24 h组455.40±3.93 a处理48 h组446.50±5.94 aF值47.49P值<0.001 注:与未处理组相比较,aP<0.05(单因素方差分析,Dunnett检验) Note:Compared with control group,aP<0.05 (One-way ANOVA,Dunnett test)
2.2 过氧化氢组和正常对照组细胞中ROS水平变化
正常对照组和过氧化氢组细胞中ROS含量分别为1.00±0.01和4.65±0.38,过氧化氢组细胞中ROS含量明显高于正常对照组,差异具有统计学意义(t=16.66,P<0.05)(图1)。
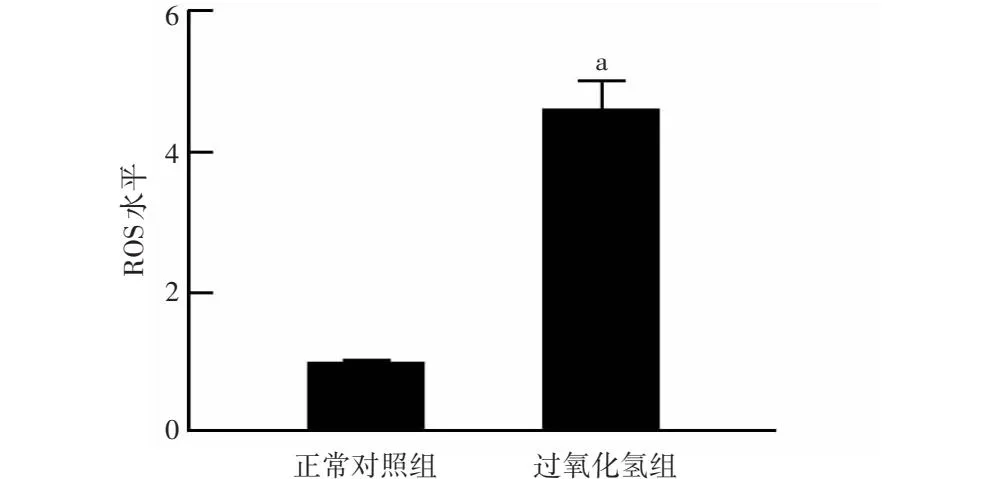
图1 过氧化氢组和正常对照组HLE-B3细胞中ROS水平比较 与正常对照组比较,aP<0.05 (独立样本t检验,n=3) ROS:活性氧簇
2.3 过氧化氢组和正常对照组细胞中凋亡水平变化
流式细胞术结果显示,过氧化氢组细胞凋亡染色较正常对照组明显增多,正常对照组和过氧化氢组细胞凋亡率分别为(0.37±0.07)%和(64.86±5.39)%,组间比较差异具有统计学意义(t=20.69,P<0.05)(图2A、B)。Caspase-3活性试剂盒检测结果显示,正常对照组和过氧化氢组Caspase-3的活性分别为0.026±0.001和0.070±0.002,与正常对照组相比,过氧化氢组Caspase-3的活性显著升高,差异具有统计学意义(t=39.80,P<0.05)(图2C)。Western blot结果显示,过氧化氢组Bax蛋白表达条带强度较正常对照组明显升高,正常对照组和过氧化氢组Bax蛋白相对表达量分别为0.59±0.07和1.19±0.04,差异有统计学意义(t=12.73,P<0.05)(图2D、E);过氧化氢组Bcl-2蛋白相对表达量较正常对照组降低,但差异无统计学意义(P>0.05)(图2F)。

图2 过氧化氢组与正常对照组LECs凋亡水平比较 A:各组细胞凋亡流式细胞图 B:各组细胞凋亡率比较 与正常对照组相比,aP<0.05(独立样本t检验;n=3) C:各组细胞Caspase-3的活性比较 与正常对照组比较,aP<0.05(独立样本t检验;n=3) D:各组Bax和Bcl-2蛋白表达电泳图 E、F:各组Bax和Bcl-2蛋白相对表达量比较 与正常对照组相比,aP<0.05(独立样本t检验;n=3)
2.4 过氧化氢组和正常对照组细胞增殖的变化
与正常对照组相比,过氧化氢组G2期的LECs增多,正常对照组和过氧化氢组G2期细胞比例分别为(9.34±1.01)%和(33.73±1.53)%,差异有统计学意义(t=23.10,P<0.05)(图3A)。EdU实验结果显示,过氧化氢组EDU阳性比例为(25.41±6.99)%,明显低于正常对照组的(50.58±9.15)%,差异有统计学意义(t=6.559,P<0.05)(图3B)。

图3 过氧化氢组和正常对照组LECs增殖能力比较 A:各组细胞周期流式细胞图 B:各组细胞周期分布比较 与正常对照组相比,aP<0.05(独立样本t检验;n=3) C:各组细胞EDU染色免疫荧光图(EDU ×100,标尺=200 μm) D:各组细胞EDU阳性细胞百分比比较 与正常对照组相比,aP<0.05(独立样本t检验;n=9)
2.5 过氧化氢组和正常对照组lncRNA-p21的表达及细胞定位
过氧化氢组lncRNA-p21相对表达量为2.36±0.29,明显高于正常对照组的1.02±0.02,差异有统计学意义(t=7.893,P<0.05)(图4A)。荧光原位杂交实验结果显示,lncRNA-p21定位于细胞质中(图4B)。
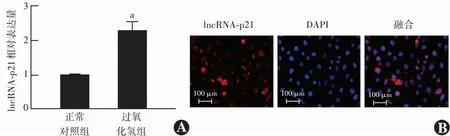
图4 过氧化氢组和正常对照组lncRNA-p21表达及细胞定位 A:与正常对照组相比,aP<0.05(独立样本t检验;n=3) B:人晶状体上皮细胞lncRNA-p21定位的荧光原位杂交图(×200,标尺=100 μm) lncRNA-p21呈红色荧光(Cy3),细胞核呈蓝色荧光(DAPI),lncRNA-p21定位于细胞质
3 讨论
随着人口老龄化,白内障发病率逐年升高,并严重影响国民眼健康水平与社会生产力能力。手术是目前治疗白内障唯一有效的方法,虽然白内障手术设备及屈光性人工晶状体在不断更新换代,但白内障的药物治疗领域尚未取得突破性进展[11-12]。因此,进一步寻找切实可行的治疗靶点以延缓和阻止ARC的发生和发展,具有重要及深远的意义。lncRNAs是近年来发现的一种具有生物学功能的非编码RNA,其转录本长度超过200 nt,在进化中高度保守,参与了转录调节、染色质重塑及组蛋白修饰、可变剪接、分子海绵吸附miRNAs、蛋白质的活性、定位及功能等功能[13-14]。然而,关于lncRNAs在白内障发生和发展中生物学功能及调控机制的研究报道尚少[15]。Shen等[16]发现lncRNA MIAT是白内障的特异性生物标志物,并通过miRNA-150-5p/Akt参与调节LECs的功能,对细胞存活、细胞增殖和凋亡有影响。此外,Cheng等[17]发现,lncRNA H19在ARC患者的晶状体中高表达,敲除lncRNA H19可加重UVB辐射诱导的人LECs氧化损伤,降低细胞存活率和增殖,促进细胞的凋亡。
2010年,Huarte等[9]在p53缺失型和野生型小鼠胚胎成纤维细胞DNA损伤模型中通过lncRNAs高通量筛选首次克隆出一种与p53表达密切相关的长链非编码RNA,lncRNA-p21,位于Ckdn1a(p21)基因座上,其编码区位于两条蛋白质编码基因之间,是5种lncRNAs亚型中的一种。p53可直接结合于lncRNA-p21的上游调控区,并正向调控LncRNA-p21转录水平[18]。自lncRNA-p21的发现,越来越多的研究表明,其与肿瘤明显相关,调控肿瘤细胞的增殖、迁移和侵袭[19-20]。Han等[21]研究证实,lncRNA-p21通过miR130b/PTEN/AKT信号通路抑制骨肉瘤细胞增殖。Shen等[22]研究发现,lncRNA-p21低表达通过HIF-1/Akt/mTOR/P70S6K信号通路减少自噬,从而增加缺氧肿瘤细胞的放疗敏感性。Chen等[23]发现lncRNA-p21通过靶向β-连环蛋白信号通路增强胃癌细胞的放疗敏感性。Wang等[24]发现,lncRNA-p21通过靶向β-catenin/Wnt信号通路,促进结直肠癌细胞的放疗敏感性。
目前普遍认为氧化应激损伤所致的LECs凋亡是除先天性白内障以外其他所有类型白内障形成的细胞学基础。细胞发生氧化损伤时内质网稳态受到干扰,内质网未折叠蛋白/错误折叠蛋白发生堆积,激活未折叠蛋白应答,即内质网应激[25-26]。在本研究中,过氧化氢组HLE-B3细胞ROS含量显著上升,同时细胞凋亡率和Bax蛋白表达显著增加,Bcl-2蛋白表达降低,凋亡蛋白Caspase-3的活性也显著增强。本研究结果还显示,过氧化氢组处于G2期的细胞百分比升高,表明细胞在G2期发生阻滞,最终抑制细胞增殖;过氧化氢组EDU阳性细胞比例明显降低,说明HLE-B3细胞存活率降低,过氧化氢可诱导LECs损伤。
lncRNA发挥作用主要取决其细胞定位,在细胞核中,lncRNA能够调节转录,通常通过充当支架来组装大型染色质重构复合物[27-28];在细胞质中,lncRNA可以充当竞争性内源RNA(ceRNA),与其他RNA转录本竞争相同的miRNA,从而导致相互作用和后续调控[29-30]。本研究通过荧光原位杂交法发现lncRNA-p21定位于细胞质中,推测其可能通过控制miRNA表达来影响其靶基因的表达量。然而本研究未验证lncRNA-p21敲减后对细胞氧化应激损伤的影响,未来需进一步实验验证其因果关系。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明董晓鸣:研究实施、数据采集及分析/解释、文章起草及修改;刘雨轩:研究实施、数据采集;纪力旸:酝酿和设计实验;王静:统计分析、指导研究;张劲松:直接参与选题、酝酿和设计实验、对文章的知识性内容作批评性审阅及定稿

