干扰hsa_circ_0103232对葡萄膜黑色素瘤细胞生物学行为的影响
杨萱 魏文斌
首都医科大学附属北京同仁医院 北京同仁眼科中心 眼内肿瘤诊治研究北京市重点实验室 北京市眼科学与视觉科学重点实验室 医学人工智能研究与验证工信部重点实验室,北京 100730
葡萄膜黑色素瘤(uveal melanoma,UM)是成年人常见的原发性眼内恶性肿瘤,具有恶性程度高、发病隐匿的特点,严重威胁患者的视力乃至生命安全。UM起源于眼球壁的中间葡萄膜层,包括虹膜、睫状体及脉络膜,具有高度侵袭性,约50%的患者会出现转移性UM[1-4]。目前,对于UM缺乏有效的治疗手段,患者的预后和生存率较差,UM发生转移后整体的生存时间为10~12个月[5-6]。因此,深入了解UM的分子机制,进而确定更有效的生物标志物和治疗靶点,对其早期临床诊断、制定预防和治疗策略具有重要意义。环状RNA(circular RNA,circRNA)是一种新型内源性非编码RNA,被认为是哺乳动物中一类稳定的调节转录物[7-8]。circRNA由“反向剪接”反应产生,具有特征性的共价闭环结构,并且在特定细胞类型或发育阶段中特异性表达[9-11]。circRNA具有选择性保守的微小RNA(microRNA,miRNA)靶位点,可以通过miRNA海绵调节下游基因的表达[12]。近年来研究表明,circRNA具有保守性、稳定性、丰富性以及动态性的特点,使其成为新型临床诊断与治疗的重要靶点及标志物;同时,circRNA广泛存在于胶质瘤、乳腺癌、肝癌等多种肿瘤中,是肿瘤发生和发展的重要调节因子[13]。目前,已有部分circRNA被发现可作为皮肤黑色素瘤的潜在靶标,如circ_0062270[14]等,但是circRNA在UM中的研究较匮乏。本课题组先前研究比较circRNA在UM组织和正常葡萄膜组织中的表达[15],探讨了多个circRNA作为UM诊断与预后标志物的可能,发现与正常葡萄膜组织相比,hsa_circ_0103232在UM组织中呈高表达,表明hsa_circ_0103232有望成为UM治疗新的潜在靶点。此外,Lin等[16]研究发现hsa_circ_0103232可能通过miR-661增强RAB3D的表达来促进皮肤黑色素瘤(SKMel1、A375和A875)的进展,进一步提示了hsa_circ_0103232在黑色素瘤中的作用。但尚未见hsa_circ_0103232对UM细胞作用的研究报道。本研究旨在探讨干扰hsa_circ_0103232对UM细胞C918和MUM2B增殖、迁移、周期和凋亡的影响。
1 材料与方法
1.1 材料
1.1.1细胞及小干扰RNA来源 C918和MUM2B细胞株购自中国科学院细胞培养库。3个靶向hsa_circ_0103232的小干扰RNA(small interfering RNA,siRNA)(si-hsa_circ_0103232#1、si-hsa_circ_0103232#2、si-hsa_circ_0103232#3)及阴性对照(siCtrl)由湖州河马生物科技有限公司设计合成。
1.1.2主要试剂及仪器 胎牛血清(04-002-1A,以色列BI公司);RPMI-1640培养基(42401042)、胰蛋白酶(25200-072)(美国Gibco公司);1%青霉素-链霉素-两性霉素B(上海碧云天生物技术有限公司);Trizol(Cat#15596018,美国Ambion公司);实时荧光定量PCR试剂盒(Cat#G891,加拿大Abm公司);Primer Script RT 试剂盒[RR014A,宝日医生物技术(北京)有限公司];TransStart Tip Green qPCR SuperMix(AQ141-01,北京全式金公司生物技术有限公司);结晶紫水溶液(R20755,上海源叶生物科技有限公司);4%多聚甲醛(上海国药集团化学试剂有限公司);细胞计数试剂盒(cell counting kit,CCK)-8(40203ES80)、细胞周期检测试剂盒(40301ES60)[翌圣生物科技(上海)股份有限公司];凋亡试剂盒(88-8007,美国Thermo Fisher Scientific公司);Transwell试剂盒(3422,美国Corning公司);Cyanine 3标记的hsa_circ_0103232探针、荧光原位杂交试剂盒(广州锐博生物科技有限公司)。Real-time PCR仪(7500Fast DX,美国Thermo Fisher Scientific公司);流式细胞仪(CytoFLEX FCM,美国Beckman公司);荧光显微镜(IX71,日本Olympus公司);倒置显微镜(U2-RFLT100,美国SPW industrial公司);CO2培养箱(MCO-18AC,日本PHCbi公司);低速离心机(L3-5K,湖南可成仪器设备有限公司);超净工作台(KLCZ-880A,北京亚泰科隆仪器技术有限公司);酶标仪(Infinite F50,瑞士Tecan公司)。
1.2 方法
1.2.1细胞培养 取C918和MUM2B细胞株,置于含10%胎牛血清和1%青霉素-链霉素-两性霉素B的RPMI-1640培养基中,于37 ℃、5% CO2的培养箱中培养。细胞培养3 d后传代,待细胞处于对数生长期后进行后续研究。
1.2.2实时荧光定量PCR检测各siRNA的干扰效果 取对数生长期C918和MUM2B细胞,接种至6孔板,细胞接种密度为2×105/孔,分为阴性对照(siCtrl)组、si-hsa_circ_0103232#1组、si-hsa_circ_0103232#2组和si-hsa_circ_0103232#3组。当细胞融合度达70%~80%时,替换为不含胎牛血清和青霉素-链霉素-两性霉素B的培养基;培养4 h后,使用RNAimax转染试剂分别将siCtrl、si-hsa_circ_0103232#1、si-hsa_circ_0103232#2和si-hsa_circ_0103232#3转染到各组细胞中,继续培养48 h。干扰序列如下:si-hsa_circ_0103232#1为5'-CUUGAUCUUGGUCACUCACAA-3';si-hsa_circ_0103232#2为5'-AUCUUGAUCUUGGUCAC UCAC-3';si-hsa_circ_0103232#3为5'-UUCAUCUUGAU CUUGGUCACU-3';siCtrl为5'-UUCUCCGAACGUGUCA CGU-3'。弃去培养基,使用PBS洗涤细胞2次。在6孔板中直接加入1 ml Trizol裂解细胞。提取细胞总RNA并逆转录为cDNA;按照实时荧光定量PCR试剂盒说明书进行PCR扩增。引物序列如下:hsa_circ_0103232正向引物序列为5'-CTCAATTCGTTTGTCCC TGGC-3',反向引物序列为5'-GGACACCGTCTCTCTGG TCA-3';β-actin正向引物序列为5'-CATGTACGTTGC TATCCAGGC-3',反向引物序列为5'-CTCCTTAATGTC ACGCACGAT-3'。PCR扩增程序:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。反应体系:TransStart Tip Green qPCR Super Mix 10 μl,正、反向引物各1 μl,模板1 μl,双蒸水补齐至20 μl。以β-actin为内参,采用2-ΔΔCt法计算hsa_circ_0103232相对表达量。
1.2.3细胞分组转染 取处于对数生长期的C918和MUM2B细胞,按3×105/孔分别接种至6孔板中,分为siCtrl组和si-hsa_circ_0103232组。参照1.2.2部分方法分别将siCtrl和si-hsa_circ_0103232转染到各组细胞,转染后24 h更换完全培养基进行后续实验。
1.2.4CCK-8法检测细胞活力 取对数生长期C918和MUM2B细胞,调整细胞浓度至1 000/μl,按100 μl/孔接种于96孔板中;常规培养24 h后按照1.2.3方法分组转染相应siRNA,并置于37 ℃、5% CO2培养箱中分别培养24、48、72和96 h。每孔加入10 μl CCK-8溶液后,将培养板置于培养箱内孵育4 h。使用酶标仪测定在450 nm处的吸光度(absorbance,A)值。细胞活力(%)=(A干扰组-A空白溶剂孔)/(AsiCtrl组-A空白溶剂孔)×100%。实验重复3次。
1.2.5细胞克隆形成实验检测细胞增殖能力 分别收集转染后的C918和MUM2B细胞,将MUM2B细胞按1 600/孔或C918细胞按2 400/孔分别接种于6孔板,每3 d换液1次,持续培养15 d。磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤1次,每孔加入1 ml 4%多聚甲醛,固定30~60 min,PBS洗涤1次。每孔加入结晶紫水溶液(1∶1稀释)500 μl,染色15 min。双蒸水洗涤数次,晾干,数码相机拍照,并进行细胞克隆计数。实验重复3次。
1.2.6Transwell实验检测细胞迁移能力 分别收集转染后的C918和MUM2B细胞,加入培养基重悬细胞并调整C918细胞和MUM2B细胞浓度分别为2×106和3×107/ml。取100 μl细胞悬液加入Transwell小室上层,置于细胞培养箱中,培养24 h。弃去小室上、下层液体后重新向24孔板中加入500 μl PBS,小室中加200 μl PBS,静置清洗5 min。弃去PBS,向24孔板小孔内加入500 μl甲醇固定10 min,弃甲醇,向24孔板小孔内加入500 μl结晶紫染色液染色20 min。向小孔内重新加入500 μl PBS,使用棉签轻轻擦拭小室底膜上层细胞,PBS清洗小室底膜,10 min/次,清洗3次。将Transwell小室置于透明、干净载玻片上,光学显微镜下观察并拍照。实验重复3次。
1.2.7流式细胞术检测细胞周期 分别收集转染的C918和MUM2B细胞,1 000×g离心5 min,弃上清,使用1 ml预冷PBS清洗细胞1次,离心收集细胞。细胞沉淀使用1 ml预冷70%乙醇轻轻混匀,4 ℃固定过夜。1 000×g离心5 min沉淀细胞。使用1 ml预冷PBS重悬细胞,1 000×g离心5 min沉淀细胞。在0.25 ml染色缓冲液中加入5 μl碘化丙啶(propidium iodide,PI)溶液和10 μl RNaseA溶液,避光静置15 min,进行流式细胞仪上机检测。采用CytExpert(Version 2.4,美国Beckman Coulter公司)分析软件进行细胞DNA含量和光散射分析,并计算细胞周期的分布情况。实验重复3次。
1.2.8流式细胞术检测细胞凋亡 分别收集转染后的C918和MUM2B细胞。使用PBS洗涤细胞1次后,低速离心收集细胞,使用1倍结合缓冲液重悬细胞。向100 μl细胞悬液中加入5 μl荧光染料偶联的Annexin V-FITC和5μl PI染液,室温避光孵育15 min。制备好的细胞悬液在4 h内进行流式细胞仪上机检测。采用流式分析软件CytExpert对实验结果进行分析,计算细胞凋亡率。实验重复3次。
1.2.9荧光原位杂交实验确定hsa_circ_0103232在细胞中的定位 分别将C918和MUM2B细胞接种于6孔板中,置于37 ℃、5% CO2培养箱中培养24 h。采用hsa_circ_0103232探针标记细胞,采用荧光原位杂交试剂盒检测hsa_circ_0103232表达信号,使用DAPI进行细胞核染色。荧光显微镜下观察细胞中hsa_circ_0103232的表达情况和定位,hsa_circ_0103232表现为红色荧光,细胞核为蓝色荧光[16],以18S和U6作为内参对照,18S分布在细胞质中,U6分布在细胞核中。
1.3 统计学方法

2 结果
2.1 各组siRNA干扰效果比较
实时荧光定量PCR结果显示,在C918细胞中,各组hsa_circ_0103232相对表达量总体比较差异有统计学意义(F=19.10,P=0.008),其中si-hsa_circ_0103232#1组hsa_circ_0103232的相对表达量为0.263±0.016,si-hsa_circ_0103232#2组为0.237±0.108,对照组表达量为1.013±0.008,而si-hsa_circ_0103232#3靶点对hsa_circ_0103232表达无干扰效果。si-hsa_circ_0103232#1与siCtrl组比较差异有统计学意义(P<0.05)(图1A)。在MUM2B细胞中,各组hsa_circ_0103232相对表达量总体比较差异有统计学意义(F=49.17,P<0.001),其中si-hsa_circ_0103232#1组相对表达量为0.469±0.028,对照组相对表达量为1.004±0.108,而si-hsa_circ_0103232#2和si-hsa_circ_0103232#3组相对表达量分别为0.620±0.074和0.533±0.012,差异均有统计学意义(均P<0.05)(图1B)。因此,选择si-hsa_circ_0103232#1进行下一步研究。
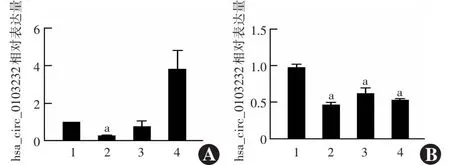
图1 各组hsa_circ_0103232相对表达量比较(单因素方差分析,LSD-t检验,n=3) A:C918细胞中各组hsa_circ_0103232表达量比较 F=19.10,P=0.008.与siCtrl组比较,aP<0.001 B:MUM2B细胞中各组hsa_circ_0103232表达量比较 F=49.17,P<0.001.与siCtrl组比较,aP<0.001 1:siCtrl组;2:si-hsa_circ_0103232#1组;3:si-hsa_circ_0103232#2组;4:si-hsa_circ_0103232#3组
2.2 各组不同时间点细胞活力和细胞克隆数比较
CCK-8检测结果表明,与siCtrl组相比,si-hsa_circ_0103232组C918和MUM2B细胞转染后各时间点的增殖活力均显著降低。相较于转染第1 d,转染后4 d,C918细胞中si-hsa_circ_0103232组的细胞活力为(135.99±0.90)%,显著低于siCtrl组的(210.62±2.56)%,差异有统计学意义(t=38.86,P<0.001);MUM2B细胞中si-hsa_circ_0103232组的细胞活力为(202.36±9.20)%,显著低于siCtrl组的(248.91±0.53)%,差异有统计学意义(t=7.141,P<0.01)(图2)。细胞克隆形成实验结果显示,C918细胞中si-hsa_circ_0103232组细胞克隆数为(12±1)个,显著低于siCtrl组的(28±4)个,差异有统计学意义(t=4.93,P=0.008);MUM2B细胞中si-hsa_circ_0103232组细胞克隆数为(45±7)个,显著低于siCtrl组的(83±3)个,差异有统计学意义(t=7.42,P=0.002)(图3)。
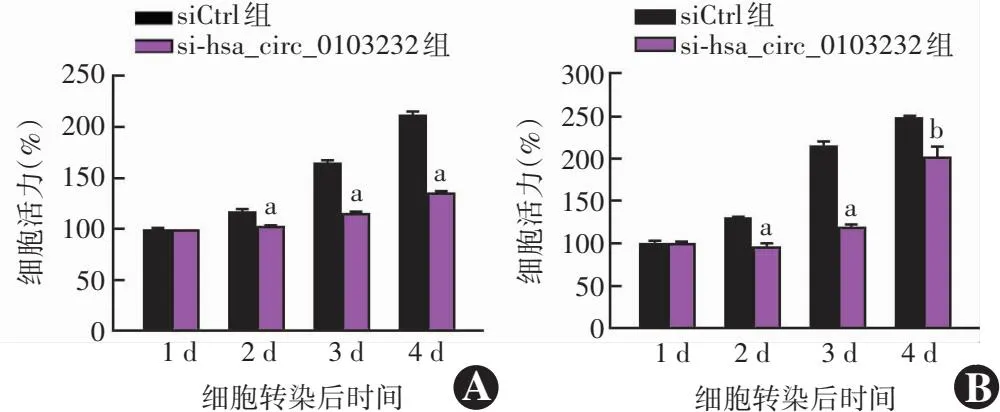
图2 各组不同时间点细胞活力比较(独立样本t检验,Bonferroni校正,n=3) A:各组不同时间点C918细胞活力比较 与相应时间点siCtrl组比较,aP<0.001 B:各组不同时间点MUM2B细胞活力比较 与相应时间点siCtrl组比较,aP<0.001,bP<0.01 siCtrl:阴性对照siRNA;si-hsa_circ_0103232:靶向hsa_circ_0103232的siRNA

图3 各组细胞克隆数量比较 A:各组C918细胞克隆形成情况(结晶紫×200) B:各组C918细胞形成克隆数比较 与siCtrl组比较,aP<0.05(独立样本t检验,n=3) C:各组MUM2B细胞克隆形成情况(结晶紫×200) D:各组MUM28细胞克隆数比较 与siCtrl组比较,aP<0.05(独立样本t检验,n=3) 1:siCtrl组;2:si-hsa_circ_0103232组
2.3 各组细胞迁移能力比较
Transwell检测结果显示,C918细胞中si-hsa_circ_0103232组迁移细胞数为(4±1)个,显著低于siCtrl组的(37±12)个,差异有统计学意义(t=3.91,P=0.017);在MUM2B细胞中si-hsa_circ_0103232组迁移细胞数为(24±2)个,显著低于siCtrl组的(57±3)个,差异有统计学意义(t=10.80,P<0.001)(图4)。

图4 各组C918和MUM2B细胞迁移数比较 A:各组C918细胞迁移情况(结晶紫×200) B:各组C918细胞迁移数比较 与siCtrl组比较,aP<0.05(独立样本t检验,n=3) C:各组MUM2B细胞迁移情况(结晶紫×200) D:各组MUM2B细胞迁移数比较 与siCtrl组比较,aP<0.05(独立样本t检验,n=3) 1:siCtrl组;2:si-hsa_circ_0103232组
2.4 各组不同细胞周期比例比较
流式细胞术结果显示,C918细胞中si-hsa_circ_0103232组G0/G1期细胞比例为(84.33±0.07)%,显著高于siCtrl 组的(70.51±0.48)%,S期和G2/M期细胞比例分别为(5.56±0.33)%和(9.92±0.10)%,均显著低于siCtrl组的(11.28±0.24)%和(17.98±0.56)%,差异均有统计学意义(t=40.50、33.70、20.00,均P<0.001);MUM2B细胞中si-hsa_circ_0103232组G0/G1期细胞比例为(51.27±0.68)%,显著高于siCtrl组的(47.48±0.75)%,G2/M期细胞比例为(44.08±1.80)%,显著低于siCtrl组的(49.32±0.76)%,差异均有统计学意义(t=5.286、3.79,均P<0.05)(图5)。

图5 各组不同细胞周期分布比较 A:各组C918细胞周期分布流式细胞图 B:各组C918细胞周期分布量化比较 与相应细胞周期siCtrl组比较,aP<0.001(独立样本t检验,n=3) C:各组MUM2B细胞周期分布流式细胞图 D:各组MUM2B细胞周期分布量化比较 与相应细胞周期siCtrl组比较,aP<0.05(独立样本t检验,n=3) siCtrl:阴性对照siRNA; si-hsa_circ_0103232:靶向hsa_circ_0103232的siRNA
2.5 各组细胞凋亡率比较
流式细胞术结果显示,si-hsa_circ_0103232组C918和MUM2B细胞凋亡率分别为(15.46±0.23)%和(14.90±0.66)%,均显著多于siCtrl组的(9.31±0.05)%和(5.79±0.14)%,差异均有统计学意义(t=36.83、19.02,均P<0.001)(图6)。
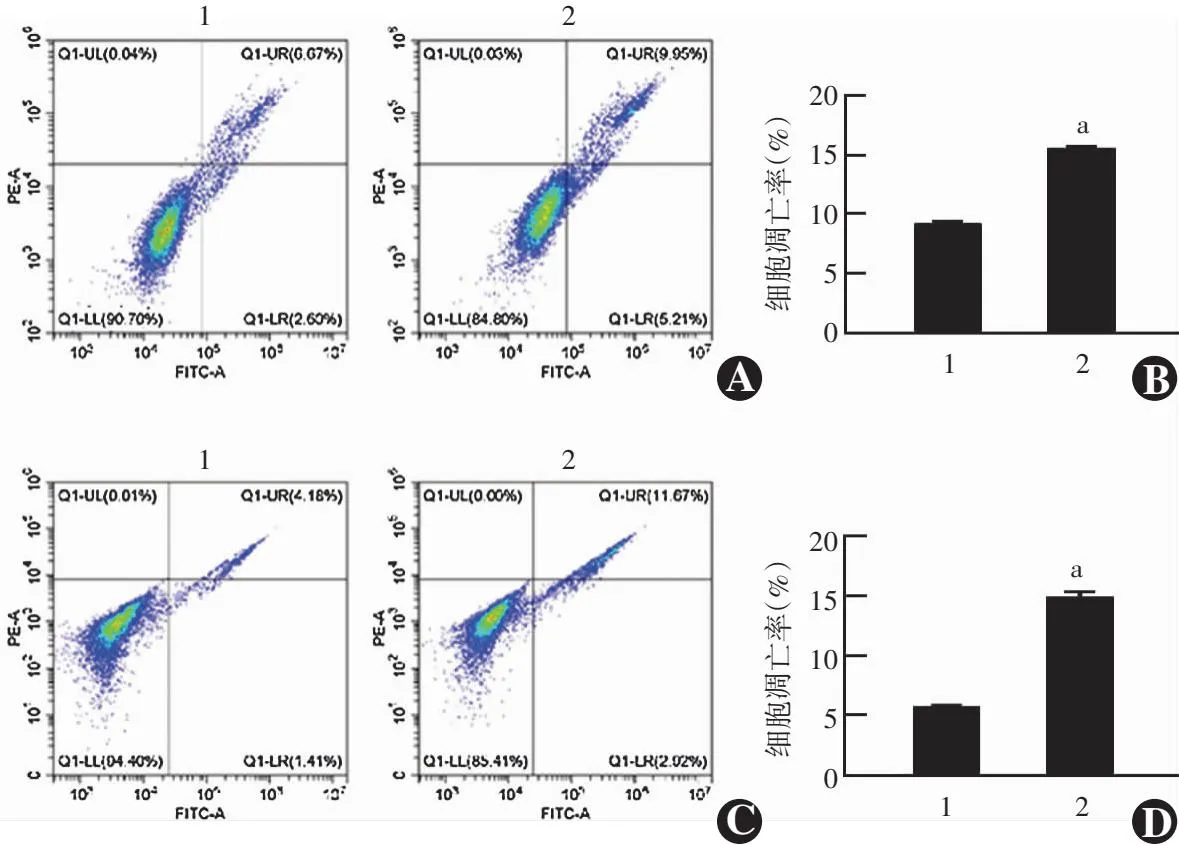
图6 各组细胞凋亡数比较 A:各组C918细胞凋亡流式细胞图 B:各组C918细胞凋亡率比较 与siCtrl组比较,aP<0.001(独立样本t检验,n=3) C:各组MUM2B细胞凋亡流式细胞图 D:各组MUM2B细胞凋亡数比较 与siCtrl组比较,aP<0.001(独立样本t检验,n=3) 1:siCtrl组;2:si-hsa_circ_0103232组
2.6 hsa_circ_0103232在C918和MUM2B细胞中的定位
荧光原位杂交实验结果显示,hsa_circ_0103232与细胞核染色存在共定位,hsa_circ_0103232主要在细胞核中表达(图7)。
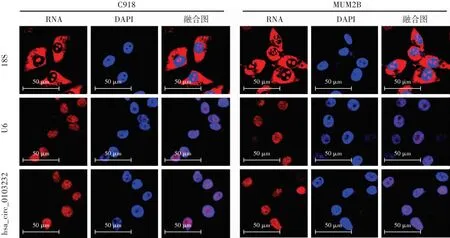
图7 hsa_circ_0103232在C918和MUM2B细胞中荧光原位杂交定位情况(标尺=50 μm) 内参探针18S、U6、hsa_circ_0103232 RNA染色均为红色荧光(Alexa Fluor 594),细胞核染色均为蓝色荧光(DAPI)
3 讨论
UM患者常见的临床表现为无痛性视力下降、视野缺损、光幻觉或虹膜颜色改变等;约30%的UM患者无症状,仅能通过常规眼底检查发现[17]。目前,UM有多种治疗方式,包括经质子束放射治疗、巩膜敷贴放射治疗、经瞳孔温热疗法、激光光凝和肿瘤局部切除以及眼球摘除等[18]。UM早期可发生肿瘤转移,转移至肝脏、肺部和骨骼,分别约占89%、29%和17%[19-21]。目前,UM患者在诊断后5、15、25和35年的病死率分别为31%、45%、49%和52%[5,22]。现阶段,UM诊断和预后的有效分子标志物及治疗靶点仍十分欠缺,亟待使用新的研究思路和手段来发掘UM转移过程中的关键调控因子,为UM的临床诊疗提供新的线索。
circRNA早期被认为是转录错误或副产物[23];近年来,circRNA因其在恶性肿瘤发生和发展中的重要调控作用已成为肿瘤领域的研究热点[22]。CiRS-7是一种经典的促癌circRNA,在多种肿瘤中呈异常高表达,包括肝癌、肺癌、结直肠癌、乳腺癌和食管癌等;研究表明其可竞争结合抑癌基因miR-7,拮抗miR-7对PI3K/AKT、ERGF等促肿瘤增生信号通路的抑制作用,进而增强肿瘤细胞的增殖能力[24]。circRNA对肿瘤细胞的侵袭转移能力具有重要调控作用,可激活多个信号通路以促进肿瘤的转移。有研究发现,circRNA-51217在前列腺癌组织及细胞株中高表达,并与miRNA-646竞争性结合,可能导致转化生长因子β1(transforming growth factor-β1,TGF-β1)的表达增加,诱导TGFβ1/p-Smad2/3信号通路的激活,以增强前列腺癌细胞侵袭浸润与转移[25]。综上,circRNA的异常表达可调控肿瘤细胞的增殖、迁徙等生物学行为,在肿瘤的发生和发展中起重要作用。
本课题组前期通过微阵列揭示hsa_circ_0103232在UM组织中呈高表达,表明其可能参与UM的进展[15]。本研究中采用siRNA干扰C918和MUM2B细胞中hsa_circ_0103232的表达并观察细胞增殖、转移能力变化,发现干扰hsa_circ_0103232能显著降低C918和MUM2B细胞活力,减少克隆形成,有效抑制细胞增殖和转移。本研究还发现,干扰hsa_circ_0103232后,细胞周期受抑制,且凋亡数量显著增加。以上结果均表明,敲低hsa_circ_0103232能抑制细胞增殖转移、促进凋亡,提示hsa_circ_0103232可能具有癌基因的角色,或可作为UM的治疗靶点。本研究荧光原位杂交实验结果显示hsa_circ_0103232在细胞核中表达,与Lin等[16]hsa_circ_0103232在细胞质中的报道不一致,这可能是由于不同种类细胞的差异造成。
综上所述,本研究结果显示hsa_circ_0103232定位在UM细胞的细胞核中;干扰hsa_circ_0103232能显著抑制UM细胞的增殖、迁移和细胞周期进程,促进细胞凋亡。本研究的局限性在于缺乏动物实验以对hsa_circ_0103232进行深入的发展和转移分子机制的探究,这也将是本课题组下一步研究重点。本研究探讨了circRNA在UM中的作用,hsa_circ_0103232可能成为抑制UM进展的潜在治疗靶点,为UM的疾病控制与治疗提供了新方向。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明杨萱:直接参与选题、酝酿和设计实验、起草文章、实施研究、采集数据、分析/解释数据、对文章知识性内容的审阅;魏文斌:直接参与选题、酝酿和设计实验、对文章智力性内容的修改及定稿

