不同非甾体类抗炎药物对超声乳化白内障吸除联合IOL植入术后抗炎效果的随机对照研究
葛佳佳 刘晴 周金燕 单晓娜 黄钰森
山东第一医科大学附属眼科研究所 山东第一医科大学附属青岛眼科医院 山东省眼科学重点实验室-省部共建国家重点实验室培育基地 山东第一医科大学眼科学院,青岛 266000
白内障是一种可致盲眼病,随着白内障手术技术和显微器械的改进,手术的创伤性逐渐降低。然而,由于超声乳化释放的热能和手术的机械创伤,白内障术后非感染性炎症反应仍不可避免[1-5]。术后不加控制的炎症反应可能会导致严重的不良反应,如虹膜后粘连、葡萄膜炎、假性黄斑水肿和继发性青光眼等。因此,有效控制炎症是白内障手术管理的重要环节[6-8]。局部糖皮质激素类药物是术后眼部抗炎的重要手段,但其长时间使用可能会引眼压升高、抗感染能力下降等不良反应[9]。非甾体抗炎药也是一种有效的眼部术后炎症治疗药物[5,10]。白内障术后的眼部炎症可能由血-视网膜屏障破坏和视网膜内液体积聚引发,导致一系列炎症事件[11-12]。这些炎症反应可能导致术后由短暂性视力损害变为永久性视力损害。双氯芬酸钠可通过抑制环氧化酶来抑制前列腺素的生成和白三烯的合成,是一种强效非甾体类抗炎药[13]。传统的双氯芬酸钠滴眼液具有多靶点特性,但由于其较强的刺激性及含有防腐剂,现已逐渐被溴芬酸钠滴眼液取代。新型双氯芬酸钠滴眼液采用独立包装,不含防腐剂,且含有玻璃酸钠成分,可减轻刺激症状。目前关于新型双氯芬酸钠滴眼液用于白内障术后的研究较少。本试验旨在评价新型双氯芬酸钠滴眼液治疗超声乳化白内障吸除联合人工晶状体(intraocular lens,IOL)植入术后炎症反应的有效性及安全性。
1 资料与方法
1.1 一般资料
采用随机双盲临床对照研究方法,纳入2020年10月至2021年2月于山东第一医科大学附属青岛眼科医院诊断为年龄相关性白内障并拟行微切口超声乳化白内障吸除联合IOL植入术患者90例90眼,其中男43例43眼,女47例47眼。若双眼均符合入组标准,纳入其接受手术的第一只眼。纳入标准:(1)年龄40~85岁;(2)诊断为年龄相关性白内障者;(3)按白内障LOCSⅢ分级方法,晶状体核硬度Ⅱ~Ⅲ级者。排除标准:(1)既往患有青光眼、葡萄膜炎、眼底病变等眼部疾病者;(2)有角膜斑翳、角膜荧光素染色阳性等;(3)有眼部外伤史者;(4)患有糖尿病、自身免疫性疾病等全身疾病者;(5)手术过程中出现后囊破裂、玻璃体脱出等;(6)无法配合完成术前检查及无法保证按时完成术后随访要求者;(7)术前1个月内曾口服、注射或外用过类固醇、非甾体类抗炎药、免疫抑制剂等抗炎药物者;(8)患有严重心、肺、肝、肾功能障碍者。采用随机数字表法将患者随机平均分为双氯芬酸钠组和溴芬酸钠组,每组45例45眼。2个组患者性别构成比、年龄、眼别构成比比较,差异均无统计学意义(均P>0.05)。本研究遵循《赫尔辛基宣言》,并经山东第一医科大学附属青岛眼科医院伦理委员会批准(批文号:青眼伦审(快)[2020]60号)。所有患者术前均被告知手术及术后用药相关事宜并签署知情同意书。

表1 2个组患者基线资料比较Table 1 Comparison of baseline data between two groups组别例数/眼数性别构成比∗(男/女,n)年龄#(x±s,岁)眼别构成比∗(右/左,n)双氯芬酸钠组45/4522/2366.29±4.1923/22溴芬酸钠组45/4521/2464.96±4.9925/20χ2/t值0.0451.3830.179P值0.8330.1700.673 注:(∗:χ2检验;#:独立样本t检验) Note:(∗:χ2 test;#:Independent samples t-test)
1.2 方法
1.2.1眼科一般检查 术前常规眼科检查包括裸眼视力和最佳矫正视力、非接触式眼压计测量、裂隙灯显微镜检查、扩瞳后眼底检查、黄斑光学相干断层扫描(optical coherence tomography,OCT)检查等。
1.2.2手术方法 采用标准超声乳化白内障吸除联合IOL植入术,手术均由同一位经验丰富的医师采用超声乳化白内障仪(美国眼力健公司)完成。术前采用0.5%复方托吡卡胺滴眼液(日本参天制药株式会社)扩瞳,0.5%盐酸丙美卡因滴眼液(美国爱尔康公司)点眼行表面麻醉,术眼行2.5 mm透明角膜切口,前房注入粘弹剂,连续环形撕囊,超声乳化晶状体核块,注吸残留皮质后,植入后房型IOL于囊袋内,水密角膜切口。结膜囊0.3%妥布霉素地塞米松眼膏(美国爱尔康公司)涂眼,术毕。
1.2.3围手术期用药 双氯芬酸钠组患者采用0.1%双氯芬酸钠滴眼液(0.4 ml∶0.4 mg,沈阳兴齐眼药公司,国药准字H20123455)点眼,4次/日;溴芬酸钠组采用0.1%溴芬酸钠滴眼液(5 ml∶5 mg,日本千寿制药株式会社,批号:K139)点眼,2次/日;2个组均持续给药6周。2个组术前3 d及术后均常规用0.3%加替沙星眼用凝胶(沈阳兴齐眼药公司)点眼,3次/日;术后均使用1%泼尼松龙滴眼液(爱尔兰爱力根公司)点眼,4次/日,连续使用2周。
1.2.4评估指标 分别于术前及术后1 d、1周和6周进行眼部常规检查,包括视力、非接触性眼压和裂隙灯显微镜检查。同时由同一位医师分别对2个组患者进行主观症状、客观症状及安全性评分。
1.2.4.1主观症状评估 分别于术前及术后1 d、1周、6周根据患者临床症状进行评分,包括眼痛、畏光、流泪和异物感4个方面,每个方面根据程度分为4个等级,各记为0~3分。评分标准:无症状为0分、轻度为1分、中度为2分、重度为3分。计算各方面评分的总分值。
1.2.4.2客观症状评估 (1)基础泪液分泌试验(Schirmer Ⅰ test,SⅠt) 分别于术前及术后1周、6周将泪液分泌检测试纸条(天津晶明新技术开发有限公司)一端反折5 mm,轻置于患者结膜囊中外1/3处,嘱患者轻闭眼,5 min后取下,将试纸条变色读数记为泪液分泌量。(2)非接触式泪膜破裂时间(non-invasive tear break-up time,NIBUT) 分别于术前及术后1周、6周采用干眼分析仪(德国Oculus公司)进行干眼常规检查,记录泪膜破裂时间。(3)角膜荧光素染色评分 分别于术后1 d、1周及6周在裂隙灯显微镜钴蓝光照射下观察角膜荧光素染色情况。将角膜分为中央、上方、颞侧、鼻侧和下方5个区域进行角膜荧光素染色评分,每一区域评分记为0~3分。其中,每个区域无染色为0分,1~30个荧光素染色点为1分;>30个荧光素染色点且未融合为2分;有丝状物附着、点状病变融合、溃疡为3分。5个区域的分数之和为最终评分。(4)前房闪辉分级 分别于术前及术后1 d、1周、6周采用裂隙灯显微镜测定前房闪辉。0级为无闪辉;1级为轻度闪辉,以灰色瞳孔区域为背景时可以看到,但以虹膜为背景时看不到;2级为中度闪辉,以虹膜为背景可以看到,虹膜和晶状体细节可以辨别;3级为明显闪辉,虹膜和晶状体细节无法辨别;4级为重度闪辉伴纤维素样渗出。测定3次,取平均值。(5)黄斑中央区厚度测量及黄斑囊样水肿(cystoid macular edema,CME)发生率 分别于术前及术后6周采用RTVue XR OCT仪(美国Optovue公司)测量黄斑中央区厚度并检查有无CME,扫描仪上黄斑区视网膜分为9个区域(图1),记录中心区A1区域视网膜内界膜至色素上皮层之间距离,即黄斑中央区厚度。检查由同一位专业操作者进行,每眼连续扫描3次。
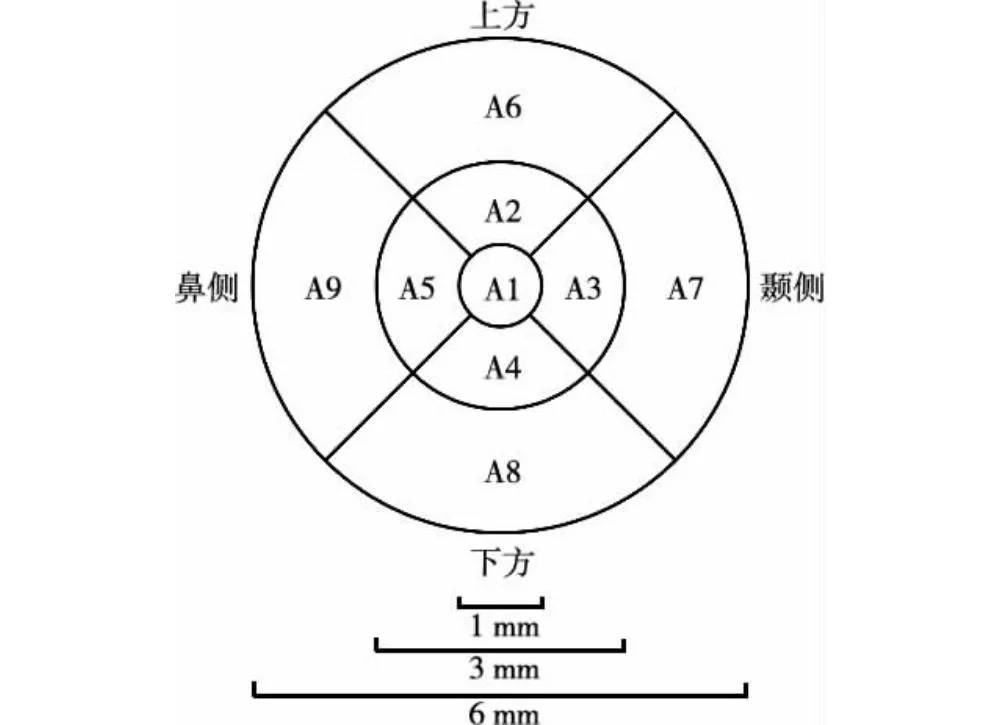
图1 OCT分区测量示意图Figure 1 Zoning measurement by OCT
1.2.4.3药物安全性评价 点药后5 min观察眼部耐受性,记录眼部症状和体征,包括烧灼感、刺痛感、眼痒、眼红。分为4个等级,其中无症状为0分、轻度为1分、明显为2分、不能耐受为3分。计算各项评分的总分值。
1.3 统计学方法

2 结果
2.1 各组不同时间点主观症状评分比较
组别与时间之间不存在交互效应(F交互作用=1.380,P=0.249)。2个组患者不同时间点主观症状评分总体比较差异均有统计学意义(F组别=5.001,P=0.028;F时间=2.920,P=0.035),其中双氯芬酸钠组术后1 d、1周、6周主观症状评分较溴芬酸钠组明显降低,各组术后1 d和6周主观症状评分均较术前增加,术后1周和6周主观症状评分均较术后1 d降低,差异均有统计学意义(均P<0.05)(表2)。

表2 2个组患者不同时间点主观症状评分比较(x±s,分)Table 2 Comparison of subjective symptoms at different time points between two groups (x±s,score)组别眼数不同时间点主观症状评分术前术后1 d术后1周术后6周双氯芬酸钠组450.47±0.730.56±0.62a0.33±0.48b0.51±0.66ab溴芬酸钠组450.47±0.510.75±0.61ac0.64±0.65bc0.78±0.77abc 注:F组别=5.001,P=0.028;F时间=2.920,P=0.035;F交互作用=1.380,P=0.249.与各自术前比较,aP<0.05;与各自术后1 d比较,bP<0.05;与双氯芬酸钠组比较,cP<0.05(重复测量两因素方差分析,LSD-t检验) Note:Fgroup=5.001,P=0.028;Ftime=2.920,P=0.035;Finteraction=1.380,P=0.249.Compared with respective preoperative,aP<0.05;compared with respective 1 day after surgery,bP<0.05;com-pared with diclofenac sodium group,cP<0.05 (Two-way repeated measures ANOVA,LSD-t test)
2.2 各组不同时间点泪液分泌量比较
组别与时间之间存在交互效应(F交互作用=3.865,P=0.023),采用简单效应分析。术前2个组患者泪液分泌量比较,差异有统计学意义(F=6.910,P=0.012),术前双氯芬酸钠组泪液分泌量较溴芬酸钠组少1.489(95%置信区间2.630~3.471)mm;术后1 d和6周双氯芬酸钠组泪液分泌量较溴芬酸钠组均降低,但差异均无统计学意义(F=1.121,P=0.729;F=0.772,P=0.384)。双氯芬酸钠组不同时间点泪液分泌量比较差异无统计学意义(F=0.547,P=0.579)。溴芬酸钠组不同时间点泪液分泌量比较差异有统计学意义(F=3.551,P=0.034),溴芬酸钠组患者术后1周和6周泪液分泌量较术前下降,差异均有统计学意义(均P<0.05)(表3)。

表3 2个组患眼不同时间点泪液分泌量比较(x±s,mm)Table 3 Comparison of SIt at different time points between two groups (x±s,mm)组别眼数不同时间泪液分泌量术前术后1周术后6周双氯芬酸钠组455.87±2.376.07±2.536.29±0.25溴芬酸钠组457.36±2.746.29±3.46a5.80±2.76a 注:F组别=1.021,P=0.315;F时间=1.352,P=0.261;F交互作用=3.865,P=0.023.与术前比较,aP<0.05(重复测量两因素方差分析,简单效应分析) Note:Fgroup=1.021,P=0.315;Ftime=1.352,P=0.261;Finteraction=3.865,P=0.023.Compared with respective preoperative,aP<0.05 (Two-way repeated measures ANOVA,Simple effect analysis)
2.3 各组不同时间点NIBUT比较
组别与时间不存在交互效应(F交互作用=0.684,P=0.483)。2个组患者NIBUT比较差异无统计学意义(F组别=3.415,P=0.068)。不同时间点NIBUT比较差异有统计学意义(F时间=4.358,P=0.020),其中,各组术后6周NIBUT较术前均缩短,差异均有统计学意义(均P<0.05);各组术后1周NIBUT较术前略缩短,但差异均无统计学意义(均P>0.05)(表4)。
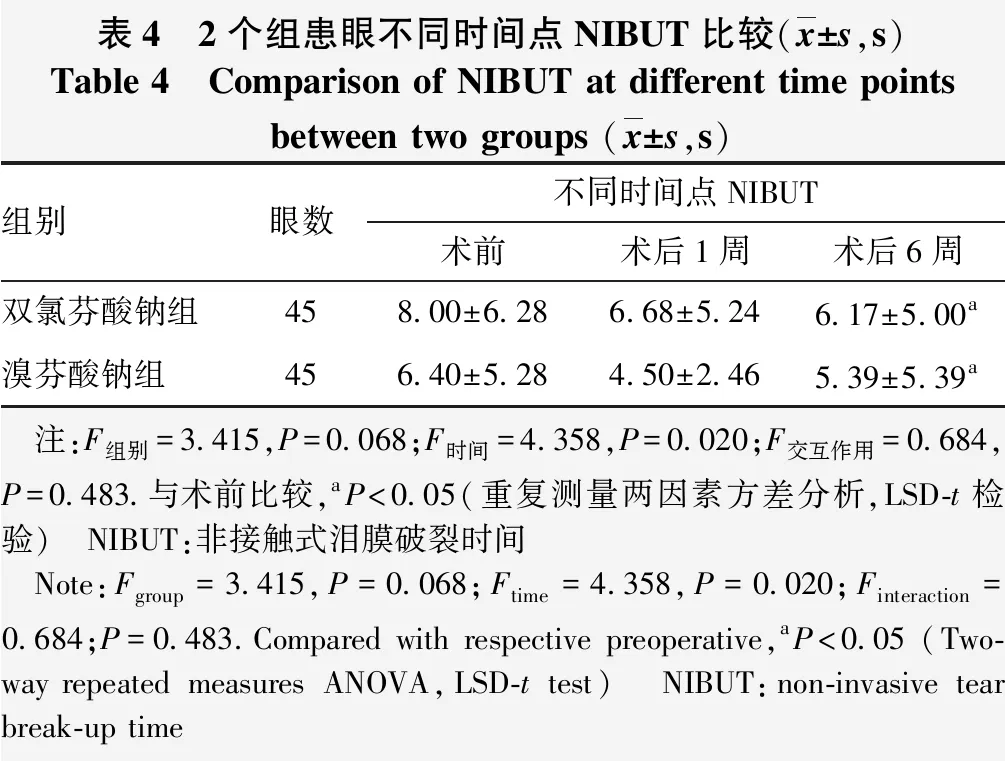
表4 2个组患眼不同时间点NIBUT比较(x±s,s)Table 4 Comparison of NIBUT at different time points between two groups (x±s,s)组别眼数不同时间点NIBUT术前术后1周术后6周双氯芬酸钠组458.00±6.286.68±5.246.17±5.00a溴芬酸钠组456.40±5.284.50±2.465.39±5.39a 注:F组别=3.415,P=0.068;F时间=4.358,P=0.020;F交互作用=0.684,P=0.483.与术前比较,aP<0.05(重复测量两因素方差分析,LSD-t检验) NIBUT:非接触式泪膜破裂时间 Note:Fgroup=3.415,P=0.068;Ftime=4.358,P=0.020;Finteraction=0.684;P=0.483.Compared with respective preoperative,aP<0.05 (Two-way repeated measures ANOVA,LSD-t test) NIBUT:non-invasive tear break-up time
2.4 各组术后不同时间点角膜荧光染色评分比较
组别与时间不存在交互效应(F交互作用=0.265,P=0.671)。2个组患者术后角膜荧光染色评分总体比较差异无统计学意义(F组别=0.110,P=0.741)。不同时间点患者角膜荧光染色评分比较差异有统计学意义(F时间=175.054,P<0.001),其中,2个组术后1 d角膜荧光染色评分均最高,术后1周和6周角膜荧光染色评分较术后1 d明显下降,差异均有统计学意义(均P<0.05)(表5)。

表5 2个组患眼不同时间点角膜荧光染色评分比较(x±s,分)Table 5 Comparison of corneal fluorescence staining score at different time points between two groups (x±s,score)组别眼数不同时间点角膜荧光素染色评分术后1 d术后1周术后6周双氯芬酸钠组451.40±0.810.13±0.34a0.00±0.00a溴芬酸钠组451.38±0.890.22±0.47a0.00±0.00a 注:F组别=0.110,P=0.741;F时间=175.054,P<0.001;F交互作用=0.265,P=0.671.与各自术后1 d比较,aP<0.05(重复测量两因素方差分析,LSD-t检验) Note:Fgroup=0.110,P=0.741;Ftime=175.054,P<0.001;Finteraction=0.265;P=0.671.Compared with respective 1 day after surgery,aP<0.05 (Two-way repeated measures ANOVA,LSD-t test)
2.5 各组不同时间点前房闪辉分级比较
组别与时间不存在交互作用(F交互作用=1.106,P=0.347)。2个组患者前房闪辉分级总体比较差异无统计学意义(F组别=0.045,P=0.507)。不同时间点前房闪辉分级比较,差异有统计学意义(F时间=322.331,P<0.001),其中2个组患者术后1 d和1周前房闪辉分级较术前均有加重,差异均有统计学意义(均P<0.05)。2个组术后前房炎症反应1周最严重,随着时间延长均逐渐减轻,术后6周前房炎症反应均恢复至术前状态(表6)。

表6 2个组患眼不同时间点前房闪辉分级比较(x±s)Table 6 Comparison of anterior chamber flash grading at different time points between two groups (x±s)组别眼数不同时间点前房闪辉分级术前术后1 d术后1周术后6周双氯芬酸钠组450.00±0.001.13±0.51a0.13+0.34a0.00±0.00溴芬酸钠组450.00±0.001.02±0.34a0.16±0.37a0.00±0.00 注:F组别=0.045,P=0.507;F时间=322.331,P<0.001;F交互作用=1.106,P=0.347.与术前比较,aP<0.05(重复测量两因素方差分析,LSD-t检验) Note:Fgroup=0.045,P=0.507;Ftime=322.331,P<0.001;Finteraction=1.106;P=0.347.Compared with preoperative,aP<0.05 (Two-way repeated measures ANOVA,LSD-t test)
2.6 各组不同时间点黄斑中央区厚度及CME发生率比较
2个组患者术前、术后6周黄斑中心凹厚度比较,差异均无统计学意义(t=-0.221、-0.374,均P>0.05)(表7)。2个组患者术后6周CME发生率均为0%。
2.7 各组不同时间点眼压比较
组别与时间不存在交互作用(F交互作用=1.437,P=0.237)。2个组患眼眼压总体比较差异无统计学意义(F组别=3.280,P=0.074);不同时间点患者眼压比较差异有统计学意义(F时间=17.820,P<0.001),各组患眼术后1 d眼压较术前增加,术后6周眼压较术前明显降低,差异均有统计学意义(均P<0.05)(表8)。

表8 2个组患眼不同时间点眼压比较(x±s,mmHg)Table 8 Comparison of intraocular pressure at different time points between two groups (x±s,mmHg)组别眼数不同时间点眼压术前术后1 d术后1周术后6周双氯芬酸钠组4515.18±2.5916.03±2.64a14.47±2.9213.84±1.86a溴芬酸钠组4515.89±3.4217.79±5.37a15.23±2.9013.98±2.92a 注:F组别=3.280,P=0.074;F时间=17.820,P<0.001;F交互作用=1.437,P=0.237.与术前比较,aP<0.05(重复测量两因素方差分析,LSD-t检验) 1 mmHg=0.133 kPa Note:Fgroup=3.280,P=0.074;Ftime=17.820,P<0.001;Finteraction=1.437;P=0.237.Compared with preoperative,aP<0.05 (Two-way repeated measures ANOVA,LSD-t test) 1 mmHg=0.133 kPa
2.8 各组药物安全性及不良反应评价
2个组均未出现患者因无法耐受药物而中止使用退出试验,受试者对2种试验药物的耐受性良好。本研究共发生8例不良事件,其中双氯芬酸钠组术后3例患者出现轻度眼压升高(>21 mmHg)(1 mmHg=0.133 kPa),发生率为6.67%,溴芬酸钠组术后5例患者出现眼压升高,发生率为11.1%,患者停药后1周眼压均恢复正常。
3 讨论
白内障术后非感染性炎症的发生机制为术中前列腺素和白三烯的释放使血-房水和血-视网膜屏障破坏,导致血管渗透性和房水蛋白质含量增高,引起前房炎症反应及CME。因此,抑制前列腺素和白三烯的产生为控制炎症反应的主要靶点[2]。
非甾体类抗炎药作为前列腺素合成酶抑制剂是通过抑制环氧化酶活性,抑制花生四烯酸生成前列腺素和/或抑制脂氧合酶产生白三烯,进而发挥抗炎作用,其抗炎作用迅速、特定,因而在白内障手术中得到广泛使用[14]。国外前瞻性临床研究表明,局部应用非甾体类抗炎药可减轻白内障术后的炎症反应[15-16]。双氯芬酸钠与溴芬酸钠的化学结构和作用机制类似,均能抑制环氧化酶介导的前列腺素类炎症介质的合成,阻断花生四烯酸向前列腺素转化。然而,双氯芬酸钠还可抑制脂氧合酶产生白三烯,理论上其抗炎效果更强,但有研究发现,溴芬酸钠滴眼液和双氯芬酸滴眼液在控制白内障术后炎症方面的效果相当[17-19]。前列腺素是眼内主要的炎症介质之一,而双氯芬酸钠具有良好的角膜渗透性,能通过抑制前列腺素合成,稳定血-房水屏障,减少炎性细胞及纤维蛋白进入前房,从而减轻炎症[4]。本研究结果显示,术后前房炎症反应在1周时最重,溴芬酸钠滴眼液和双氯芬酸钠滴眼液在抗前房炎症反应方面效果相当,与文献报道相符。白内障术后第1周是炎症反应出现和抗炎治疗的关键阶段,联合使用抗炎药物能更有效地消除术后前房炎症反应。
黄斑水肿是白内障术后常见的并发症,是造成术后视力减退的主要原因。尽管其发病机制尚不明确,但大多数研究者认为白内障术后炎症是CME发生的主要原因[20]。CME一般在术后1周发生,4~6周达顶峰[21]。非甾体类抗炎药物在控制黄斑厚度方面的作用已在先前研究中得到证实[21-22]。
尽管理论上围手术期应用非甾体类抗炎药物可进一步预防炎症反应,减少CME的发生。但目前的研究仍无法得出明确结论。有研究表明非甾体类抗炎药物对白内障术后慢性CME有效[22];然而,也有研究表明,虽然非甾体类抗炎药物可以加速术后几周的视力恢复,但其长期影响尚不明确[20]。本研究结果显示,溴芬酸钠组和双氯芬酸钠组患者术前和术后6周黄斑中心凹厚度比较,差异均无统计学意义,表明双氯芬酸钠与溴芬酸钠在控制超声乳化白内障吸除联合IOL植入术后眼内炎症的作用相当,且均未增加黄斑中央区厚度及出现CME。
白内障术后并发干眼的原因包括术源性损伤和药物源性损伤[17,23-24]。白内障手术对眼表造成的损伤主要来自于手术切口损伤神经、术中眼表暴露及机械性损伤、围手术期用药的眼表毒性反应和手术引起的炎症反应等[25-26]。白内障术后炎症反应的加重导致中性粒细胞和巨噬细胞聚集及自由基、蛋白水解酶和环氧合酶的产生,也被认为是干眼发展的关键因素。局部麻醉剂和手术前含防腐剂滴眼液的使用也会导致炎症反应[27-28]。大多数滴眼液均含有防腐剂,防腐剂可以破坏泪膜稳定性、上皮细胞间的紧密连接及抑制细胞有丝分裂,导致角膜伤口愈合延迟[28]。而双氯芬酸钠滴眼液目前采用的是独立包装,不含防腐剂,并且含有玻璃酸钠,对眼表有良好的润滑、保湿和促进角膜上皮愈合的作用。二者制成复方制剂,可以减轻非甾体类消炎镇痛药常见的刺激性,增加患者舒适度。有研究发现,白内障术后应用不含防腐剂而含有玻璃酸钠的0.1%双氯芬酸钠滴眼液者主观症状评分优于0.1%溴芬酸钠滴眼液[17]。本研究结果显示,双氯芬酸钠组患者术后主观症状评分较溴芬酸钠组明显降低,表明双氯芬酸钠组患者用药后舒适度较高,与既往研究结果一致。但本研究结果显示,2个组患眼术后干眼相关检查指标比较差异无统计学意义,这可能与随访时间短、每日2次的溴芬酸钠使用频次较低有关。
综上所述,新型0.1%双氯芬酸钠滴眼液4次/日和0.1%溴芬酸钠滴眼液2次/日持续局部给药6周,对眼压影响较小;在治疗超声乳化白内障吸除联合IOL植入术后炎症反应方面效果相当,患者具有良好的依从性和耐受性,且新型0.1%双氯芬酸钠滴眼液舒适度较高。然而,本研究样本量小,随访时间短,可能存在一定的偏倚,而且研究中患者用药量和频率是否遵循医嘱也是后续值得关注的问题。由于本研究随访患者数量有限,2个组患者术前干眼程度不一致,对于各组间白内障术后干眼指标的比较需扩大样本量进一步研究。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明葛佳佳:采集及整理数据、统计分析、文章撰写;刘晴:采集数据、统计分析;周金燕、单晓娜:采集数据;黄钰森:酝酿和设计试验、实施研究、文章审阅及定稿

