飞秒激光小切口角膜基质透镜取出术治疗近视性屈光参差
李 青,岳 钟,郭敬云
0引言
屈光参差是指同一个体双眼屈光度不同的屈光状态,通常定义为双眼球镜屈光度数相差≥1.50 DS,或柱镜屈光度数相差≥1.00 DC[1]。近视性屈光参差由于眼球的眼轴过长或角膜弯曲度增大导致光线在视网膜前聚焦,从而造成远处视物不清,而近处视物清晰[2-3]。对于成年且屈光度稳定的近视性屈光参差患者可以考虑进行屈光手术,以帮助恢复或部分恢复双眼视功能[4-5]。近年来,随着飞秒激光技术在眼科屈光手术领域的广泛应用,角膜屈光手术逐渐向微创或无创方向发展,最具代表性的手术方式包括飞秒激光小切口角膜基质透镜取出术(small incision lenticule extraction,SMILE)和飞秒激光辅助准分子激光原位角膜磨镶术(femtosecond assisted laserinsitukeratomileusis,FS-LASIK)[6-8]。其中,无需制作开放式角膜瓣的SMILE可极大程度上规避角膜瓣相关并发症的发生,加之可对角膜帽进行针对性的设计制作,保留角膜皮下基底神经丛,减小手术对角膜周围神经的影响,具有手术切口小、神经损伤小、恢复快、患者舒适度高等优点[9-10]。然而目前关于上述两种手术方式对近视性屈光参差治疗效果的研究数据相对较少,为进一步探究SMILE治疗近视性屈光参差的临床效果及优势,本研究选取本院收治的行SMILE和FS-LASIK治疗的近视性屈光参差患者76例作为研究对象,进行如下研究,以期为近视性屈光参差的治疗提供数据支持。
1对象和方法
1.1对象回顾性分析2021-01/2022-12于本院行SMILE或FS-LASIK治疗的近视性屈光参差患者76例146眼的临床资料,根据选择手术方式分为SMILE组和FS-LASIK组。SMILE组患者39例77眼,其中男21例,女18例;年龄18-36(平均23.10±4.89)岁;术前屈光度(等效球镜度)平均为-4.79±2.20 D,双眼屈光参差度(双眼等效球镜差值)平均为2.54±0.62 D。FS-LASIK组患者37例69眼,其中男19例,女18例;年龄18-35(平均22.08±4.17)岁;术前屈光度(等效球镜度)平均为-4.77±2.04 D,双眼屈光参差度(双眼等效球镜差值)平均为2.56±0.64 D。两组患者性别、年龄、术前屈光度及双眼屈光参差度比较,差异均无统计学意义(P>0.05),具有可比性。本研究已通过保定市第一中心医院伦理委员会审批。
1.1.1纳入标准(1)自愿接受近视激光手术并签署手术知情同意书者;(2)年龄≥18岁;(3)术前最佳矫正视力(best corrected visual acuity,BCVA)均优于0.8(小数视力);(4)术前双眼屈光参差度(双眼等效球镜差值)≥2.00 D;(5)1 a内屈光度变化不超过±0.50 D;(6)术前角膜厚度≥500 μm,预期术后角膜基质床厚度≥280 μm;(7)软性角膜接触镜停戴时间≥15 d,硬性角膜接触镜停戴时间≥30 d,角膜塑形镜停戴时间≥3 mo。
1.1.2排除标准(1)妊娠期、哺乳期妇女;(2)合并角膜炎、圆锥角膜、青光眼等眼部器质性病变患者;(3)合并风湿病、糖尿病、瘢痕体质等全身疾病患者;(4)对治疗药物存在过敏史者。
1.2方法
1.2.1术前准备两组患者术前均已完成裸眼视力(uncorrected visual acuity,UCVA)、BCVA、眼压、眼轴、角膜厚度、Sirius三维角膜地形图检查、散瞳验光和眼底检查等检查。术前3 d,所有患者均常规使用加替沙星滴眼液(规格0.3%,国药准字H20110119),每天4次,连续使用3 d。
1.2.2手术过程SMILE组患者手术均由同一位操作熟练的医师使用同一台飞秒激光设备(VisuMax飞秒激光仪)完成。患者平卧位,调整合适位置使用弧形压平镜对术眼进行负压吸引,使用飞秒激光仪依次对透镜后表面、前表面、侧切及角膜帽2 mm边切口进行扫描,于显微镜下进行钝性分离最后取出完整基质透镜,术毕。参数设置:采用90°弧形切口,边切口长度2 mm,激光脉冲频率500 kHz,脉冲能量175 nJ,微透镜直径6.5 mm,角膜帽直径7.5 mm,厚度120 μm。
FS-LASIK组患者手术均由同一位操作熟练的主任医师使用同一台飞秒激光设备(VisuMax飞秒激光仪)和同一台准分子激光设备(MEL-80准分子激光系统)完成。先用VisuMax飞秒激光仪进行角膜瓣的制作,随后将患者头部调整至MEL-80准分子激光仪下,掀开角膜瓣,利用准分子激光对角膜基质床进行屈光性消融,最后进行角膜瓣复位,术毕。参数设置:准分子激光切削光学区直径6.5 mm,激光脉冲频率500 kHz,脉冲能量175 nJ,角膜瓣直径8.0 mm,厚度110 μm。
1.2.3术后用药两组患者术后均使用氟米龙滴眼液(规格0.1%,国药准字H20010693),术后第1 wk每天4次,之后每周用药频率较上周每天减少1次,直至第4 wk后停药;术后1 wk常规使用加替沙星滴眼液(规格0.3%,国药准字J20180068),每天4次;术后1 mo常规使用玻璃酸钠滴眼液(规格0.3%,国药准字H20183444),每天4次。
1.2.4随访观察术后至少随访3 mo,观察术后1 wk,1、3 mo视力、屈光度、屈光参差度、角膜像差和术后干眼、角膜炎、眼压升高、层间异物、上皮细胞植入等并发症发生情况。使用国际标准对数视力表评估UCVA,并将结果转换为LogMAR视力[10]进行统计分析。使用NIDEK AR-310A全自动电脑验光仪测量患眼屈光度,重复测量3次取平均值,并计算等效球镜度(等效球镜度=球镜度数+1/2柱镜度数)和屈光参差度(双眼等效球镜差值)。使用Sirius三维角膜地形图仪检测瞳孔直径5 mm角膜像差,重复测量3次,选取采集质量最佳图像,记录高阶像差(角膜总高阶像差、彗差、三叶草和球差),像差大小用均方根(RMS)表示。
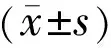
2结果
2.1两组患者手术前后视力比较手术前后各时间点两组患者UCVA比较,具有时间差异性(F时间=2663.494,P时间<0.001),但无组间差异性和交互效应(F组间=0.773,P组间=0.381;F交互=0.754,P交互=0.417),见表1。术后1 wk,1、3 mo,两组患者UCVA均较术前改善,差异均有统计学意义(P<0.05)。
2.2两组患者手术前后屈光度与屈光参差度比较手术前后各时间点两组患者屈光度、屈光参差度比较,均具有时间差异性(F时间=672.952、918.678,均P时间<0.001),但无组间差异性和交互效应(F组间=0.019、0.073,P组间=0.891、0.787;F交互=0.070、0.111,P交互=0.903、0.814),见表2、3。术后1 wk,1、3 mo,两组患者屈光度和屈光参差度均较术前降低,差异均有统计学意义(P<0.05)。
2.3两组患者手术前后角膜像差比较手术前后各时间点两组患者彗差、三叶草、球差、总高阶像差比较,均具有时间差异性、组间差异性和交互效应(F时间=47.102、48.143、59.622、144.944,F组间=44.793、22.012、127.837、40.127,F交互=7.723、3.493、14.303、4.853,均P<0.001),见表4。术后1 wk,1、3 mo,两组患者彗差、三叶草、球差、总高阶像差均较术前显著增加,且FS-LASIK组彗差、三叶草、球差、总高阶像差均显著高于SMILE组,差异均有统计学意义(P<0.05)。
2.4两组患者术后并发症发生情况比较术后随访3 mo,SMILE组患者术后并发症总发生率为5.2%(4/77),低于FS-LASIK组(15.9%,11/69),差异有统计学意义(χ2=4.560,P=0.033),见表5。
表1 两组患者手术前后UCVA比较

表1 两组患者手术前后UCVA比较
组别眼数术前术后1 wk术后1 mo术后3 moSMILE组771.08±0.220.02±0.05a-0.01±0.06a,c-0.02±0.03a,cFS-LASIK组691.04±0.240.02±0.07a-0.01±0.04a,c-0.02±0.07a,c
注:aP<0.05 vs 同组术前;cP<0.05 vs 同组术后1 wk。
表2 两组患者手术前后屈光度比较

表2 两组患者手术前后屈光度比较
组别眼数术前术后1 wk术后1 mo术后3 moSMILE组77-4.79±2.20-0.05±0.24a-0.02±0.27a-0.04±0.32aFS-LASIK组69-4.77±2.04-0.09±0.32a-0.04±0.36a-0.05±0.35a
注:aP<0.05 vs 同组术前。
表3 两组患者手术前后屈光参差度比较

表3 两组患者手术前后屈光参差度比较
组别例数术前术后1 wk术后1 mo术后3 moSMILE组392.54±0.620.22±0.18a0.18±0.12a0.20±0.11aFS-LASIK组372.56±0.640.19±0.22a0.21±0.15a0.22±0.15a
注:aP<0.05 vs 同组术前。
表4 两组患者手术前后角膜像差比较
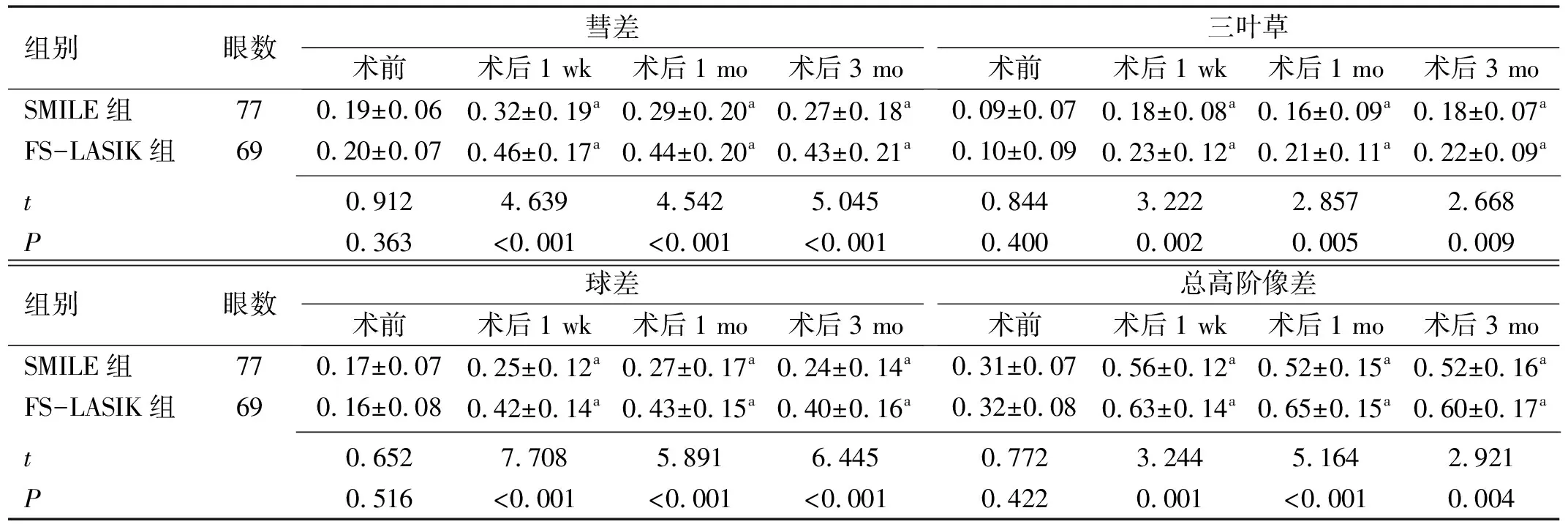
表4 两组患者手术前后角膜像差比较
组别眼数彗差术前术后1 wk术后1 mo术后3 mo三叶草术前术后1 wk术后1 mo术后3 moSMILE组770.19±0.060.32±0.19a0.29±0.20a0.27±0.18a0.09±0.070.18±0.08a0.16±0.09a0.18±0.07aFS-LASIK组690.20±0.070.46±0.17a0.44±0.20a0.43±0.21a0.10±0.090.23±0.12a0.21±0.11a0.22±0.09a t0.9124.6394.5425.0450.8443.2222.8572.668P0.363<0.001<0.001<0.0010.4000.0020.0050.009组别眼数球差术前术后1 wk术后1 mo术后3 mo总高阶像差术前术后1 wk术后1 mo术后3 moSMILE组770.17±0.070.25±0.12a0.27±0.17a0.24±0.14a0.31±0.070.56±0.12a0.52±0.15a0.52±0.16aFS-LASIK组690.16±0.080.42±0.14a0.43±0.15a0.40±0.16a0.32±0.080.63±0.14a0.65±0.15a0.60±0.17a t0.6527.7085.8916.4450.7723.2445.1642.921P0.516<0.001<0.001<0.0010.4220.001<0.0010.004
注:aP<0.05 vs 同组术前。

表5 两组患者术后并发症发生情况 眼(%)
3讨论
近年来,近视患病率逐年上升,其中近视性屈光参差为其中一种特殊类型,症状严重者双眼视功能遭到破坏,还可能引发斜视、视疲劳等并发症,严重影响患者的生活质量,目前已证实该病形成或与遗传因素、环境因素、疾病因素等有关[11-12]。近视性屈光参差可采取屈光手术进行矫正,准分子激光手术精准度高、适用范围广、术后反应轻且效果稳定,手术效果良好,在多项研究[13-16]中均有体现。本研究比较了SMILE与FS-LASIK的应用效果,结果显示,两组患者UCVA、屈光度及屈光参差度均明显改善,但两组间无显著性差异,说明SMILE与FS-LASIK均能有效降低近视性屈光参差患者近视严重程度,并缓解屈光参差,进而极大提升视力水平。马代金等[17]研究显示SMILE与FS-LASIK均能有效治疗近视及散光。郎敏等[18]研究显示SMILE与FS-LASIK两种手术方式矫正高度近视具有相似的有效性、安全性和稳定性。
SMILE与FS-LASIK均会造成角膜形态发生变化,引入角膜高阶像差,从而影响近视性屈光参差患者的视觉清晰度和视觉质量,导致患者出现眩光、干眼等症状[19-21]。汪涛等[22]研究发现,角膜像差可作为评估屈光手术后视觉质量的客观指标,治疗过程中不仅要关注视力恢复情况,还需定期检查角膜像差,以便及时进行治疗和矫正,提高患者的视觉质量和舒适度。本研究中,两组患者术后彗差、三叶草、球差、总高阶像差均较术前显著增加,且FS-LASIK组患者彗差、三叶草、球差、总高阶像差显著高于SMILE组。而郑洪玲等[23]研究表明,FS-LASIK和SMILE术后垂直彗差、球差及总高阶像差均较术前增加,但应用眼球自旋控制功能的FS-LASIK术后垂直彗差的绝对值低于SMILE术后,而球差高于SMILE术后。张亚丽等[24]研究表明,FS-LASIK和SMILE均改变了角膜前表面非球面性,术后角膜前表面Q值均向正值方向变化,且SMILE对角膜前表面Q值和角膜像差的改变均小于FS-LASIK。分析原因可能是由于FS-LASIK术中准分子激光切削角膜基质边缘能量丢失产生的余弦效应导致球差增加,本研究中所采用的准分子激光系统具有Q值调整波前像差优化功能,补偿了部分周边的余弦效应,但仍显示了较明显的球差增加[25-27]。
虽然SMILE与FS-LASIK在近视矫正方面相对安全且有效,但仍然存在潜在并发症风险,包括干眼、角膜炎、眼压升高等[28]。为降低并发症风险,医生须通过全面咨询和评估以确定患者是否适合手术,并在术后严密监督,嘱患者遵循指导以获得预期康复收益。本研究发现,SMILE组患者并发症发生率显著低于FS-LASIK组,说明SMILE能有效降低近视性屈光参差患者术后并发症发生率。分析原因如下:(1)两种手术难免会造成一定程度的角膜神经损伤,影响泪液分泌和眼表湿润功能,术后角膜表面平滑度下降促进泪液蒸发率增加,导致干眼的发生[29];(2)SMILE切口较小,角膜形态更加稳定,减少角膜神经损伤、水肿与炎症,可降低干眼、角膜炎和眼压升高的风险。
综上所述,SMILE与FS-LASIK均可有效矫正近视性屈光参差,两种手术方法治疗效果相似,均可有效提高患者UCVA,改善视觉质量,但SMILE术后角膜高阶像差更低、并发症发生率更小,整体效果更好。然而,本研究仅是对SMILE与FS-LASIK矫正近视性屈光参差的小样本、短期观察研究,且考虑本研究中使用的MEL-80设备使用年限较长,手术技术、医生的经验等其他因素,未来需要更大样本量以及较为先进的准分子激光设备手术进行全面、长期的随访研究,验证SMILE和FS-LASIK的临床效果。

