m6A甲基化修饰在眼科疾病中的研究进展
薛愚愚,刘春梦 ,陈 婕,叶河江
0引言
N6-甲基腺苷 (m6A)甲基化修饰是真核生物RNA最普遍的一种表观遗传学修饰,以动态、可逆的方式参与调控多种生物学过程。m6A可调节多种细胞功能,参与代谢性、炎症性、退行性眼病和眼部肿瘤的发生发展,如糖尿病视网膜病变、白内障、年龄相关性黄斑变性、葡萄膜黑色素瘤等。本文对m6A甲基化修饰在眼部组织细胞和眼科疾病中的作用、分子机制和治疗前景进行综述。
1 m6A甲基化修饰概述
随着检测技术的快速发展,RNA表观遗传学已成为前沿研究领域[1]。核碱基的化学修饰对于诱导蛋白质翻译和调节某些信号通路至关重要[2]。在这些修饰中,近年来备受关注的是RNA的m6A甲基化修饰。
m6A甲基化修饰,即腺嘌呤碱基A的第6位N原子发生甲基化,是最普遍、最丰富和最保守的RNA内部修饰方式[3-5]。m6A修饰各种RNA,包括信使RNA (mRNA)、微小RNA (miRNA)和长链非编码RNA (lncRNA)[2, 6]。m6A修饰具有可逆性,在调节基因表达时,这种修饰更具灵活性[3, 7]。
RNA的m6A甲基化修饰主要有三类酶参与,即m6A甲基转移酶、m6A去甲基化酶和m6A甲基化识别蛋白。m6A甲基转移酶(又称“writers”),负责促进RNA甲基化,包括METTL3/14/16、RBM15/15B、WTAP和KIAA1429等。其中研究较多的是METTL3,它是第一个被发现的甲基转移酶,在m6A甲基化修饰过程中起主要的催化作用,能使特定的靶转录物甲基化。m6A去甲基化酶(又称“erasers”),负责将细胞中的RNA去甲基化,包括FTO和ALKBH5。m6A甲基化识别蛋白(又称“readers”),主要识别存在于RNA中的m6A修饰并调节下游分子机制,包括YTHDF1/2/3、YTHDC1/2、IGF2BP1/2/3和HNRNPA2B1等[7-8]。这些酶使m6A修饰过程动态和可逆,敲除或过表达这些酶可以特异性干扰m6A的形成[9]。RNA的编码器和消码器决定了RNA的m6A修饰水平,而读码器决定了m6A修饰的RNA翻译效率或影响RNA的稳定性[10]。
m6A修饰在肿瘤和非肿瘤疾病的发病机制中都具有调节作用[5, 11]。异常的m6A甲基化可以影响某些生物学过程并导致多种疾病,如癌症、糖尿病等[12]。近年来的研究发现,m6A甲基化异常可能介导眼部的多种病理过程,参与代谢性、炎症性、退行性眼病和眼部肿瘤的发生发展。
2 m6A甲基化修饰与眼部组织细胞的关系
m6A甲基化修饰的表达可见于许多眼组织,包括角膜、葡萄膜、晶状体、视网膜和眼外肌等[10]。了解眼组织细胞中m6A甲基化修饰的作用可为了解眼部功能和眼部疾病的分子机制提供新的见解。
2.1视网膜神经节细胞Weng等[13]的研究发现m6A甲基转移酶METTL14被敲除后,小鼠视网膜神经节的轴突再生会减弱。METTL14在哺乳动物神经系统轴突再生中起作用,但具体的作用途径还不清楚。另一项研究[14]揭示了功能冗余的YTHDFs介导皮质和视网膜神经发生中的m6A调节过程。视网膜中METTL14敲除会导致视网膜神经元数量减少,层状结构紊乱。这种表型只有在视网膜中的YTHDF1、YTHDF2和YTHDF3同时被敲除时才会出现。未来的研究需要明确YTHDFs通过何种机制调节神经细胞,以阐明YTHDFs靶点在神经发生中的具体功能。
2.2视网膜小胶质细胞小胶质细胞是视网膜中的组织驻留巨噬细胞,其诱导的视网膜炎症的不平衡极化是糖尿病视网膜病变(diabetes retinopathy,DR)和葡萄膜炎的发病机制之一。Chen等[15]研究鉴定出一个负调控小胶质细胞M1极化的关键分子A20。在葡萄糖刺激下,ALKBH5的低表达使m6A修饰水平升高,A20 mRNA的降解速度加快,最终导致A20在DR视网膜小胶质细胞中的表达降低,小胶质细胞M1极化增强,炎症反应更明显。研究有助于阐释DR的发病机制。另一项研究[16]分析了葡萄膜炎小鼠视网膜细胞的单细胞RNA测序数据,YTHDC1沉默下调SIRT1的表达,促进STAT3磷酸化,进而诱导M1小胶质细胞激活并加剧炎症反应。研究探索了YTHDC1在细胞免疫调节中的作用,但在体内是否有同样的作用还有待进一步研究。
2.3视网膜色素上皮细胞Yin等[17]检测到METTL14沉默可降低人类视网膜色素上皮细胞(adult retinal pigment epithelial cell line-19,ARPE-19)的增殖,增加细胞凋亡。METTL14调节微管相关蛋白(microtubule-associated protein,MAP2)的表达,MAP2可与NEUROD1结合,导致RPE细胞的病理变化。研究提示针对METTL14/YTHDF2/MAP2/NEUROD1信号轴的治疗策略可能是一种新的有效选择。Meng等[18]探讨了METTL3在脂多糖(LPS)诱导的RPE炎症中的作用和潜在机制。METTL3沉默后,RPE细胞表现出增殖抑制和炎症因子分泌增加。METTL3经NR2F1/IL-6途径调节RPE炎症。研究为治疗RPE相关的眼部疾病提供了新的思路。
2.4视网膜的光感受器Yang等[19]研究了METTL14在视网膜视杆细胞和视锥细胞中的功能。视杆细胞中METTL14的缺失会导致暗视觉功能下降和视杆细胞变性,而视锥细胞中METTL14的缺失会导致视蛋白的错误定位和视锥细胞进行性死亡。研究首次证明了m6A对于维持哺乳动物视网膜光感受器的存活和功能的重要性,可能为RP的治疗干预提供新的见解。
2.5血管内皮细胞最近的一项研究表明METTL3介导的m6A甲基化修饰在脉络膜新生血管发病中可经Notch通路调控血管内皮细胞的生物学活性,促进血管形成[20]。研究为CNV发病的分子机制提供了新的见解,但还需体内实验作进一步验证。Zhao等[21]发现内皮细胞CYP2J2过表达维持了缺血再灌注损伤后BRB的完整性。研究提示CYP2J2-METTL3-ANXA1通路是缓解BRB损伤的潜在治疗靶点。
表1总结了m6A甲基化在视网膜细胞调节中的重要性,m6A调节因子可能成为新的治疗靶点。然而,单纯的细胞研究主要集中在视网膜细胞和血管内皮细胞,目前关于眼部其他细胞的相关研究报道尚少。未来还需要更多的研究继续阐明m6A在眼部组织细胞中的作用机制。
3 m6A甲基化修饰与眼科疾病的关系
3.1糖尿病视网膜病变研究人员在DR发病机制的几种关键因素中观察到m6A水平的变化,如炎症、氧化应激和血管生成[22]。m6A RNA修饰可能成为控制DR进展的新的候选者。
通过鉴定并验证DR中与RNA甲基化修饰相关的差异表达基因,研究者建议对METTL3、Nsun4等基因进行探索[23]。有多项研究证明了METTL3从不同路径影响DR的进展。高血糖会损害内皮细胞的功能,并促进内皮-间质转化(endothelial-mesenchymal transition,EndoMT)。Cao等[24]发现DR患者、DR小鼠和高糖诱导的人类视网膜微血管内皮细胞中METTL3的表达水平显著下调,并证明了METTL3可通过lncRNA SNHG7/KHSRP/MKL1轴调控DR中的EndoMT,这可能成为DR治疗的新靶点。也有研究基于体内和体外实验证明了METTL3在周细胞功能障碍中的作用,发现METTL3过表达通过抑制PKC-η、FAT4和PDGFRA的表达损害周细胞功能[25],研究为DR的治疗提供了新的视角。Zha等[26]临床研究表明,与正常志愿者相比,糖尿病患者的外周静脉血样本中METTL3 mRNA和miR-25-3p均呈低表达,研究证明了METTL3过表达可减轻高糖诱导的RPE细胞凋亡和焦亡,并通过靶向作用于miR-25-3p/PTEN/AKT信号通路促进细胞增殖。本研究可为临床探索DR治疗的潜在药物提供启示。
YTHDF2是另一个重要的影响DR病理的m6A相关酶。Huang等[27]的研究表明circFAT1通过介导YTHDF2

表1 m6A相关酶在眼部组织细胞中的作用
在DR中的表达,促进HG诱导的RPE细胞自噬,抑制RPE细胞焦亡。本研究为DR的防治提供了新的思路。另一项研究[28]探讨了赖氨酸乙酰转移酶1(lysine acetyltransferase 1,KAT1)触发YTHDF2介导的整合素β1(integrin β1,ITGB1)mRNA不稳定性以减轻DR的进展。这些分子的异常表达可为DR提供诊断或预后价值。
以上研究表明,除了mRNA之外的各种非编码RNA,如miRNA、lncRNA和circRNA也与DR相关。m6A甲基化修饰调节了DR发病机制的不同关键因素,可能在DR的发病和进展中发挥关键作用。此领域的广泛研究可能为DR的研究带来新的前沿。
3.2眼部肿瘤近年来,越来越多的资料表明m6A甲基化修饰参与了各种肿瘤的发病过程。在眼部的相关研究主要涉及眼部黑色素瘤和视网膜母细胞瘤。
3.2.1眼部黑色素瘤眼部黑色素瘤包括葡萄膜黑色素瘤(uveal melanoma,UM)和结膜黑色素瘤(conjunctival melanoma,CM),是成人中最常见和致命的眼部癌症。UM和CM都起源于黑色素细胞,并表现出侵袭性的生长模式。
有多项研究揭示了m6A甲基化修饰在眼部黑色素瘤中的作用机制。Jia等[29]研究发现RNA甲基化显著抑制UM和CM的进展。m6A RNA修饰在转录后促进了HINT2的表达。而HINT2 mRNA是眼部黑色素瘤中的一种肿瘤抑制因子,YTHDF1促进了甲基化HINT2 mRNA的翻译。研究揭示了眼部黑色素瘤中m6A甲基化的关键功能。整合膜糖蛋白β-分泌酶2(integral membrane glycoprotein beta-secretase 2, BACE2)在脊椎动物色素沉着和转移性黑色素瘤中起重要作用。He等[30]的研究发现,沉默METTL3后,甲基化的BACE2 RNA显著减少。而抑制BACE2在体外和体内均显著阻碍肿瘤进展。研究提示m6A/BACE2/TMEM38b可能是眼部黑色素瘤的潜在治疗轴。组蛋白乳酸化在M1巨噬细胞极化过程的表达调控中起重要作用。Yu等[31]的研究发现组蛋白乳酸化通过促进YTHDF2的表达促进肿瘤发生。YTHDF2识别m6A修饰的PER1和TP53 mRNA并促进它们的降解,从而加速眼黑色素瘤的肿瘤发生。PER1和TP53可能是与YTHDF2相关的关键候选基因,而YTHDF2可能是眼部黑色素瘤的一种新的致癌基因。组蛋白去乙酰化抑制剂(histone deacetylation inhibitors,HDACis)在多种恶性肿瘤中显示出令人鼓舞的结果。有研究发现,在眼部黑色素瘤中,靶向组蛋白去乙酰化酶通过诱导METTL14修饰的m6A RNA甲基化来抑制肿瘤生长。HDACis通过HDAC/METTL14/FAT4轴在眼部黑色素瘤中发挥抗癌作用[32]。这些研究为肿瘤发生中表观遗传的调控提供了新见解。
UM是成人最常见的眼内恶性肿瘤,探索UM的分子机制并确定其生物标志物对于疾病的早期发现、诊治和预后至关重要。Tang等[33]首次从TCGA数据集全面评估了UM中m6A调控基因的表达、潜在功能和预后价值,并区分了三个m6A调节因子(ALKBH5、YTHDF1和KIAA1429)的预后风险特征。研究表明m6A RNA甲基化调节因子在UM的恶性进展和早期诊断中起重要作用。另一项研究[34]证明了UM细胞和临床标本中的METTL3和RNA m6A甲基化水平均显著升高。METTL3介导的m6A RNA甲基化通过靶向c-Met调节UM细胞增殖、迁移和侵袭。研究首次阐明了m6A RNA修饰在UM中的功能作用和分子机制。Liu等[35]的研究探讨了lncRNA共有的免疫基因在不同风险群体中的表达。YTHDF3在高危组中表达上调,可能是高危因素;RBM15B和IGF2BP2在低危组中表达上调,可能是保护因素。研究表明m6A调控因子和相关lncRNA在肿瘤微环境重塑中发挥了重要作用,但具体机制还需要进一步的探索。最近的一项研究[36]表明ALKBH5可通过FOXM1 mRNA的去甲基化诱导上皮间质转化(epithelial-to-mesenchymal transition,EMT)促进UM转移和进展。AKLBH5是UM中潜在的预后生物标志物和治疗靶点。Wang等[37]研究发现五种m6A调节因子与UM患者的预后相关。其中,RBM15B被证实是UM的唯一独立预后因素,且与UM的临床病理特征显著相关。本研究的结果是由生信分析产生的,还需要更多的临床数据和实验来证实RBM15B在UM中的预后价值。
3.2.2视网膜母细胞瘤视网膜母细胞瘤(retinoblastoma,RB)是儿童常见的眼内恶性肿瘤。Zhang等[38]建立了小鼠的裸鼠皮下肿瘤模型,首次揭示了m6A的甲基化转移酶METTL3是促进RB进展的关键因素。METTL3在体外和体内通过PI3K/AKT/mTOR通路促进RB的进展。研究提示METTL3是RB的致癌基因,同时可能是RB治疗的潜在治疗靶点。
3.3葡萄膜炎有三项研究通过小鼠实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis,EAU)模型模拟体内葡萄膜炎,并探索了m6A甲基化与EAU的关系。Tang等[39]的研究表明FTO敲低使ATF4的m6A水平升高,激活p-STAT3,加重炎症反应。研究首次发现FTO在葡萄膜炎中的作用。近期的一项研究[40]证明了FTO介导的m6A修饰通过GPC4/TLR4/NF-κB信号轴调节小胶质细胞的炎症,从而减轻EAU。研究为葡萄膜炎的潜在治疗策略提供了新见解。Zhao等[41]的研究从体内和体外证明了METTL3的过表达以YTHDC2依赖的方式改善了EAU的发展,抑制了致病性Th17细胞的反应。研究为自身免疫性葡萄膜炎的治疗提供了有希望的治疗靶点。
3.4白内障Li等[42]探讨了年龄相关性白内障(age-related cataract,ARC)m6A修饰对晶状体上皮细胞(lens epithelium cells,LECs)病变中环状RNA(circRNA)及相关甲基转移酶的影响。m6A甲基转移酶ALKBH5在皮质性ARC的LECs中显著上调。研究从新的角度阐释了ARC的发病机制。另一项研究[43]发现METTL3在糖尿病性白内障组织标本和高糖诱导的人晶状体上皮细胞(human lens epithelial cells,HLECs)中上调。METTL3特异性靶向ICAM-1 30 UTR以增加mRNA的稳定性,并促进其蛋白质表达。研究为糖尿病性白内障的m6A修饰提供了新见解。
3.5青光眼Niu等[44]的研究建立了实验性急性青光眼的小鼠模型,证明了视网膜中YTHDF2的条件性敲除可保护视网膜神经节细胞,避免发生树突变性。未来YTHDF2可能用于治疗青光眼和其他视网膜损伤引起的神经变性。最近的一项研究[45]首次评估了假性剥脱性青光眼(pseudoexfoliation glaucoma,PXG)和ARC患者房水中m6A甲基化组和基因表达谱,发现PXG组房水中m6A水平明显高于ARC组。METTL3、YTHDC2在PXG标本中显著上调。研究为PXG中m6A修饰的进一步深入研究奠定了基础。
3.6Graves眼病Zhu等[46]对7例Graves眼病(Graves’ ophthalmopathy,GO)患者和5例未患GO的受试者在手术中切除的眼外肌进行了研究。发现与对照标本相比,GO患者标本中m6A水平显著升高,ALKBH5、YTHDF2、WTAP等的表达显著上调。研究表明靶向调节m6A甲基化的基因可能为GO提供新的治疗方法。
3.7翼状胬肉Jiang等[47]的临床研究从24例翼状胬肉患者中分别获得24份翼状胬肉组织和24份正常结膜组织,研究发现翼状胬肉组织中m6A水平和METTL3表达均降低,m6A修饰可能通过Hippo通路促进疾病的发生发展。研究提示m6A修饰水平下降可能是翼状胬肉发生的重要原因,但其确切机制有待进一步探索。
3.8角膜病Hu等[48]通过给小鼠接种镰刀菌建立了真菌性角膜炎模型,无菌PBS处理的小鼠为对照组。与对照组相比,镰刀菌处理组的角膜组织中总体m6A水平上调,METTL3的水平显著升高。m6A修饰可能通过改变PI3K-AKT信号通路的激活状态在真菌性角膜炎中发挥作用。研究首次表明m6A修饰可能为真菌性角膜炎提供潜在的治疗靶点。另一项相似的研究[49]通过小鼠和原代角膜基质细胞建立体内和体外真菌性角膜炎模型,也证明了METTL3的下调可通过PI3K/AKT信号通路减弱角膜炎症。
3.9近视转移RNA衍生片段(transfer RNA-derived fragments,tRFs)是一类新型的小非编码RNA。最近的一项研究[50]揭示了tRF-22通过调节脉络膜血管功能在近视进展中的保护作用。tRF-22阻断METTL3介导的Axin1或Arid1b mRNA转录物的m6A甲基化,使Axin1或Arid1b表达增加,从而产生对Wnt信号的抑制作用。tRF-22可作为一种新的抗血管生成因子。Wen等[51]发现相对于单纯性核性白内障患者,在高度近视的核性白内障患者晶状体前囊中,METTL14表达上调,METTL3、FTO、ALKBH5表达下调。研究首次提供了高度近视患者的完整人类晶状体转录组m6A图,为确定RNA m6A修饰在高度近视病理中的潜在功能提供了基础。
3.10增殖性玻璃体视网膜病变增殖性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是一种难治性玻璃体视网膜纤维化疾病,RPE细胞的EMT是PVR的关键病理机制。Ma等[52]的研究发现METTL3的过表达可以在体外抑制ARPE-19细胞的EMT,在体内抑制PVR过程。研究首次证明mRNA的m6A甲基化修饰参与了PVR的病理过程,为PVR的临床治疗开辟了新视角。
3.11外伤性视神经病变Qu等[53]的动物研究建立了大鼠的外伤性视神经病变(traumatic optic neuropathy,TON)模型,发现TON组的METTL3、WTAP、FTO和ALKBH5的表达均上调。KEGG分析显示m6A峰值上调与MAPK信号通路等显著相关。研究揭示了TON早期m6A的差异表达修饰,可能为TON的机制和治疗提供新的见解。
3.12年龄相关性黄斑变性Chen等[54]的研究确定了环状RNA circSPECC1通过YTHDC1介导的m6A修饰,抵抗氧化应激损伤,维持RPE中的脂质代谢。研究提示,补充circSPECC1可能是一种有希望的治疗年龄相关性黄斑变性的靶点。淀粉样蛋白β(amyloid-β,Aβ)是年龄相关性黄斑变性中RPE变性的关键病理因素。近期的一项研究[55]发现FTO通过m6A去甲基化负调控PKA的表达,通过PKA/CREB信号通路减轻Aβ1-40诱导的视网膜色素上皮细胞变性。研究有助于为年龄相关性黄斑变性提出新的治疗方法。Wang等[56]的研究发现在激光诱导脉络膜新生血管的小鼠模型视网膜下纤维化过程中,METTL3在RPE细胞中上调。研究确定了METTL3-m6A-HMGA2在视网膜下纤维化和RPE细胞EMT中的表观遗传机制,为新生血管性年龄相关性黄斑变性继发性视网膜下纤维化提供了新的治疗靶点。
3.13原发性Sjögren综合征干眼Ma等[57]的横断面研究纳入了48例原发性Sjögren综合征(primary Sjögren’s syndrome,pSS)干眼患者和40例健康对照。研究发现pSS干眼患者的外周血单核细胞的m6A甲基化水平和METTL3表达均升高。m6A和METTL3的上调与pSS干眼患者血清学指标和干眼体征有关,提示METTL3可能参与了pSS干眼的发病机制,还需要进一步的体内和体外实验来验证和阐释。

表2 m6A相关酶在眼科疾病中的生物学作用
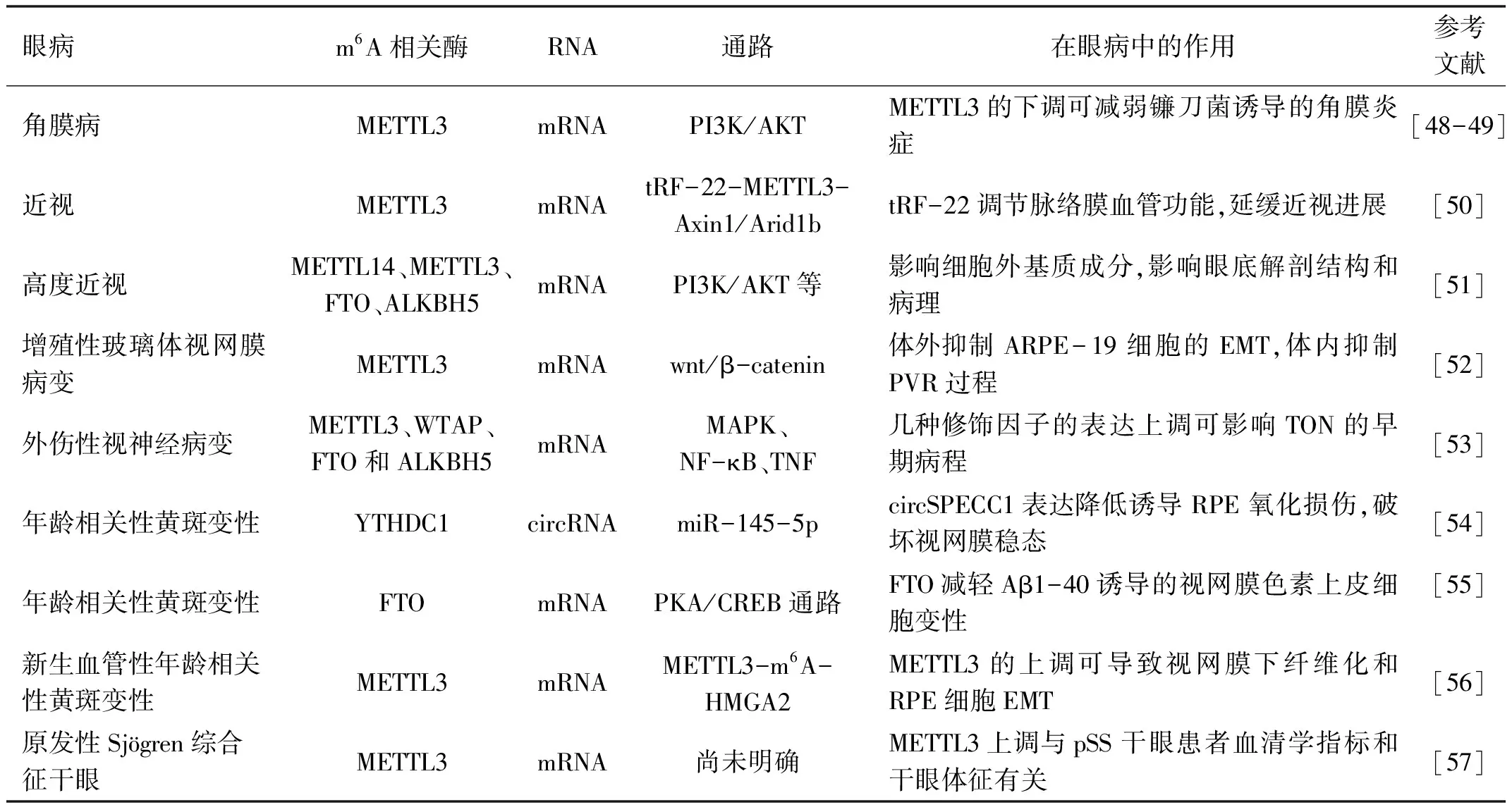
续表2 m6A相关酶在眼科疾病中的生物学作用
4小结与展望
表观遗传学可以作为基因-环境的中介,为研究疾病发生发展机制提供新思路[58]。m6A甲基化在眼科疾病中的研究已涉及多种疾病,其中研究较多的是DR和眼部肿瘤,其他疾病的研究尚处于起步阶段,见表2。未来,靶向m6A调控因子可能通过促进或抑制m6A甲基化来治疗疾病,将为某些眼科疾病的患者带来新的希望。

