多成分含量测定结合抗氧化活性的化学计量学分析筛选五味子标准汤剂质量标志物的研究
林伟雄,王寿富,陈仕妍,陈清怡,莫秋怡,吴晓英,张正,邓李红
(广东一方制药有限公司,广东省中药配方颗粒企业重点实验室,广东 佛山 528244)
五味子为木兰科植物五味子Schisandrachinensis(Turcz.) Baill.的干燥成熟果实,又称“北五味子”,在《神农本草经》中列为上品,主产于东北三省[1]。五味子具有益气生津,收敛固涩,补肾宁心的功效,用于治疗久咳虚喘、心悸失眠、自汗、盗汗、遗精遗尿等病症[2]。五味子具有悠久的用药历史及临床安全性,已被列入《可用于保健食品的物品名单》[3],其中所含的木脂素、有机酸及黄酮等[3-6]多种化学物质群具有明显的抗氧化效果[7-8],作为天然的抗氧化剂具有广阔的开发前景[9]。
中药标准汤剂是基于中医理论与临床基础,经标准化工艺制备而成的水煎剂,作为中药配方颗粒工艺优化和质量控制的参照基准[10-11]。《中药配方颗粒质量控制与标准制定技术要求》提出,明确标准汤剂质量标准及其在制剂制备中的应用方法,有助于全过程把控中药制剂的整体内在质量,进而保障配方颗粒与临床汤剂用药和剂量的一致性[12]。目前,关于五味子标准汤剂的研究报道较少,仅有文献[13-15]涉及了相关质量标准的建立及评价研究,尚无针对标准汤剂中化学成分与抗氧化活性方面的相关性评价。中药水煎剂成分,作用靶点、途径以及药效规律复杂,单一的化学质量研究不能满足中药评价整体性、临床用药一致性的需求,因此,对中药进行多层次质量控制显得尤为重要[16]。本文以五味子标准汤剂为研究对象,结合超高效液相色谱(UPLC)法和一测多评(QAMS)法同时测定8种成分的含量,并基于抗氧化活性和成分指标的相关性评价,初步筛选抗氧化质量标志物;进一步针对候选成分进行分子对接以及抗氧化活性的单体验证,以确定合理的质量标志物。本文旨在为五味子标准汤剂的全面质量评价提供有效、客观、可行的方法。
1 材料
1.1 仪器
MiliQ Direct 8型超纯水机(德国Merck公司);KQ-500DE型数控超声清洗器(昆山市超声仪器有限公司);H-Class型UPLC仪(Empower3工作站,美国Waters公司);Thermo Vanquish型UPLC仪[赛默飞世尔科技(中国)有限公司];Agilent 1290 Infinity Ⅱ型UPLC仪(美国Agilent公司);UV-2600 probe型紫外-可见分光光度计(日本Shimadzu公司);ME204E型万分之一天平、XP26百万分之一天平(瑞士Mettler Toledo公司)。
1.2 药材与试剂
5-羟甲基糠醛对照品(批号:CFS202102;纯度:98%)购自ChemFaces公司;原儿茶酸对照品(批号:110809-201906;纯度:99.7%)、五味子醇甲对照品(批号:110857-201815;纯度:99.7%)、五味子甲素对照品(批号:110764-201915;纯度:99.5%)、五味子乙素对照品(批号:110765-201813;纯度:99.1%)、维生素C(批号:100425-202105;纯度:100%)均购自中国食品药品检定研究院;五味子醇乙对照品(批号:ST05480120;纯度:98%)购自上海诗丹德生物技术有限公司;当归酰基戈米辛H对照品(批号:wkq20090202;纯度:99.51%)购自四川省维克奇生物技术有限公司;五味子酯乙对照品(批号:21091406;纯度:98.81%)购自成都普菲德生物技术有限公司;2,2'-氨基-二(3-乙基-苯并噻唑啉磺酸-6)铵盐(ABTS)和1,1-二苯基-2-三硝基苯自由基(DPPH)购自苏州格锐思生物科技有限公司;乙腈为色谱级,其余试剂为分析纯,水为超纯水。
15批五味子饮片(编号S1~S15,具体来源信息见表1)经广东一方制药有限公司孙冬梅主任中药师鉴定为木兰科植物五味子Schisandrachinensis(Turcz.) Baill.的干燥成熟果实。

表1 15批五味子饮片来源信息Table 1 Resource information of 15 batches of Schisandra Chinensis Fructus
2 方法与结果
2.1 色谱条件
色谱柱:Waters ACQUITY UPLC HSS T3(150 mm×2.1 mm, 1.8 μm);流动相A:乙腈,流动相B:0.2%冰醋酸溶液,梯度洗脱(0~3 min,5%A;3~5 min,5%~45%A;6~13 min,45%~50%A;13~23 min,50%~100%A;23~25 min,100%A;25~31 min,100%~5%A);检测波长:260 nm;流速:0.4 mL·min-1;柱温:30 ℃;进样量:1 μL。
2.2 对照品溶液的制备
取对照品5-羟甲基糠醛、原儿茶酸、五味子醇甲、五味子醇乙、当归酰基戈米辛H、五味子酯乙、五味子甲素和五味子乙素适量,精密称定,加甲醇制成每1 mL中分别含5-羟甲基糠醛321.83 μg,原儿茶酸470.33 μg,五味子醇甲390.75 μg,五味子醇乙268.13 μg,当归酰基戈米辛H 340.72 μg,五味子酯乙197.82 μg,五味子甲素299.10 μg和五味子乙素138.15 μg的混合对照品储备溶液。
2.3 供试品溶液的制备
取干燥的五味子饮片100 g,加入8倍量的水,浸泡30 min后,武火煮沸后用文火保持微沸30 min,经纱布滤过;残渣加入6倍量的水,武火煮沸后用文火保持微沸25 min,经纱布滤过;合并2次煎液,60 ℃减压浓缩至500 mL,共制备15批生药浓度为200 mg·mL-1的五味子标准汤剂浓缩液[17]。取标准汤剂浓缩液各1 mL,置10 mL量瓶中,加入甲醇定容,摇匀,0.22 μm微孔滤膜滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 系统适用性试验 分别精密量取混合对照品溶液、供试品溶液、空白溶剂(甲醇)各1 μL,注入H- Class型UPLC仪。按“2.1”项下色谱条件进样分析,结果见图1。空白溶剂对待测成分无检测干扰,各成分保留时间一致、色谱峰的分离度均大于1.5。

注:A.混合对照品;B.标准汤剂样品;C.空白溶剂;1.5-羟甲基糠醛;2.原儿茶酸;3.五味子醇甲;4.五味子醇乙;5.当归酰基戈米辛H;6.五味子酯乙;7.五味子甲素; 8.五味子乙素
2.4.2 线性关系考察 精密吸取“2.2”项下混合对照品储备溶液0.1、0.25、0.5、2.5、5 mL,分别置于10 mL量瓶中,甲醇定容得5个不同质量浓度的系列混合对照品溶液,连同储备溶液一起,按“2.1”项下色谱条件进样分析,记录峰面积。以各待测对照品的质量浓度(x)为横坐标、峰面积(y)为纵坐标,进行线性回归。由表2可见8个成分在相应的线性范围内呈良好的线性关系。
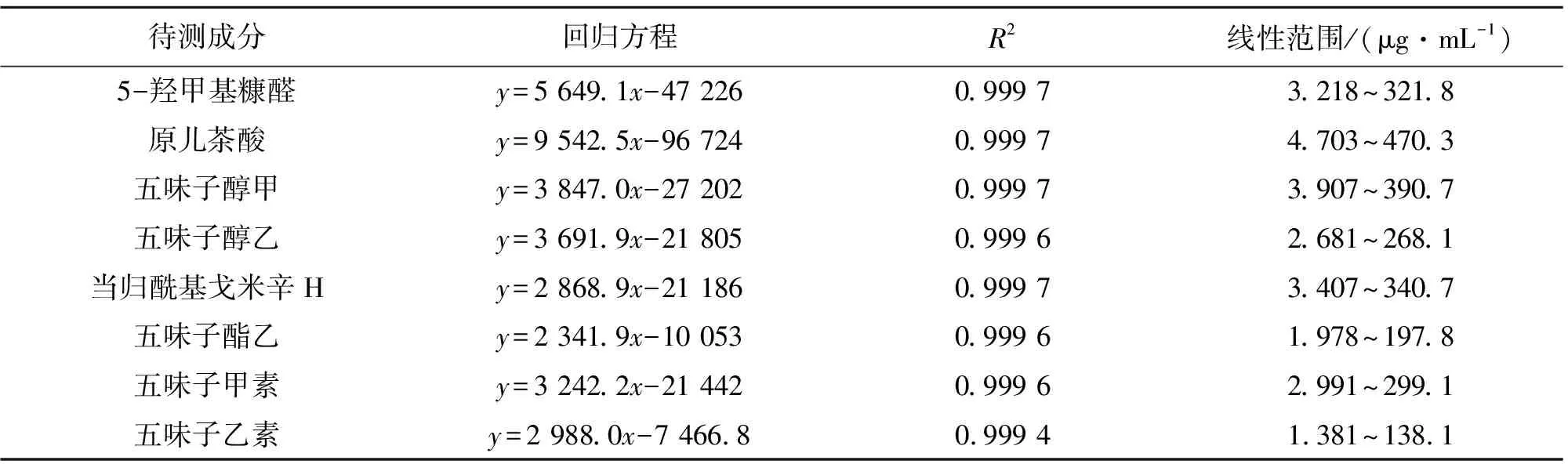
表2 8个成分线性关系Table 2 Linear relationships for 8 constituents
2.4.3 稳定性试验 精密量取同一批五味子标准汤剂(编号S1)1份,按“2.3”项下方法制备供试品溶液,分别于室温放置0、2、4、8、12、24 h时,按“2.1”项下色谱条件进样测定,记录各成分的保留时间和峰面积,计算RSD。5-羟甲基糠醛、原儿茶酸、五味子醇甲、五味子醇乙、当归酰基戈米辛H、五味子酯乙、五味子甲素、五味子乙素峰面积的RSD分别为1.80%、1.18%、0.37%、0.67%、0.52%、1.08%、0.38%、0.74%,保留时间的RSD分别为0.65%、0.68%、0.11%、0.14%、0.20%、0.12%、0.08%、0.07%(n=6),表明五味子供试品溶液在24 h内稳定性良好。
2.4.4 精密度试验 精密量取同一批五味子标准汤剂(编号S1)1份,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样6次,记录各成分的保留时间和峰面积,计算RSD。5-羟甲基糠醛、原儿茶酸、五味子醇甲、五味子醇乙、当归酰基戈米辛H、五味子酯乙、五味子甲素、五味子乙素峰面积的RSD分别为1.59%、0.81%、0.14%、0.22%、0.46%、0.42%、0.11%、0.56%,保留时间的RSD分别为0.81%、0.85%、0.15%、0.17%、0.19%、0.10%、0.07%、0.06%(n=6),表明本仪器精密度良好。
2.4.5 重复性试验 精密量取同一批五味子标准汤剂(编号S1)6份,按“2.3”项下方法平行制备供试品溶液,按“2.1”项下色谱条件进样测定,记录各成分的保留时间和峰面积,计算RSD。5-羟甲基糠醛、原儿茶酸、五味子醇甲、五味子醇乙、当归酰基戈米辛H、五味子酯乙、五味子甲素、五味子乙素含量的RSD分别1.83%、2.09%、1.70%、1.91%、1.47%、1.94%、1.83%、1.81%,保留时间的RSD分别为0.30%、0.33%、0.04%、0.05%、0.06%、0.03%、0.01%、0.01%(n=6),表明该方法重复性良好。
2.4.6 加样回收率考察 精密称定已知含量的同一批五味子标准汤剂6 份,每份0.5 mL,按照1∶1比例加入对照品适量,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样分析,计算加样回收率。5-羟甲基糠醛、原儿茶酸、五味子醇甲、五味子醇乙、当归酰基戈米辛H、五味子酯乙、五味子甲素、五味子乙素的平均加样回收率分别为106.84%、95.85%、102.78%、100.82%、102.24%、105.17%、102.10%、95.47%,RSD分别为1.67%、1.88%、0.76%、1.91%、2.71%、2.37%、1.29%、1.80%。
2.5 6种木脂素类成分QAMS法的建立
2.5.1 相对校正因子(fi)的测定 分别精密吸取“2.4.2” 项下的系列混合对照品溶液,按“2.1”项下色谱条件进样测定,记录峰面积。以五味子醇甲为内参物,根据公式fi=(As·Ci)/(Ai·Cs)(As、Ai为内参物和待测成分的峰面积,Cs、Ci为内参物和待测成分的质量浓度),计算得到五味子醇乙、当归酰基戈米辛H、五味子酯乙、五味子甲素、五味子乙素的fi分别为1.03、1.31、1.61、1.18、1.19,其RSD分别是1.05%、0.67%、0.35%、0.52%、1.27%,相对保留时间分别是1.14、1.34、1.49、1.66、1.72。
2.5.2 不同仪器、色谱柱、柱温、流速对fi的影响 在其它色谱条件不变的情况下,分别考察不同仪器(Waters H-Class型、Thermo Vanquish型、Agilent 1290 Infinity Ⅱ型UPLC仪)、色谱柱[ACQUITY UPLC HSS T3(150 mm×2.1 mm, 1.8 μm)、CORTECS UPLC T3(150 mm×2.1 mm, 1.6 μm)、ACQUITY UPLC BEH C18(150 mm×2.1 mm, 1.7 μm)]、柱温(25、30、35 ℃)、流速(0.3、0.35、0.4 mL·min-1)对各成分fi的影响,结果见表3。各成分fi的RSD为0.77%~1.86%,表明不同仪器、色谱柱、柱温、流速对5种成分的fi的影响较小。
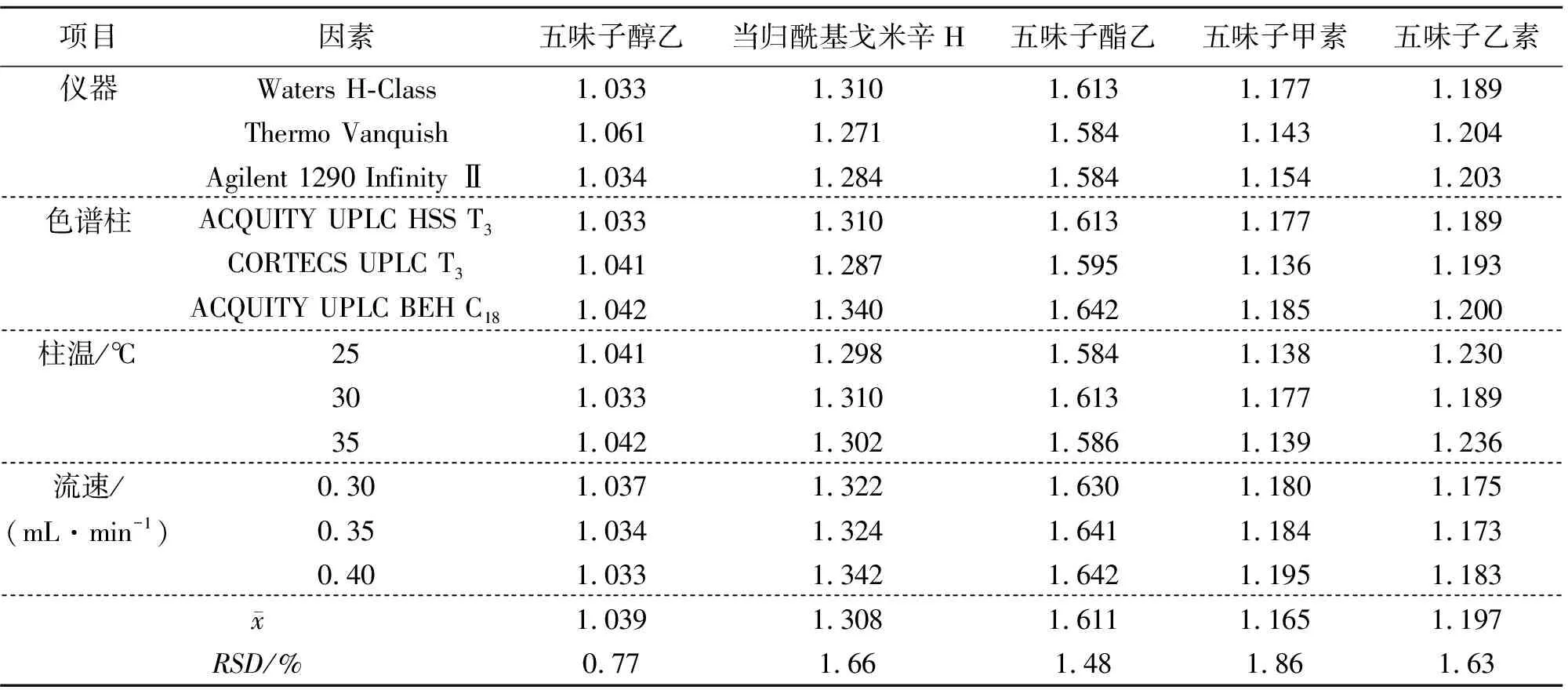
表3 不同仪器、色谱柱、柱温和流速对fi的影响Table 3 Effects of various instruments, chromatographic columns, column temperatures and flow rates on fi
2.5.3 不同仪器、色谱柱、柱温、流速对相对保留时间的影响 以五味子醇甲为内参物,考察“2.5.2”项下不同仪器、色谱柱、柱温、流速对五味子醇乙、当归酰基戈米辛H、五味子酯乙、五味子甲素、五味子乙素相对保留时间的影响,结果见表4。5种成分的相对保留时间RSD为0.71%~2.71%,表明该方法可用于对目标色谱峰的准确定位。

表4 不同仪器、色谱柱、柱温和流速对相对保留时间的影响Table 4 Effects of various instruments, chromatographic columns, column temperaturesand flow rates on the relative retention time
2.6 五味子标准汤剂8种成分含量测定
取15批五味子标准汤剂,分别按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样分析,采用外标法(ESM)计算2种有机酸和6种木脂素类成分的含量,并进一步比较ESM和QAMS计算方法下5个木脂素成分的含量结果差异,见表5。2种检测结果较为接近,相对误差(RE)<3.5%;同时,借助Prism 9.0 对2者进行t检验,2种测定方法的结果无统计学差异(P>0.05),所建立的方法可用于五味子标准汤剂中5-羟甲基糠醛、原儿茶酸和木脂素类(五味子醇甲、五味子醇乙、当归酰基戈米辛H、五味子酯乙、五味子甲素和五味子乙素)共8种成分的同步含量测定。
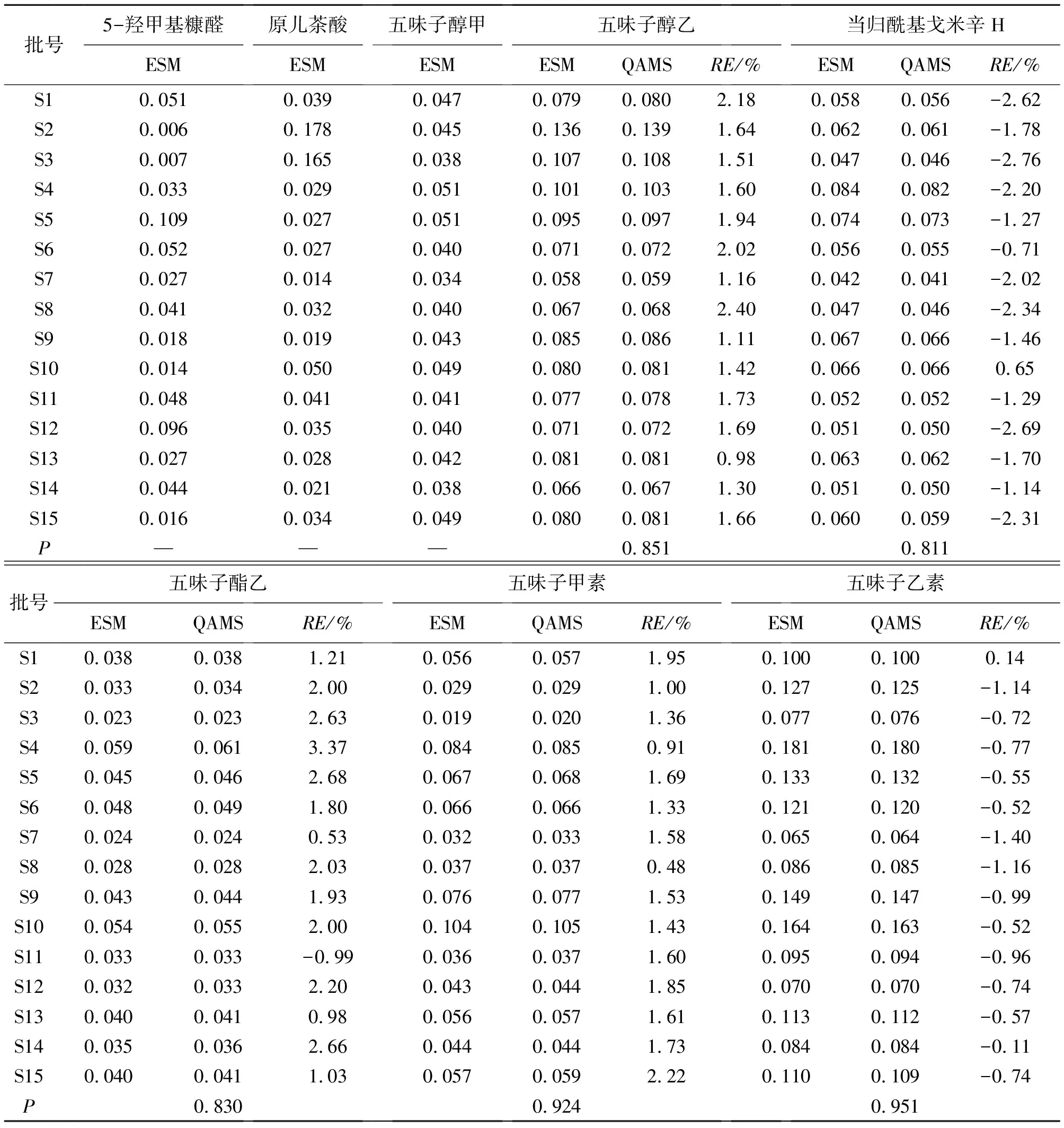
表5 各成分含量测定结果(%,n=2)Table 5 Results of content determination results for various components(%,n=2)
2.7 化学模式分析
以不同批次五味子标准汤剂的不同成分含量为原始数据,MetaboAnalyst,以基于Ward法的欧氏距离为度量进行系统聚类热图,可直观反映样品的近似程度及化学成分的整体分布规律,结果见图2。所有样品大致聚为3类,Ⅰ类包括S2~S3,Ⅱ类包括S7~S8、S11~S12、S14,Ⅲ类包括S1、S4~S6、S9~S10、S13、S15。其中,产自黑龙江的S2和S3,与另外1批黑龙江产的样品(S1)以及其它2个产地明显区分开,说明样品可能受产地来源以及加工等因素影响,其质量存在一定个体差异。不同颜色代表不同成分指标的含量高低,第Ⅰ类标准汤剂中的原儿茶酸和五味子醇乙含量响应强度较高,五味子酯乙、五味子甲素、当归酰基戈米辛H和五味子乙素在第Ⅲ类中响应较高,这些成分可能构成不同批次样品之间的主要差异性组分。
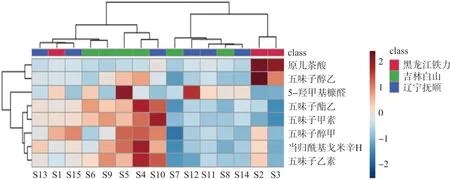
图2 系统聚类热图Fig.2 Heatmap of system cluster analysis
为了更客观地量化导致样品质量差异的化学成分,将不同成分的含量导入SIMCAP 14.0以进行OPLS-DA建模,分别生成得分散点图(图3)以及变量投影重要性(VIP)值图(图4)。所拟合的模型中,R2x(cum)为0.840,稳定性参数R2y(cum)为0.756,模型预测能力Q2(cum)为0.627,表明模型稳定性和预测能力均良好。200次置换检验(图5)显示R2和Q2左侧的点均高于右侧的点,斜率均为正值,Q2与纵轴相交数值<0,模型验证有效,无过拟合现象。图3中样品划分为3类,且结果与聚类分析一致。VIP值>1的变量对解释差异具有较大的贡献意义,可作为影响五味子标准汤剂的主要质量差异物质[18]。以VIP值>1为条件筛选质量差异成分,可得到对样品质量差异贡献较大的4个成分:原儿茶酸(VIP值=1.140 1)、五味子醇乙(VIP值=1.139 2)、五味子乙素(VIP值=1.021 2)、五味子酯乙(VIP值=1.002 7),提示这4者为质量控制过程中的潜在质量标志物。
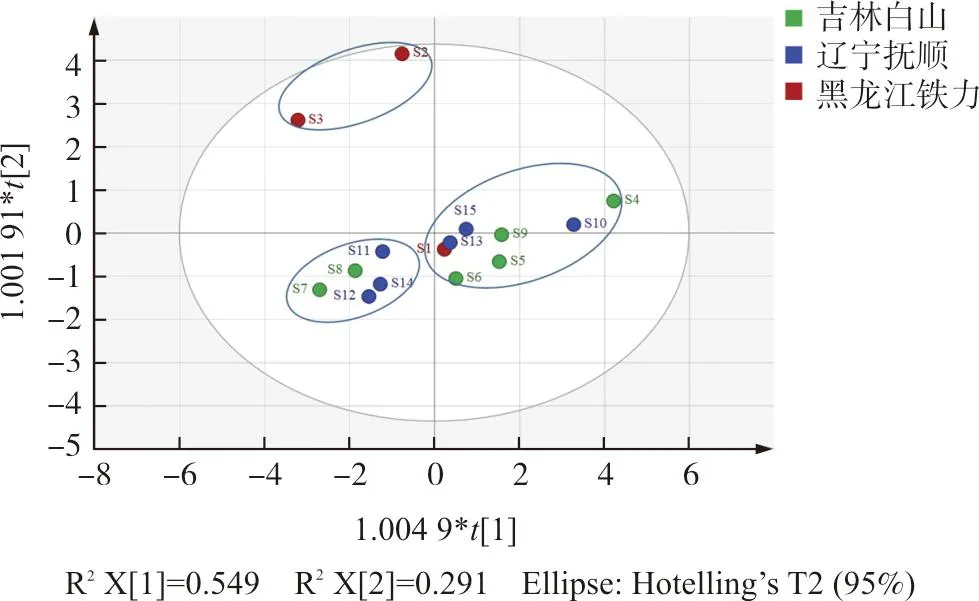
图3 OPLS-DA得分散点图Fig.3 Scoring scatter plot by OPLS-DA
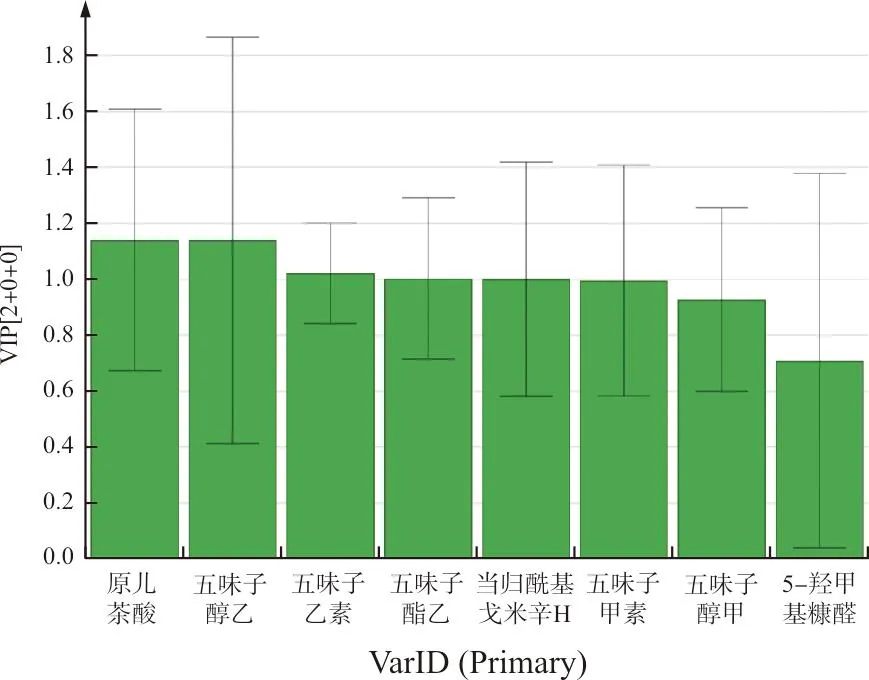
图4 VIP值图Fig.4 VIP values

图5 OPLS-DA模型置换检验Fig.5 Permutation test for OPLS-DA model
2.8 五味子标准汤剂抗氧化活性测定
2.8.1 样品溶液的制备 取15批“2.3”项下五味子标准汤剂浓缩液,滤过,取续滤液,加水稀释,制得质量浓度(按生药量计)分别为0.25、0.5、2.0、5.0、10.0 mg·mL-1的系列浓度溶液A,用于DPPH自由基清除试验;同法制得质量浓度(按生药量计)分别为1.0、2.0、5.0、10.0、25.0 mg·mL-1的系列浓度溶液B,用于ABTS自由基清除试验。
2.8.2 DPPH自由基清除试验 参照文献[19]方法并做出调整,配制0.06 mmol·L-1的DPPH作为反应底物,以维生素C为阳性对照,取“2.8.1”项下样品溶液A,分别设置空白组(400 μL甲醇+600 μL DPPH溶液)、对照组(400 μL样品+600 μL甲醇)、样品组(400 μL样品或维生素C+600 μL DPPH溶液),避光反应30 min后,使用紫外-分光光度计测得517 nm波长处的吸光度,计算自由基清除率:自由基清除率=[1-(A样品组-A对照组)/A空白组]×100%。以样品浓度为横坐标,自由基清除率为纵坐标,绘制清除曲线,计算DPPH自由基半数清除浓度(IC50)值,结果见表6。
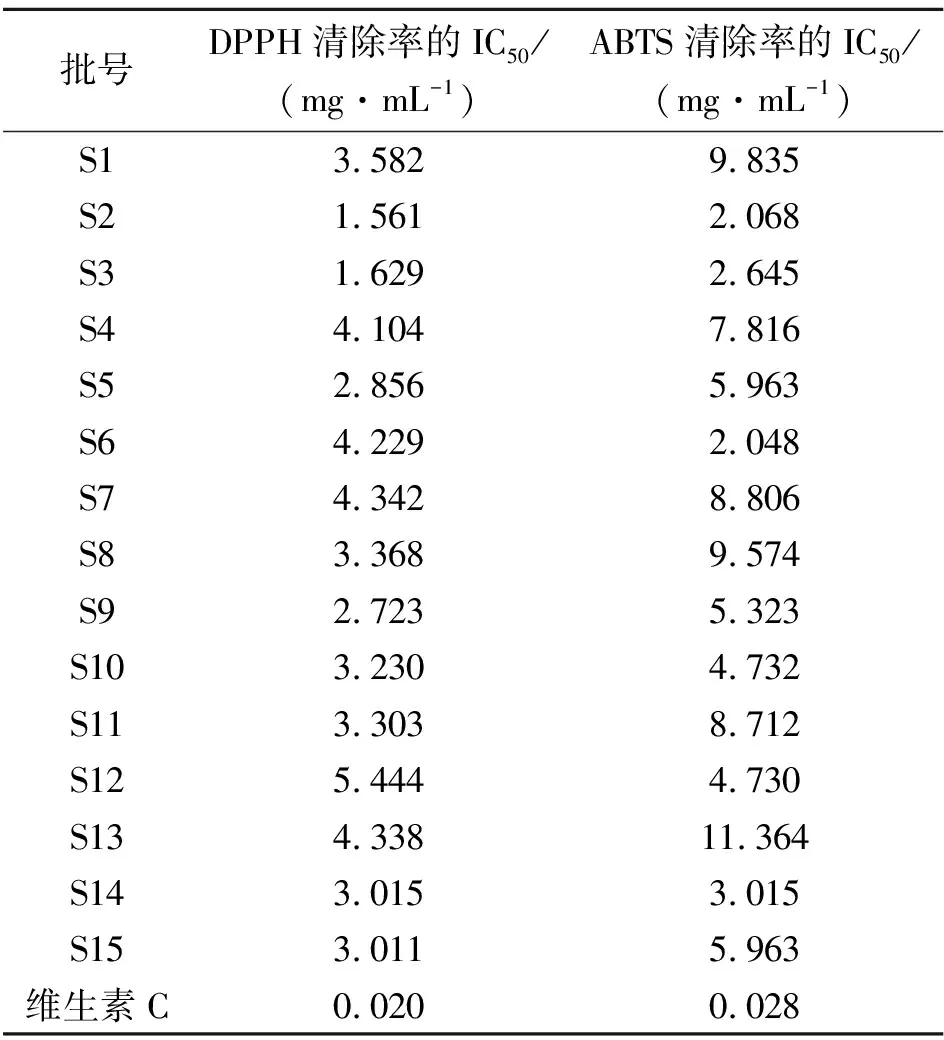
表6 15批五味子标准汤剂抗氧化活性测定结果Table 6 Results of antioxidative activities for 15 batchesof Schisandra Chinensis Fructus standard decoction
2.8.3 ABTS自由基清除试验 参照文献[19]方法并做出调整,将7 mmol·L-1的ABTS储备液和140 mmol·L-1的K2S2O8等体积混合,于4 ℃下避光保存12 h,得到ABTS·+工作液,反应时采用无水乙醇进行稀释。以ABTS·+为底物,维生素C为阳性对照,取“2.8.1”项下样品溶液B,分别设置空白组(50 μL无水乙醇+950 μL ABTS·+溶液)、对照组(50 μL样品+950 μL 无水乙醇溶液)、样品组(50 μL样品+950 μL ABTS·+溶液),避光反应6 min后,于734 nm波长处测得吸光度,计算自由基清除率:自由基清除率=[1-(A样品组-A对照组)/A空白组]×100%。以样品浓度为横坐标,自由基清除率为纵坐标,绘制清除曲线,计算ABTS自由基半数清除浓度(IC50)值,结果见表6。
2.8.4 结果分析 由表6可知,各样品对DPPH和ABTS自由基均有一定的清除效果,但均弱于阳性组。不同批次样品之间抗氧化能力差异较大,代表DPPH清除能力的IC50值在1.561~5.444 mg·mL-1之间,样品清除DPPH的能力大小为S2>S3>S9>S5>S15>S14>S10>S11>S8>S1>S4>S6>S13>S7>S12,其中,排名靠前的为产自黑龙江的S2和S3批次;代表ABTS清除能力的IC50在2.048~11.364 mg·mL-1之间,样品清除ABTS的能力大小为S6>S2>S3>S14>S12>S10>S9>S5>S15>S4>S11>S7>S8>S1>S13,排名靠前的为黑龙江的S2和S3、吉林的S6批次。虽然整体上S2和S3这2批黑龙江产地样品对DPPH和ABTS的清除能力较为靠前,但剩余的1个黑龙江批次样品与其余2个产地(吉林和辽宁)的样品之间无明显强弱之分,说明五味子标准汤剂抗氧化效果的差异可能受产地来源、加工处理以及采收时间等多种外界条件影响。
2.9 谱效关系分析
2.9.1 灰色关联度分析(GRA) 以DPPH、ABTS自由基清除活性指标为母序列,五味子标准汤剂中的8种成分含量为子序列,进行GRA,采用均值化将原始数据进行无量纲化,再计算各子序列与母序列的绝对差、关联系数,最终确定关联度(r),结果见表7。一般认为,r>0.5时表示子序列与母序列有一定关系,数值越大则该成分与抗氧化作用的相关性越大[20]。由此可知,8个成分与DPPH、ABTS自由基清除能力的r值均大于 0.5,说明各成分对抗氧化效应均有不同程度的贡献。8种成分对DPPH自由基清除作用的贡献度为原儿茶酸>五味子醇乙>五味子乙素>当归酰基戈米辛H>五味子酯乙>五味子甲素>五味子醇甲>5-羟甲基糠醛,对ABTS自由基清除作用的贡献度为原儿茶酸>五味子醇乙>五味子甲素>五味子酯乙>五味子乙素>5-羟甲基糠醛>当归酰基戈米辛H>五味子醇甲。在2种抗氧化能力GRA排名中均靠前5位的成分为原儿茶酸、五味子醇乙、五味子酯乙、五味子乙素。
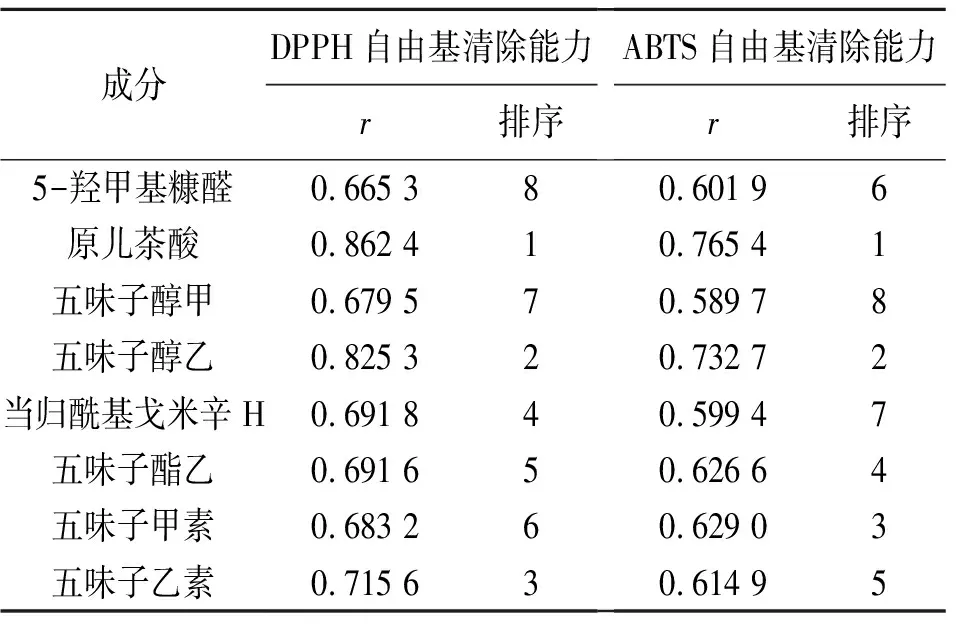
表7 GRA结果Table 7 Results of GRA
2.9.2 偏最小二乘回归分析(PLSR) 由于GRA侧重于阐述成分与活性之间关联程度的大小,因此需要进一步结合PLSR综合描述各成分对活性指标的贡献率和相互作用。以样品8个成分的含量为自变量,以DPPH、ABTS自由基清除作用为因变量,分别导入SIMCA 14.0进行PLSR。一般情况下,VIP值大于0.5的自变量被认为对解释因变量具有意义,VIP值大于1的自变量被认为对解释因变量有较大意义[18];同时,当标准化回归系数为正值则表示成分含量与抗氧化效应呈正相关,反之为负相关。由图6可知,五味子标准汤剂中对DPPH清除活性的VIP值大于0.5的成分为原儿茶酸、五味子醇乙、5-羟甲基糠醛、五味子甲素和五味子酯乙,提示这些成分与DPPH自由基反应密切相关;其中,原儿茶酸、五味子醇乙、五味子乙素的回归系数分别为0.395、0.360、0.035,呈正相关性,提示这3个成分对清除DPPH具有重要作用。由图7可知,五味子标准汤剂中对ABTS清除活性的VIP值大于0.5的成分为原儿茶酸、五味子醇乙、五味子酯乙、五味子甲素、5-羟甲基糠醛和五味子醇甲,提示这些成分与ABTS自由基反应密切相关;其中,原儿茶酸、五味子醇乙、五味子酯乙的回归系数分别为0.382、0.279、0.131,呈明显正相关,提示其对清除ABTS具有重要作用。此外,五味子乙素的VIP值(0.492)接近0.5,且具有较明显的正回归值(0.085),因此推测其对ABTS清除作用也具有贡献意义。
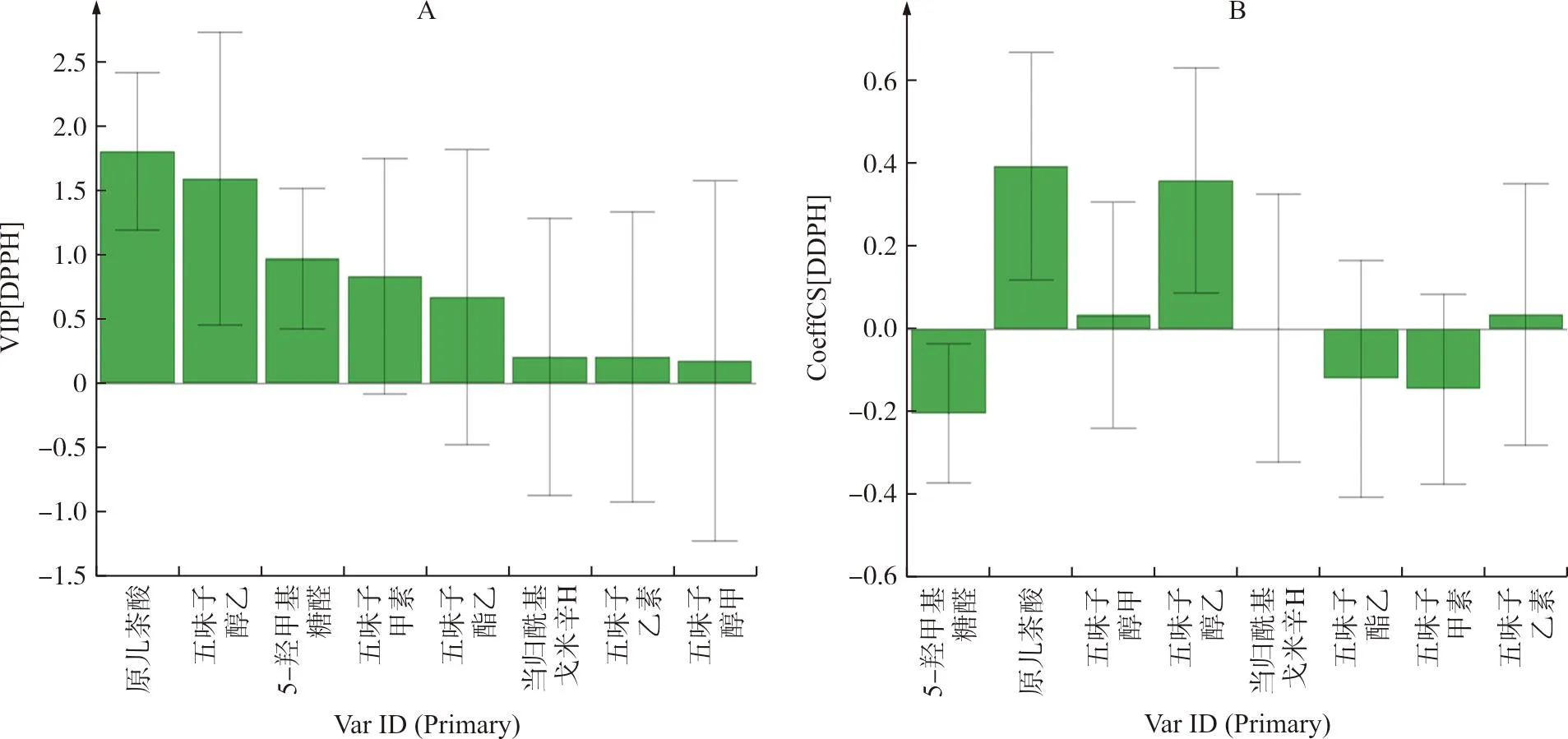
图6 各成分对DPPH清除作用的VIP值贡献图(A)和标准化回归系数图(B)Fig.6 VIP contribution(A) and normalized regression coefficient(B) diagrams ofDPPH scavenging activity by various components

图7 各成分对ABTS清除作用的VIP贡献图(A)和标准化回归系数图(B)Fig.7 VIP contribution(A) and normalized regression coefficient(B) diagrams ofABTS scavenging activity by various components
根据GRA和PLSR的综合结果,在GRA排名前5位的基础上,以DPPH或ABTS任一指标的PLSR模型中VIP值接近或大于0.5、回归系数为正值优选原儿茶酸、五味子醇乙、五味子酯乙和五味子乙素为五味子标准汤剂抗氧化活性的候选质量标志物。
2.10 分子对接预测
通过结合化学计量学,筛选出4个备选的质量和抗氧化活性差异成分原儿茶酸、五味子醇乙、五味子酯乙及五味子乙素,基本满足作为质量标志物的专属性、稳定性、可测性、有效性等基本特征[20],推测其可能为五味子标准汤剂发挥抗氧化活性的质量标志物。为进一步探究4个成分与抗氧化活性的关联,采用分子对接初步预测其与相关靶点的结合机制。从PubChem数据库获取配体化合物SDF结构,通过检索相关文献[21-24]和RSCB蛋白数据库获取9个抗氧化相关受体的晶体结构,具体信息见表8。对蛋白进行去水和修饰配体、加电荷、计算Gasteiger等常规处理,导出PDB格式文件完成受体准备。将受体和化合物导入AutoDockTools 1.5.6软件,确定对接盒子的位置及大小,导出PDBQT格式文件;之后用AutoDock vina 1.1.2软件进行配体化合物与受体的对接模拟,所得结果采用Pymol软件进行可视化分析[25]。

表8 抗氧化相关受体蛋白信息Table 8 Information about antioxidant-related receptors
化合物与靶点之间的结合能越小,表明释放的能量更多,结合体的构象越稳定,一般认为结合能<-5.0 kJ·moL-1表示结合活性较好,结合能<-7.0 kJ·moL-1表示结合活性极强[26]。根据表9结果可知,4个活性成分与多个抗氧化受体蛋白均有一定的结合能力,主要与LOX-5、HO-1、CYP2C9、HO-2、XOD均有较好的亲和力,原儿茶酸、五味子酯乙与CYP2C9,五味子醇乙与HO-2,五味子乙素与XOD的结合性最好,具体对接示意图见图8。分子通过与氨基酸残基的相互作用保证其与靶点之间较强的结合力,原儿茶酸结合CYP2C9,与TRP-120、ARG-124、ILE-112和VAL-436等残基形成氢键作用,平均键长为2.1 Å;五味子醇乙结合HO-2,与ALA-208和ASP-210残基形成氢键作用,平均键长为2.6 Å;五味子酯乙结合CYP2C9,与ARG-132和LYS-270残基形成氢键作用,平均键长为2.3 Å;五味子乙素结合XOD,与ASN-1173残基形成氢键作用,平均键长为2.7 Å。4个高活性成分可能通过参与酶促氧化体系调节氧化应激进而发挥抗氧化作用。

注:A.原儿茶酸与CYP2C9对接图;B.五味子醇乙与HO-2对接图;C.五味子酯乙与CYP2C9对接图;D.五味子乙素与XOD对接图
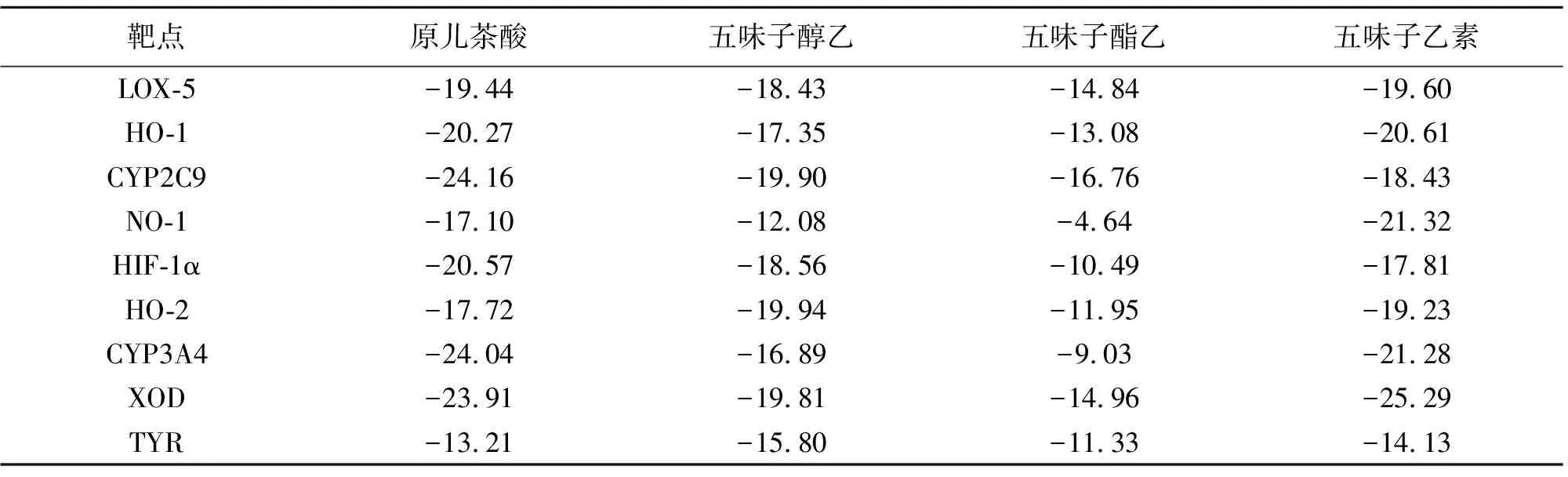
表9 五味子标准汤剂活性成分与靶点对接的结合能/(kJ·moL-1)Table 9 Binding energy between active components from Schisandra Chinensis Fructusstandard decoction and targets/(kJ·moL-1)
2.11 单体成分对DPPH和ABTS自由基清除能力的验证
精密称定4种活性成分单体对照品,以甲醇为溶剂,分别将其配制成1.07、0.43、0.17、0.069、0.027、0.011、0.004 mg·mL-1的系列浓度的溶液,与DPPH、ABTS工作液反应,计算各成分的清除率。表10结果表明,原儿茶酸对DPPH和ABTS自由基均具有较强的清除活性,且呈现明显的浓度依赖关系,IC50值分别为0.020、0.049 mg·mL-1。而五味子醇乙、五味子酯乙及五味子乙素的单体对照品溶液在相应浓度范围内对DPPH和ABTS均无清除作用,因此,最终建议将原儿茶酸作为五味子标准汤剂抗氧化活性的质量标志物。
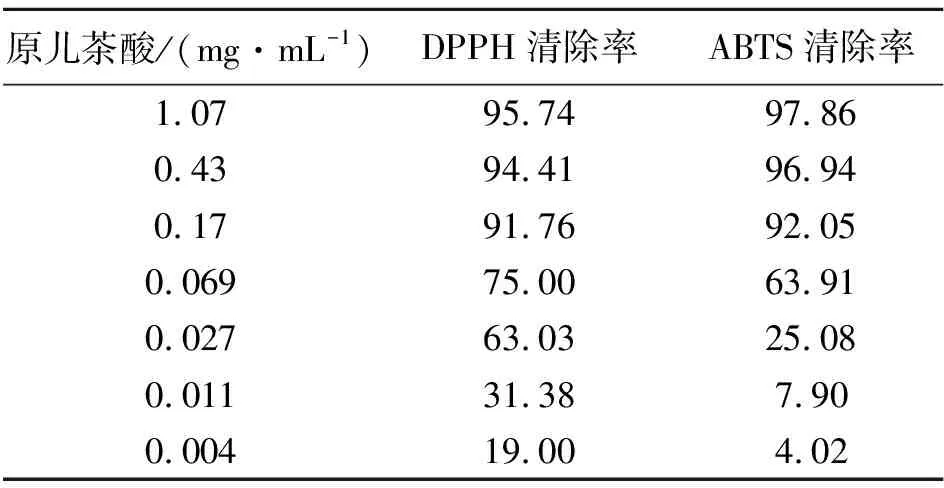
表10 单体化合物DPPH、ABTS自由基清除率(%)Table 10 Free radical scavenging rate against DPPHand ABTS by single compound(%)
3 讨论
预实验分别对甲醇-水、乙腈-水、乙腈-0.1%磷酸、乙腈-0.1%冰醋酸、乙腈-0.2%冰醋酸等不同流动相体系进行了考察,发现采用乙腈-0.2%冰醋酸流动相系统时,各色谱峰分离效果良好,峰形较好,且基线相对平稳。考察不同流速0.3、0.35、0.4 mL·min-1下,各成分色谱峰峰形和分离度均良好,最终选择0.4 mL·min-1,客观上可提高分析效率。以五味子醇甲为内标物,对6种木脂素类成分建立QAMS,QAMS与ESM的测定结果无显著性差异(P>0.05),并对其余2种成分(5-羟甲基糠醛、原儿茶酸)同步进行含量测定,进而建立了基于QAMS的8种成分的含量测定方法。
样品含量聚类和OPLS-DA分析结果显示,原儿茶酸、五味子醇乙、五味子酯乙、五味子乙素是导致批次间质量差异的主要成分。批次S2和S3均聚为一类,这2批样品中原儿茶酸和五味子醇乙的含量均明显高于其它批次;这2批样品清除DPPH和ABTS自由基的能力亦在样品中靠前,抗氧化效果较好,可能与原儿茶酸和五味子醇乙含量较高有关,同时推测这可能是由于药材的产地、采收期以及加工方式等因素综合导致的质量差异。
GRA结果显示,8种成分均与抗氧化作用具有关联性,其中原儿茶酸、五味子醇乙的关联度最高;在PLSR中,原儿茶酸、五味子醇乙、五味子乙素与DPPH、ABTS的清除作用均呈正相关,五味子酯乙则与ABTS的清除作用呈正相关。同时,借助标准化回归系数表征不同成分与活性指标之间的正负相关性,剔除GRA数值大但对抗氧化产生抑制作用的物质,2种方法互为补充和印证。原儿茶酸是典型的具邻羟基的多酚化合物,邻苯二酚结构决定了其羟基极易断裂并失去电子的性质,该结构能够结合活性自由基ROS、O2等并使其淬灭;此外,原儿茶酸通过螯合过渡金属离子,或上调机体超氧化歧化酶(SOD)、过氧化氢酶(CAT)多种酶活性,以阻止H2O2等自由基链式反应,在多种氧化应激模型中具有明显的抗氧化能力[27]。DPPH和ABTS自由基分别通过氢转移和电子转移终止自由基反应,理论上由联苯环辛烯型木脂素上的酚羟基提供可解离的质子或电子进行清除,但大部分木脂素类的酚羟基很少,多为解离度较低的二氧甲基取代基团,因此与自由基的结合特性主要取决于该基团C原子的正电荷密度大小和空间位阻。本研究综合五味子标准汤剂对DPPH和ABTS的清除活性,推测木脂素成分对自由基的清除活性可能存在以下规律:五味子醇乙、五味子乙素和五味子酯乙均有相对良好的活性,而五味子醇甲、当归酰基戈米辛H以及五味子甲素的活性相对较弱甚至无清除活性[28-29]。
据文献报道,CYP2C9属于细胞色素酶家族成员,正常生理状态下通过催化代谢途径中的氧化还原反应维持氧化还原的平衡,病理状态下CYP2C9基因过表达导致副产物ROS自由基的大量产生,从而加剧氧化应激、肝损伤、炎症反应等各种代谢异常[30]。XOD通过催化黄嘌呤氧化生成超氧阴离子或过氧化氢,引起多种组织氧化损伤[31],而五味子活性成分可以作为这些氧化关键酶的抑制剂。分子对接是一种常用的分子构象模拟工具,可用于探究活性物质与不同氧化酶的结合机制。基于谱效筛选结果,进一步对潜在的单体成分进行分子对接预测,发现原儿茶酸、五味子醇乙、五味子酯乙、五味子乙素均能与多种抗氧化相关靶点进行结合,但随后的体外抗氧化活性实验结果表明,3种木脂素成分均无明显的DPPH和ABTS清除活性,原儿茶酸对2种自由基均有较高的清除能力,其IC50值分别为0.020、0.049 mg·mL-1。
综上所述,原儿茶酸可能通过清除自由基及结合多种核心靶点的方式发挥抗氧化效应,建议将其作为五味子标准汤剂抗氧化作用的质量标志物。值得关注的是,多项研究显示五味子木脂素提取液对DPPH和ABTS均有良好的清除效果[5,32],其清除能力与木脂素成分具有明显的关联性[33-34],由此推测五味子醇乙、五味子酯乙及五味子乙素的清除作用可能是与五味子中多种成分协同作用的结果。同样地,Song等[35-36]表明五味子木脂素单体虽不能直接清除体外DPPH或ABTS自由基,但五味子乙素能通过清除细胞自由基ROS,以及通过Bax和Caspase-3转导凋亡信号通路,降低Aβ介导的PC12细胞毒性[35]。五味子醇乙可降低卵巢癌细胞中的ROS水平,并下调细胞周期蛋白CDK4、CCNB1的表达,进而抑制癌细胞增殖[37]。Liu等[38]实验结果显示五味子酯乙可抑制APP/PS1模型小鼠的氧化应激和BACEI酶以提高其认知水平。此外,本文通过含量-活性关系发现五味子醇乙、五味子酯乙及五味子乙素可能与五味子标准汤剂的抗氧化作用呈正相关,上述分子对接和文献研究亦显示三者可能介导多种相关靶点从而调节氧化应激系统,提示五味子标准汤剂的抗氧化效果可能是通过成分之间的不同作用效应联合产生的。所以,在后续研究中可以更深入地探索成分之间的作用关系,以研究五味子标准汤剂的抗氧化作用机制。本研究为评价五味子标准汤剂的质量指标、抗氧化的药效基础及作用机制提供新思路。

