温肾通络止痛方抑制巨噬细胞衰老改善BMSC成骨分化和老年性骨质疏松模型小鼠骨丢失的研究
张天驰,李沐哲,牛园园,郭杨,3,王礼宁,3,田霖坤,王遇珩,王泉荃,马勇,3
(1.南京中医药大学第一临床医学院,骨伤修复与重建新技术实验室,江苏 南京 210023;2.南京中医药大学附属医院,江苏 南京 210029;3.南京中医药大学无锡附属医院,江苏省中医退行性骨关节病临床医学创新中心,江苏 无锡 214071)
老年性骨质疏松症(Senile osteoporosis,SOP)是一种与年龄相关的代谢性骨疾病,以进行性骨量丢失、骨微结构恶化和骨脆性增加为特征,通常发生在65岁以上的人群中[1]。巨噬细胞是骨组织中最丰富、最活跃的免疫细胞之一。在骨髓微环境中,它们与骨髓间充质干细胞(Bone marrow mesenchymal stromal cell,BMSC)、成骨细胞和破骨细胞相互作用,在维持骨稳态中起着至关重要的作用。而在衰老的骨髓微环境中,衰老细胞产生衰老相关分泌表型(Senescence associated secretory phenotypes,SASPs),诱导巨噬细胞衰老并向M1型极化[2]。同时,衰老的巨噬细胞会分泌肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)和白细胞介素-1β(Interleukin-1β,IL-1β)等细胞因子,造成成骨细胞和破骨细胞之间的失衡,加剧了年龄相关的骨质流失[2-3]。因此,在治疗SOP方面,调控衰老巨噬细胞、改善骨髓微环境以促进BMSC成骨分化可能是一种新方法。
马勇教授认为SOP主要病机为肾精亏虚,脾虚肝郁,骨髓失养,故治疗SOP当以补益脾肾、调和脏腑、强筋健骨之法。以此构建的经验方温肾通络止痛方疗效确切(处方已申请国家发明专利,公布号:CN107823493A),能有效提高SOP患者骨密度,改善疼痛、腰膝酸软、步履艰难等症状[3-4],并且可在炎症微环境下通过核因子κB(Nuclear factor-kappa B,NF-κB)信号通路,调控巨噬细胞极化,抑制破骨细胞活性[5]。而在衰老微环境下,温肾通络止痛方能否通过延缓巨噬细胞衰老,对成骨分化产生影响仍然有待进一步的探索。因此,本研究拟利用过氧化氢(H2O2)建立巨噬细胞衰老模型,并通过D-半乳糖构建SOP小鼠模型,探讨温肾通络止痛方能否通过抑制巨噬细胞衰老促进BMSC成骨分化从而发挥抗骨质疏松效应。
1 方法
1.1 试剂
H-DMEM培养基(Cytiva,批号:SH30022.FS);DMEM/F12培养基(Cytiva,批号:SH30023.01);L-DMEM培养基(Cytiva,批号:SH30021.01);青霉素-链霉素(100×)(新赛美,批号:C100C5);胰蛋白酶消化液(新赛美,批号:C100C1);p21抗体(武汉三鹰,批号:28248-1-AP);p53抗体(武汉三鹰,批号:60283-2-Ig);Runt相关转录因子2(Runt-related transcription factor 2,Runx2)抗体(武汉三鹰,批号:82636-2-RR);骨钙蛋白(Osteocalcin,OCN)抗体(Santa Cruz,批号:sc-390877);GAPDH抗体(Affinity,批号:AF7021);HRP偶联羊抗兔二抗抗体(武汉三鹰,批号:SA00001-2);HRP偶联羊抗小鼠二抗抗体(武汉三鹰,批号:SA00001-1);iNOS抗体(武汉三鹰,批号:80517-1-RR);ARG1抗体(武汉三鹰,批号:16001-1-AP);CoraLite488-conjugated Goat Anti-Rabbit IgG(武汉三鹰,批号:SA00013-2);CoraLite594-conjugated Goat Anti-Rabbit IgG(武汉三鹰,批号:SA00013-4);苏木素-伊红(Hematoxylin-eosin,HE)染液(南京建成生物工程研究所,批号:D006-1-1);切片石蜡、脱钙液、4%多聚甲醛(索莱宝,批号:8002-74-2、E1171、P1112);活性氧(Reactive oxygen species,ROS)检测试剂盒、细胞衰老β-半乳糖苷酶染色试剂盒、成骨细胞矿化结节染色试剂盒、碱性磷酸酶(Alkaline phosphatase,ALP)试剂盒、线粒体膜电位检测试剂盒(JC-1)、CCK-8试剂盒、免疫荧光染色试剂盒、免疫染色通透液、免疫染色封闭液(碧云天,批号:S0033S、C0602、C0148S、C3206、C2006、C0037、P0186、P0096、P260);地塞米松、β-磷酸甘油磷酸钠、维生素C(Sigma,批号:265005、G9422、BP461);总RNA提取试剂盒、逆转录试剂盒、实时荧光定量聚合酶链式反应(qPCR)试剂盒(南京诺唯赞生物科技有限公司,批号:RC101-01、R223-01、Q711-02)。
1.2 仪器
Allsheng型全自动多功能酶标仪(杭州奥盛仪器有限公司);BB16/BB5060型CO2培养箱(德国Heraus公司);CKX31型倒置相差显微镜(日本Olympus公司);Mini Trans-blot cell型电转印槽系列(美国Bio-Rad公司);1176型小动物Micro-CT测试仪(比利时Skyscan公司)。
1.3 细胞和实验动物
小鼠单核巨噬细胞RAW264.7(武汉普诺赛,货号:CL-0190)。3月龄的雄性C57BL/6J小鼠[体质量(30±5)g]和8周龄SD大鼠[体质量(180±20)g]购自浙江杭州医学院,实验动物许可证号:SCXK(浙)2019-0002。动物实验已获得南京中医药大学实验动物伦理委员会的批准(202211A035),并遵循《实验动物护理和使用指南》。
1.4 温肾通络止痛方药液制备
温肾通络止痛方组成:山茱萸10 g,骨碎补30 g,淫羊藿10 g,蛇床子6 g,狗脊10 g,薏苡仁15 g,附子8 g,炙黄芪15 g,炒白术10 g,羌活10 g,独活10 g,细辛3 g,天麻6 g,白芍15 g,炙甘草6 g。实验使用的中药均购自江苏省中医院。称取处方药材,加10倍水量煎煮1 h,二煎采用8倍量的水煎煮1 h,2次提取的药液合并后过滤,滤液浓缩至每1 mL含1.25 g生药,4 ℃保存备用。
1.5 含药血清制备
40只8周龄SD大鼠采用随机数字表法分为空白血清组(20只)、温肾通络止痛方含药血清组(20只),适应性喂养后,据《药理学实验方法》中临床常用量按实验动物与人体表面积折算出给药组温肾通络止痛方剂量为21 g·kg-1,空白组给予等量生理盐水,每日1次,连续7 d。末次给药1 h后麻醉,腹主动脉取血,室温静置2 h后分离血清,4 ℃、3 500 r·min-1离心15 min,吸取上层血清,0.22 μm滤膜过滤,-80 ℃保存备用。
1.6 细胞培养
RAW264.7细胞采用含体积分数10%胎牛血清的DMEM高糖培养基在37 ℃、体积分数5%CO2细胞培养箱中培养。细胞生长至培养瓶底面积的80%~90%时,每2 d按照1∶3传代。
采用文献报道的方法获取原代小鼠BMSC[6]。2月龄C57BL/6小鼠麻醉后脱颈处死,剥离胫骨和股骨,无血清DMEM/F12培养基冲洗骨髓腔,离心后弃去上清,用含体积分数为10%胎牛血清、1%青霉素-链霉素的DMEM/F12培养基重悬后,放于37 ℃、体积分数5%CO2细胞培养箱中培养,48 h后半量换液,之后每隔2 d全量换液1次,细胞生长融合至80%~90%时,按照1∶2传代,取第3代细胞用于后续实验。
1.7 实验分组和干预
1.7.1 巨噬细胞衰老模型建立 RAW264.7细胞分别加入含有100、200、300、400 μmol·L-1H2O2的培养基3 h后,换无H2O2培养基继续培养48 h,β-半乳糖苷酶染色检测巨噬细胞衰老水平,CCK-8法检测巨噬细胞活性,从而筛选最佳的H2O2诱导浓度。
1.7.2 含药血清对巨噬细胞衰老、线粒体功能、极化的影响 将RAW264.7细胞随机分为对照组、模型组、含药血清低剂量组、含药血清高剂量组。除对照组外,其余3组均加入H2O2(30 μmol·L-1)以诱导巨噬细胞衰老,3 h后对照组和模型组换成含有空白血清的培养基,含药血清低、高剂量组分别换成含有低剂量含药血清(20%温肾通络止痛方含药血清+80%空白血清)和高剂量含药血清(40%温肾通络止痛方含药血清+60%空白血清)的培养基,继续培养48 h后,对细胞进行β-半乳糖苷酶染色,Western blot、qPCR检测衰老指标p21和p53的mRNA及蛋白表达,探讨含药血清对巨噬细胞衰老的影响。ROS染色和JC-1染色检测巨噬细胞线粒体功能。qPCR检测巨噬细胞极化相关因子IL-6、IL-10、CD206、iNOS mRNA水平,免疫荧光检测巨噬细胞极化相关因子ARG1和iNOS的蛋白表达,评估含药血清对巨噬细胞极化的影响。
1.7.3 含药血清处理的巨噬细胞条件培养基对BMSC成骨分化的影响 取各组巨噬细胞上清液,制备条件培养基(CM),BMSC细胞随机分为对照组-CM、模型组-CM、含药血清低剂量组-CM、含药血清高剂量组-CM。取BMSC接种于12孔板中,调整细胞密度约为每孔2×104个,使用成骨诱导液(L-DMEM完全培养基+50 μg·mL-1维生素C+10 mmol·L-1β-甘油磷酸钠+8~10 mol·L-1地塞米松)和条件培养基进行诱导,2者体积比为1∶1,隔天换液,诱导7 d后进行qPCR检测成骨指标OCN、Ⅰ型胶原蛋白(Collagen type Ⅰ alpha 1,Col1a1)、Runx2 mRNA表达水平,并用ALP试剂盒进行染色实验。诱导21 d后进行茜素红染色实验。
1.7.4 温肾通络止痛方对D-半乳糖诱导的SOP小鼠模型的影响 将40只3月龄雄性C57BL/6J小鼠按照数字表法随机分为对照组、模型组、复方(温肾通络止痛方)低剂量组、复方(温肾通络止痛方)高剂量组,每组10只。每天腹腔注射D-半乳糖(1 g·kg-1),共6周。6周后,按照人与小鼠体表面积换算法,算出温肾通络止痛方低、高剂量组小鼠每日灌胃给予温肾通络止痛方汤剂21、42 g·kg-1,温肾通络止痛方溶液用生理盐水稀释成所需浓度,给药体积为1 mL·kg-1,对照组及模型组灌胃给予等体积生理盐水。给药8周后,小鼠禁食12 h,腹腔注射戊巴比妥钠(50 mg·kg-1)麻醉后,摘除眼球取血,采血结束后处死小鼠,剥离小鼠股骨、胫骨,一部分放置于-80 ℃保存,一部分放置于4%多聚甲醛中保存。Micro-CT分析小鼠股骨的骨微结构,HE染色检测小鼠股骨病理变化,Western blot、qPCR检测小鼠胫骨衰老相关分子p21、p53和成骨相关指标OCN、Runx2蛋白和mRNA表达水平,qPCR检查巨噬细胞极化相关分子IL-6、iNOS、CD206、IL-10 mRNA的表达水平,评估温肾通络止痛方对小鼠SOP模型的影响。
1.8 检测指标
1.8.1 细胞活性检测 将RAW264.7接种于96孔板,每孔加入10 μL CCK-8溶液,继续孵育2 h后,检测450 nm处的吸光度值。
1.8.2 β-半乳糖苷酶染色 将RAW264.7细胞室温固定15 min,加入1 mL X-Gal染色工作液,37 ℃无CO2条件下孵育6 h,显微镜下观察。
1.8.3 免疫荧光检测 将RAW264.7细胞室温固定15 min,用免疫染色通透液(Triton X-100)处理20 min,免疫染色封闭液封闭30 min,按1∶100稀释iNOS和ARG1一抗,4 ℃孵育过夜,按1∶1 000稀释二抗与DAPI共同孵育30 min,加入抗荧光淬灭剂封固,倒置荧光显微镜采集图像。
1.8.4 qPCR检测 使用RNA提取试剂盒从各组胫骨、RAW264.7细胞、BMSC中提取总RNA并合成cDNA。使用SYBR Green染料法进行qPCR分析。最后,使用GAPDH作为内参基因对qPCR反应进行标准化,采用2-ΔΔCt法计算p21、p53、IL-6、IL-10、CD206、iNOS、OCN、Col1a1、Runx2 mRNA的表达。引物序列见表1。

表1 qPCR引物序列Table 1 qPCR Primer sequence
1.8.5 Western blot检查 取于干预后的巨噬细胞及-80 ℃保存的胫骨,胫骨样本经液氮研磨后,使用RIPA裂解液提取组织总蛋白,并经过BCA法进行定量。将蛋白稀释为同一浓度,加入上样缓冲液,混匀后沸水煮10 min,冷却后进行SDS-PAGE凝胶电泳,使用PVDF膜进行400 mA 30 min的转膜,接着在室温下使用5%的脱脂奶粉进行2 h的封闭处理。随后,按抗体说明书配制一抗:p21(1∶1 000)、p53(1∶1 000)、GAPDH(1∶10 000)、Runx2(1∶1 000)、OCN(1∶100),并在4 ℃下孵育过夜,接着根据一抗种类使用合适的二抗在室温下孵育2 h。最后,滴加ECL化学发光液,使用凝胶成像系统检测目标蛋白的信号强度,并利用Image J软件进行条带灰度值的测定。
1.8.6 ROS染色 RAW264.7细胞中加入10 μmol·L-1Hydroethidine探针,室温中孵育30 min,PBS清洗3遍后,荧光显微镜下观察,Hydroethidine探针与细胞中ROS结合发出红色荧光。
1.8.7 JC-1染色 PBS洗涤RAW264.7细胞1次,加入0.5 mL细胞培养液,再加入0.5 mL JC-1染色工作液,充分混匀。细胞培养箱中37 ℃孵育20 min。37 ℃孵育结束后,吸除上清,用JC-1染色缓冲液(1×)洗涤2次,加入1 mL细胞培养液,荧光显微镜下通过荧光通道FL1(绿)和FL2(红)检测分别拍照。
1.8.8 ALP染色 将BMSC细胞用4%多聚甲醛室温固定30 min,PBS清洗3遍,按碱性磷酸酶染色试剂盒配置工作液,室温染色30min,PBS冲洗3遍,倒置相差显微镜观察采集图像。
1.8.9 茜素红染色 将BMSC细胞用4%多聚甲醛室温固定30 min,PBS清洗2遍,换成茜素红染液室温染色5 min,PBS冲洗3遍,倒置相差显微镜观察采集图像。
1.8.10 Micro-CT检测 每组随机选取6只小鼠的右侧股骨组织,去除股骨周围的软组织,用4%多聚甲醛固定48 h后,保存在70%乙醇溶液中,使用Micro-CT影像系统对股骨远端进行扫描,分析骨密度(Bone mineral density,BMD)、骨体积分数(Bone volume/tissue volume,BV/TV)、骨小梁数量(Trabecular number,Tb.N)和骨小梁分离度(Trabecular thickness trabecular separation,Tb.Sp)。
1.8.11 HE染色 分离小鼠股骨组织,在4%多聚甲醛中充分固定24 h,EDTA脱钙液脱钙1个月。脱钙后进行组织脱水、浸蜡、包埋等,制作石蜡切片。切片经脱蜡、苏木精-伊红染色、脱水、透明、封片等步骤后在显微镜下拍照采集图像。
1.9 统计学方法

2 结果
2.1 巨噬细胞衰老模型的制备
β-半乳糖苷酶染色结果显示,与对照组相比,H2O2组可以见到大量绿色的衰老阳性细胞。CCK-8结果显示,与对照组相比,300、400 μmol·L-1H2O2均可显著降低细胞活力(P<0.05,P<0.001)。但H2O2为400 μmol·L-1时细胞活力较低,细胞大量死亡,因此后续的实验采用300 μmol·L-1的H2O2来建立细胞衰老模型(图1)。

注:A.β-半乳糖苷酶染色检测造模后巨噬细胞衰老情况,红色三角形指示绿色的衰老阳性细胞;B.CCK-8检测造模后巨噬细胞的细胞活力;与对照组比较,
2.2 含药血清对巨噬细胞衰老的影响
β-半乳糖苷酶活性染色结果显示,与对照组相比,模型组可见大量的绿色衰老阳性细胞;与模型组相比,含药血清组衰老阳性细胞数量明显减少(图2A)。qPCR与Western blot实验结果显示,与对照组相比,模型组衰老相关基因p21和p53的mRNA及蛋白表达水平均明显升高(P<0.05,P<0.01,P<0.001),高剂量含药血清干预后,p21和p53 mRNA及蛋白表达显著降低(P<0.05,P<0.01,P<0.001)(图2B~C)。

注:A.β-半乳糖苷酶染色检测含药血清给药后巨噬细胞衰老情况,红色三角形指示绿色的衰老阳性细胞;B.qPCR检测含药血清干预后巨噬细胞p21、p53 mRNA的表达;C.Western blot检测含药血清干预后巨噬细胞p21、p53蛋白的表达;与模型组比较,
2.3 含药血清对衰老巨噬细胞线粒体功能的影响
免疫荧光结果显示,H2O2可刺激RAW264.7细胞中ROS产生(P<0.001),而含药血清可降低ROS的产生(P<0.05,P<0.001)(图3A)。为了确定功能失调线粒体的减少是否为ROS减少的原因,使用JC-1标记来测量线粒体膜电位。免疫荧光分析结果表明,高剂量含药血清处理后降低了JC-1绿色荧光的强度,而增加了JC-1红色荧光的强度(P<0.05),表明线粒体膜电位在含药血清处理后变得稳定(图3B)。
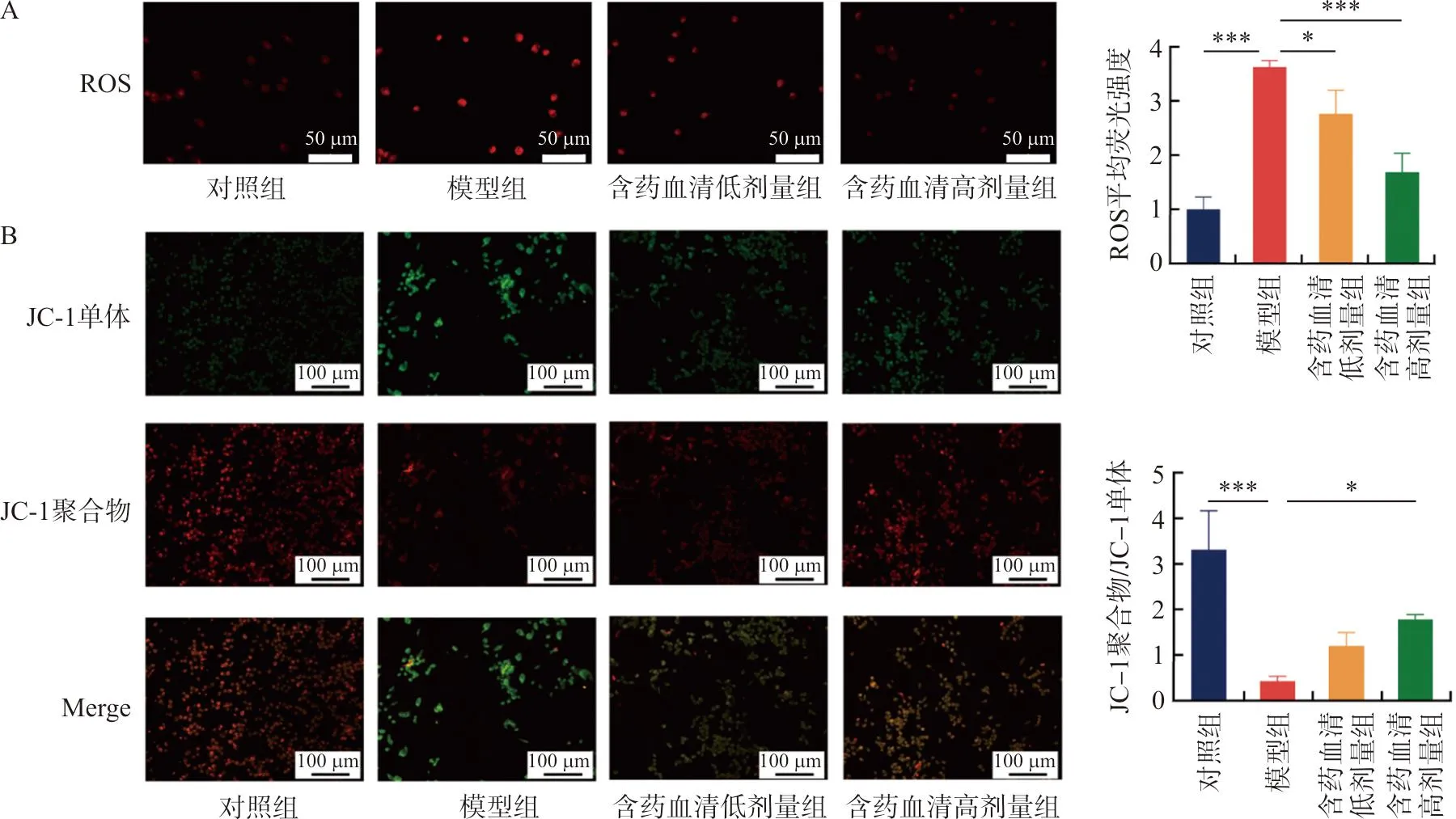
注:A.ROS染色检测含药血清给药后衰老巨噬细胞ROS水平;B.JC-1检测含药血清给药后衰老巨噬细胞线粒体功能;与模型组比较,
2.4 含药血清对衰老巨噬细胞极化的影响
qPCR结果显示,与对照组比较,模型组M1型相关基因iNOS显著升高(P<0.01);高剂量含药血清干预后,巨噬细胞iNOS的mRNA表达水平显著降低(P<0.01),M2型相关基因CD163和CD206表达水平升高(P<0.05)。免疫荧光结果显示,与对照组相比,模型组中的iNOS荧光强度显著增加(P<0.001);而与模型组相比,高剂量含药血清可显著降低iNOS荧光强度(P<0.01),增加M2型相关蛋白ARG1的荧光强度(P<0.05)(图4)。

注:A.qPCR检测含药血清干预后巨噬细胞iNOS、CD206、CD163 mRNA的表达水平;B.免疫荧光检测含药血清给药后衰老巨噬细胞iNOS与ARG1的表达水平;与模型组比较,
2.5 含药血清处理的巨噬细胞条件培养基对BMSC成骨分化的影响
ALP染色、茜素红染色结果显示,模型组-CM中ALP阳性细胞数、茜素红阳性区域显著少于对照组(P<0.01,P<0.001),含药血清干预之后,ALP阳性细胞数、茜素红阳性区域显著增多和变大(P<0.05,P<0.01,P<0.001),说明BMSC成骨分化增强。qPCR结果显示,与对照组-CM相比,模型组-CM中成骨相关基因Runx2 mRNA表达降低(P<0.05),高剂量含药血清-CM干预后,Col1a1、Runx2 mRNA表达水平升高(P<0.05,P<0.01)(图5)。
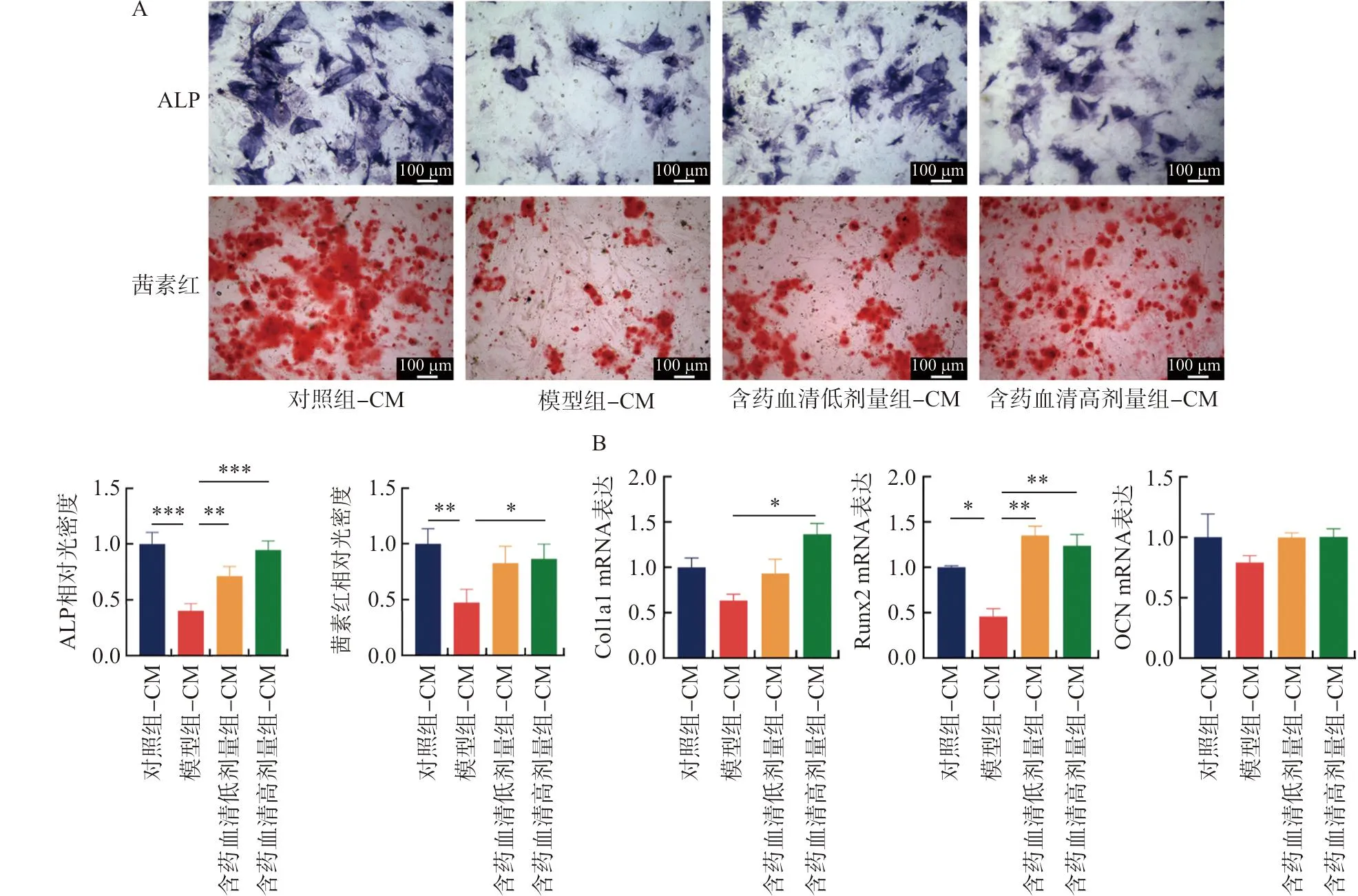
注:A.ALP染色、茜素红染色检测含药血清处理的巨噬细胞条件培养基对BMSC成骨的影响;B.qPCR检测含药血清处理的巨噬细胞条件培养基对BMSC成骨相关基因Col1a1、Runx2和OCN mRNA表达;与模型组-CM比较,
2.6 温肾通络止痛方对小鼠股骨骨微结构的影响
Micro-CT结果显示,与对照组比较,模型组小鼠股骨组织中BMD、BV/TV、Tb.N均显著降低(P<0.01,P<0.001,P<0.000 1),Tb.Sp升高(P<0.001);与模型组比较,复方高剂量组BMD、BV/TV、Tb.N均显著增加(P<0.05,P<0.01,P<0.001),Tb.Sp显著降低(P<0.05)(图6)。
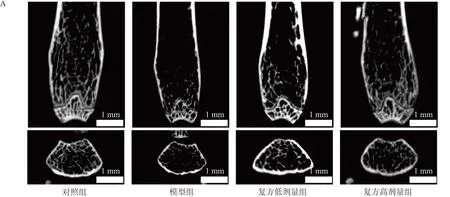
注:A.Micro-CT检测各组小鼠股骨微结构;B.各组小鼠BMD、Tb.Sp、BV/TV、Tb.N比较。与模型组比较,
2.7 温肾通络止痛方对小鼠股骨病理变化的影响
HE染色结果显示,与对照组比较,模型组小鼠骨小梁数量减少,间隙增宽变细多断裂;温肾通络止痛方干预后,骨小梁明显改善,数量增多变宽,骨小梁连续性增加,且骨小梁状况随剂量增大改善明显(图7)。

图7 温肾通络止痛方对小鼠股骨病理变化的影响Fig.7 Effect of Wenshen Tongluo Zhitong Recipe on pathological changes of femur in mice
2.8 温肾通络止痛方对小鼠胫骨衰老和巨噬细胞极化相关基因的影响
qPCR结果显示,与对照组相比,模型组胫骨衰老相关因子p21和p53 mRNA和蛋白显著升高(P<0.01,P<0.000 1),成骨相关指标OCN、Runx2蛋白表达显著下降(P<0.01,P<0.000 1),高剂量温肾通络止痛方干预后,p21和p53 mRNA和蛋白降低(P<0.05,P<0.001,P<0.000 1),成骨相关指标OCN、Runx2蛋白表达上升(P<0.01,P<0.000 1)。与对照组比较,模型组M1型相关基因IL-6,iNOS mRNA显著升高(P<0.01);高剂量温肾通络止痛方干预后iNOS mRNA降低(P<0.05),IL-10和CD206 mRNA表达水平升高(P<0.01)。详见图8。

注:A.qPCR检测温肾通络止痛方干预后小鼠胫骨p21、p53 mRNA的表达水平;B.qPCR检测温肾通络止痛方干预后小鼠胫骨IL-6、iNOS、IL-10和CD206 mRNA的表达水平;C.Western blot检测温肾通络止痛方干预后小鼠胫骨p21、p53、OCN和Runx2蛋白的表达水平;与模型组比较,
3 讨论
随着我国人口老龄化的加剧,SOP的问题受到越来越多的重视。目前,我国65岁以上人群SOP发病率已达32%[7]。中医药对SOP的治疗具有疗效好、毒副作用小、治疗成本低廉等优点。中医学认为SOP为本虚标实之证。根据藏象学说理论,本课题组将该病的病机归纳为肾精亏虚,脾虚肝郁,骨髓失养,故以补益脾胃、调和脏腑、强筋健骨之法构建了温肾通络止痛方。方中黄芪、附子主一身阳气,鼓舞肾阳;骨碎补、蛇床子、狗脊、淫羊藿、山茱萸温补肾阳,充养骨髓;狗脊、淫羊藿兼可祛风除湿;薏苡仁、白术、白芍益气健脾疏肝;羌活、细辛、独活、天麻散寒通络止痛;炙甘草调和诸药,全方共奏补益脾肾、调和脏腑、强筋健骨之效。
中医学对免疫的认识由来已久,《素问·四气调神大论》便记载:“是故圣人不治已病治未病,不治已乱治未乱”[8]4。《素问·刺法论》中也记载:“正气存内,邪不可干,邪之所凑,其气必虚”[8]164。正气代表了人体防御、抵抗病邪的能力。而随着年龄的增长、机体的衰老,脏腑功能失调,人体正气渐虚而免疫力下降。正气的产生与运行有赖于肝脾肾三脏。正气依赖于肾中精气所化生。《素问·上古天真论》指出:“丈夫八岁,肾气实,发长齿更……八八,天癸竭,精少,肾脏衰,形体皆极,则齿发去”[8]2。由此可见,伴随着年龄的增长,肾之藏精与纳气功能不足,导致免疫功能的下降。温肾通络止痛方中主温补肾阳淫羊藿被证实能够提升机体的免疫能力[9]。正气靠脾胃后天水谷之精气充养,故张仲景提出“四季脾旺不受邪”[10]1。随着年龄的增长,脾胃运化功能下降,正气亏虚,恰符合李东垣指出的“百病皆由脾胃衰而生也”[11]7,可见,脾虚与免疫力下降密切相关。本方中白芍具有柔肝之功,对免疫系统的正向调节作用已被证实[12]。正气对于机体的作用有赖于肝之疏泄。随着机体的衰老,肾精亏虚,水不涵木,肝气郁滞,正气则难以发挥其功能,故而肝气郁滞是机体免疫功能下降的重要因素。本方中细辛对细胞衰老的正向调节作用已被证实[13]。因此,温肾通络止痛方可通过调节脏腑平衡,影响免疫衰老,从而发挥抗骨质疏松效应。
SOP的发生与衰老密切相关,抑制衰老可以延缓疾病的进程或减轻其严重程度[14]。巨噬细胞具有调节组织修复、再生的能力,在骨稳态中发挥着至关重要的作用。伴随着机体的衰老,巨噬细胞也会表现出细胞衰老样特征,如线粒体膜电位降低,引起线粒体功能障碍,以及细胞衰老的标志物p21和p53表达升高等[15-16]。同时,衰老的巨噬细胞倾向于向M1型分化,并分泌SASPs,使机体处于长期的炎症状态[17-19]。H2O2能够通过其氧化作用诱导体外细胞衰老[20]。本研究中,H2O2可以增加β-糖苷酶阳性巨噬细胞的数量,使巨噬细胞衰老标志物p21和p53的mRNA及蛋白表达均明显升高,并使其M1型相关基因iNOS的mRNA显著升高,促进巨噬细胞向M1极化。同时,H2O2还可以使巨噬细胞内ROS不断累积,线粒体膜电位降低,引起线粒体功能障碍。而含药血清降低了巨噬细胞衰老标志物p21和p53的mRNA及蛋白的表达;减少了ROS的产生;降低了JC-1绿色荧光的强度,增加了JC-1红色荧光的强度。提示含药血清可以在一定程度上改善线粒体的功能,改善巨噬细胞的衰老。D-半乳糖是一种活性氧促进剂,广泛应用于衰老动物模型的建立[16]。本研究观察到通过D-半乳糖建立的SOP小鼠胫骨中衰老标记物p21和p53表达明显增高,温肾通络止痛方明显下调上述分子的mRNA及蛋白表达水平,由此可见,温肾通络止痛方在一定程度上可以改善SOP小鼠模型股骨的老化现象。同时,通过比较模型组与复方组小鼠胫骨中巨噬细胞极化相关基因,发现温肾通络止痛方可显著促进胫骨中巨噬细胞IL-10和CD206 mRNA的表达,促进胫骨中巨噬细胞向M2极化。根据以上分析,温肾通络止痛方可改善骨微环境中的巨噬细胞衰老与分化。
巨噬细胞和BMSC之间的相互作用对于维持骨稳态至关重要。根据微环境中的信号分子,巨噬细胞可以被极化为M1或M2状态[21]。Song和Wu等发现M1型巨噬细胞可通过分泌外泌体抑制BMSCs的成骨分化[22-23]。此外,Assoian等报道,M2型巨噬细胞产生大量成骨生长因子驱动BMSC向成骨细胞转化[24-25]。近期有文章报道,在免疫衰老的过程中,衰老的巨噬细胞积累和分泌大量的钙颗粒蛋白进入骨髓,不仅抑制BMSC的成骨分化,也刺激其成脂分化,最终加速骨老化[26]。我们的研究结果表明,与H2O2处理的巨噬细胞条件培养基组相比,含药血清处理的巨噬细胞条件培养基能显著升高钙沉积和ALP阳性表达,并促进成骨相关基因Runx2和Col1a1 mRNA表达。此外,温肾通络止痛方能显著增加D半乳糖诱导的衰老小鼠股骨Tb.N、BMD、BV/TV等骨微结构,并改善骨小梁数量及宽度,还可以促进成骨相关指标OCN、Runx2蛋白表达。根据以上分析,温肾通络止痛方可通过改善骨微环境中的巨噬细胞衰老与极化,进而促进BMSC成骨分化,从而减少骨质的流失。
综上所述,我们在中医理论的指导下,从衰老巨噬细胞-BMSC成骨分化的角度出发,进行了初步探索,发现温肾通络止痛方可能通过缓解巨噬细胞衰老,改变巨噬细胞M1/M2极化表型,促进BMSC成骨分化,维持骨稳态。由此得出,骨髓微环境对于骨重塑至关重要,调控骨髓衰老微环境可以作为未来抗骨质疏松的有效手段。但是,本实验仍有不足,在衰老骨髓微环境中,衰老巨噬细胞与BMSC之间的通讯机制没有明确,可通过测序分析进一步挖掘。

