裸藻β-1,3-葡聚糖对断奶仔猪生长性能、血清炎症细胞因子含量及肠道菌群结构的影响
杨馥嘉 陈 静* 刘显军* 李海东 葛冬冬 曲盛卿 刘景军
(1.沈阳农业大学动物科学与医学学院,沈阳 110866;2.沈阳博睿农牧科技有限公司,沈阳 110300;3.山东纳美达生物科技有限公司,济南 250100)
葡聚糖是一种多糖物质,存在于某些微生物生长过程中分泌的黏液中,可分为α-葡聚糖和β-葡聚糖,其中β-葡聚糖最具生理活性。自从在面包酵母里分离出β-葡聚糖以来,β-葡聚糖生物活性特别是免疫调节活性为人们所重视,因此β-葡聚糖亦被称作生物反应调节剂[1]。随着抗生素的禁用,开发安全、有效、绿色的新型抗生素替代品的呼声越来越高[2]。研究表明,β-葡聚糖能促进动物生长,提高免疫功能,增强机体抵抗力,因而成为替抗物之一[3-4]。β-葡聚糖来源广泛,主要存在于真菌、藻类、植物和某些细菌的细胞壁中[5]。近些年的研究表明,藻类来源的β-葡聚糖(裸藻β-1,3-葡聚糖)在增强动物的免疫功能和肠道健康[6-7]、提高抗应激性能[8]和生长性能方面更具有优势[9]。作为一种安全有效的天然免疫系统反应辅助因子,裸藻β-1,3-葡聚糖可能是通过炎性因子来调节机体的免疫反应[10]。有研究表明,饲粮中添加2%的裸藻β-1,3-葡聚糖可有效增强小鼠抗病能力,显著提高体内细胞因子水平[11]。感染大肠杆菌后的小鼠,通过饲喂裸藻β-1,3-葡聚糖(1%),抗体、促炎因子、自然杀伤细胞水平均有所增加,该试验利用酵母β-1,3-葡聚糖作对照,结果表明,裸藻β-1,3-葡聚糖调节免疫能力高于酵母β-1,3-葡聚糖[12]。饲粮中添加5%的裸藻β-1,3-葡聚糖可降低大鼠肾小球硬化,促炎症细胞因子基因的表达被抑制,减少尿毒症毒素的形成[13]。酵母葡聚糖含有特殊的生物因子,具有抗肿瘤、消炎保健、增强免疫功能等作用,同样可作为免疫调节剂,这主要是因为其含有β-葡聚糖[14]。
饲用抗生素能促进动物生长,防治动物腹泻,但同时也引起药物残留、细菌耐药性等负面问题,对动物、人和生态环境造成严重危害。然而,饲料中禁用抗生素后,动物生长性能显著下降,病死率显著升高,严重影响畜牧业的健康发展。因此,研发安全、高效、绿色的新型饲用抗生素替代产品已迫在眉睫[2]。葡聚糖可以与动物机体中相关模式受体结合从而诱导免疫系统的活化增强动物机体免疫力,使葡聚糖替代抗生素成为可能。因此,本试验旨在研究裸藻β-1,3-葡聚糖、酵母β-1,3-葡聚糖对仔猪生长性能、血清炎症细胞因子含量及肠道菌群结构的影响,为揭示裸藻β-1,3-葡聚糖的促生长、增强免疫力机制提供参考依据。
1 材料与方法
1.1 试验材料
裸藻β-1,3-葡聚糖:具有高比例的β-(1,3)糖苷键,主要成分β-1,3-葡聚糖含量>70%。
酵母β-1,3-葡聚糖:天然存在酵母细胞壁中的免疫活性多糖,主要成分β-1,3-葡聚糖含量>70%。
基础饲粮参照《猪营养需要》(GB/T 39235—2020)配制,其组成及营养水平见表1。饲粮中粗蛋白质、粗脂肪等营养物质含量参照《饲料分析及饲料质量检测技术》测定。

表1 基础饲粮组成及营养水平(干物质基础)
1.2 试验设计及饲养管理
采用单因素完全随机试验设计,选取150头40日龄左右、体重[(13.06±0.26) kg]相近的“杜洛克×长白×大白猪”三元杂断奶仔猪,随机分为5个组,每组5个重复,每个重复6头猪。对照组饲喂基础饲粮,50 mg/kg裸藻组饲喂基础饲粮+50 mg/kg裸藻β-1,3-葡聚糖,100 mg/kg裸藻组饲喂基础饲粮+100 mg/kg裸藻β-1,3-葡聚糖,150 mg/kg裸藻组饲喂基础饲粮+150 mg/kg裸藻β-1,3-葡聚糖,100 mg/kg酵母组饲喂基础饲粮+100 mg/kg酵母β-1,3-葡聚糖。预试期3 d,正试期28 d。
试验在沈阳博睿农牧科技有限公司科研猪场进行,严格遵循断奶仔猪的日常饲养管理。仔猪每天饲喂4次(08:00、12:00、16:00和20:00)。猪舍的温度控制在24~26 ℃,相对湿度控制在60%~70%。定期清洁房间,保持通风、清洁、干燥和卫生。试验期间,各组均不使用抗生素,每天对试验猪的采食量进行详细记录,观察试验猪,每日记录所需信息。
1.3 样品采集
粪样:试验第28天,仔猪空腹,收集其粪便,液氮保存,待测肠道菌群结构。
血样:试验第28天,仔猪空腹,前腔静脉采血10 mL,3 500 r/min离心10 min,分离血清,-20 ℃保存,待测血清炎症细胞因子含量。
1.4 指标测定
1.4.1 生长性能
以重复为单位准确记录每天给料量和残余料量,计算每天每重复的采食量,于试验开始的第1、28天08:00对试猪空腹称重,统计平均日采食量、平均日增重和料重比,计算公式如下:
平均日增重=(终末体重-初始体重)/试验天数;平均日采食量=总采食量/试验天数×头数;料重比=总采食量/(终末体重-初始体重)。
1.4.2 血清炎症细胞因子含量
血清白细胞介素-1(IL-1)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)含量采用试剂盒(南京建成生物工程研究所)测定,测定方法严格按照试剂盒说明书进行操作。
1.4.3 肠道菌群结构
正试期结束后,在各组中随机选取3只仔猪,从直肠获取鲜粪样本(3~5 g),置于无菌的Ep管,放置冻存管中并标记后,液氮速冻,-80 ℃保存,随后运送到上海派森诺公司进行肠道微生物16S rRNA的V3、V4区宏基因组分类测序,引物序列为正向:5′-ACTCCTACGGGAGGCAGCA-3′;反向:5′-GGACTACHVGGGTWTCTAAT-3′,采用Illumina平台对群落DNA片段进行双端(paired-end)测序。测序原始数据以FASTO格式保存,切除序列的引物片段,弃去未匹配引物的序列,然后调用DADA2进行质控、去噪、拼接、去嵌合体。在97%相似度水平对高质量序列聚类,分别输出代表序列和操作分类单元(OTU)表。使用Rdp FrameBot软件,对核酸序列中的插入和缺失错误进行纠正,获得校正的核酸序列和蛋白质序列。利用QIIME2(2019.4)软件与参考序列数据库进行比对。利用QIIME2(2019.4)软件计算样本Alpha多样性指数、Beta多样性、菌群组成及菌群差异分析。
1.5 数据统计分析
应用SPSS 26.0软件进行统计分析。分析前进行方差齐性检验。数据统计分析采用单因素方差分析(one-way ANOVA)和Duncan氏法多重比较。结果用平均值±标准差表示,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 裸藻β-1,3-葡聚糖对断奶仔猪生长性能的影响
由表2可知,与对照组相比,50 mg/kg裸藻组的终末体重、平均日采食量、平均日增重和料重比均显著升高(P<0.05);100 mg/kg裸藻组的终末体重、平均日采食量和平均日增重均显著升高(P<0.05),料重比显著降低(P<0.05);150 mg/kg裸藻组的终末体重和料重比均显著升高(P<0.05);100 mg/kg酵母组的终末体重、平均日采食量、平均日增重和料重比均显著升高(P<0.05)。
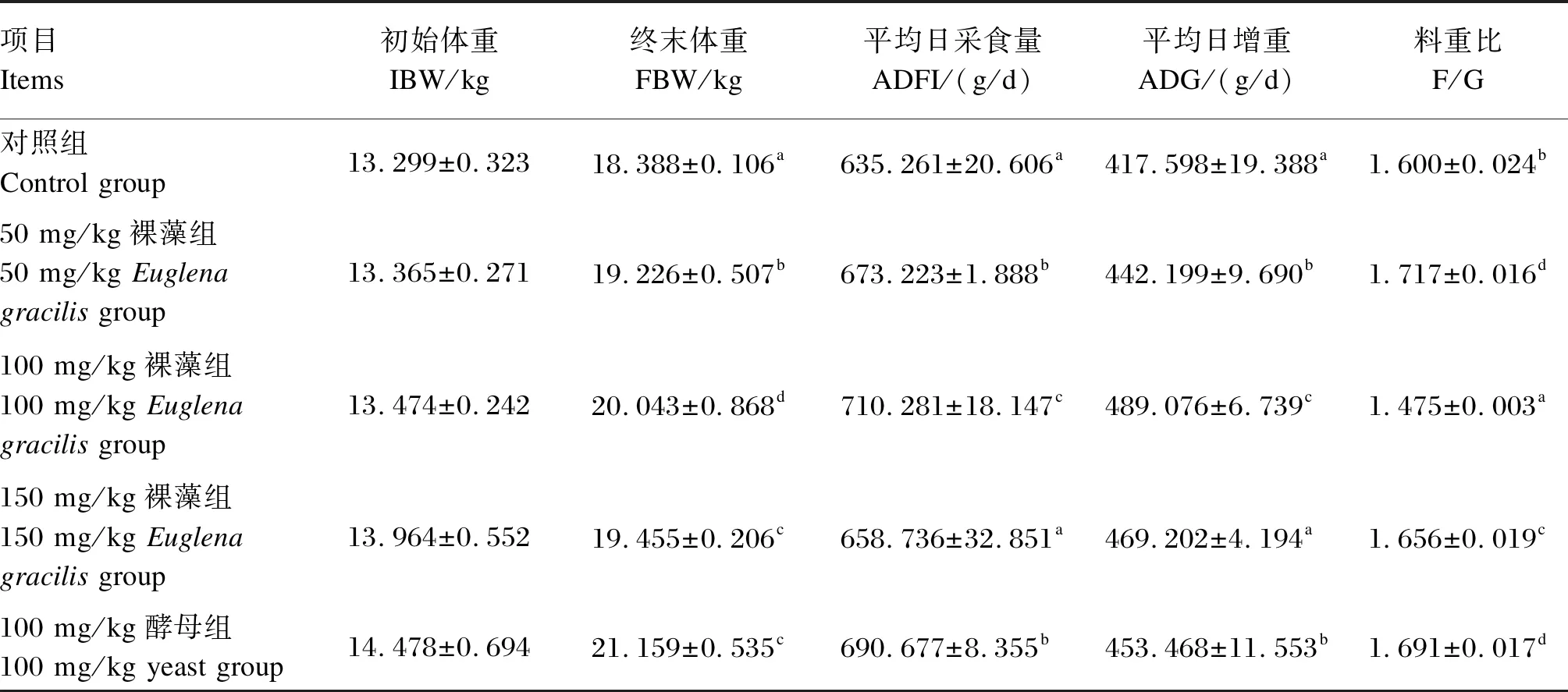
表2 裸藻β-1,3-葡聚糖对断奶仔猪生长性能的影响
2.2 裸藻β-1,3-葡聚糖对断奶仔猪血清炎症细胞因子含量的影响
由表3可知,与对照组相比,50 mg/kg裸藻组、100 mg/kg裸藻组、150 mg/kg裸藻组和100 mg/kg酵母组血清IL-1、IL-6和TNF-α含量均显著升高(P<0.05)。其中,50 mg/kg裸藻组的血清IL-1、IL-6和TNF-α含量最高,显著高于其他各组(P<0.05)。
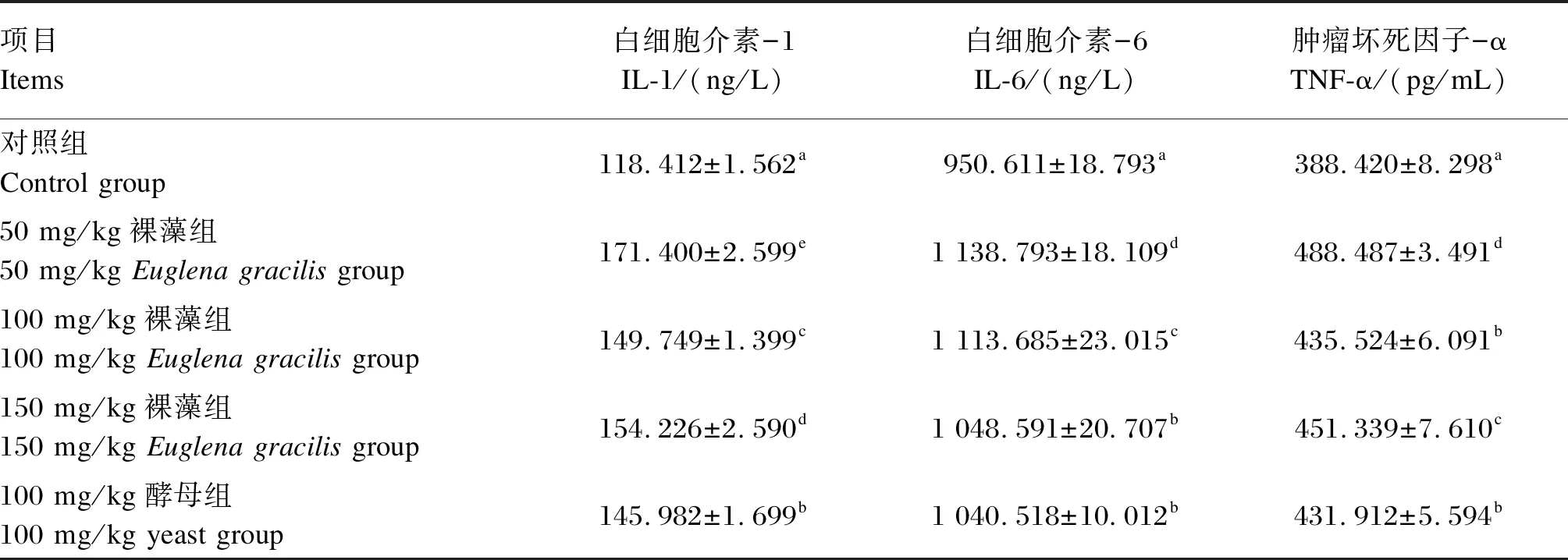
表3 裸藻β-1,3-葡聚糖对断奶仔猪血清炎症细胞因子含量的影响
2.3 裸藻β-1,3-葡聚糖对断奶仔猪肠道菌群结构的影响
图1是各组基于一致性绘制的稀释曲线,曲线趋于平缓,证明本试验测序数据量已饱和,即测序数据合理,可以反映样本中大多数的微生物信息。进而对各组粪便样本进行测序,统计OTU数目,用Venn图展示不同组之间共有和差异的OTU数目。由图2可知,对照组OTU数目为2 325个,50 mg/kg裸藻组OTU数目为1 495个,100 mg/kg裸藻组OTU数目为1 940个,150 mg/kg裸藻组OTU数目为1 951个,100 mg/kg酵母组OTU数目为2 082个,各组共有OTU数目为484个。结果发现,50 mg/kg裸藻组OTU数目明显降低,表明添加50 mg/kg裸藻β-1,3-葡聚糖可降低菌群丰富度。

A:对照组;W:50 mg/kg裸藻组;X:100 mg/kg裸藻组;Y:150 mg/kg裸藻组;Z:100 mg/kg酵母组。下图同。
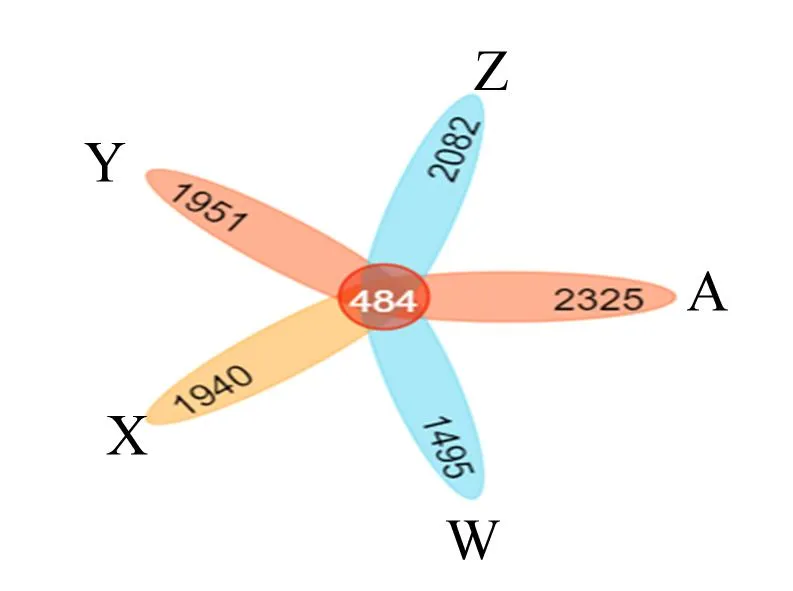
图2 肠道菌群OTU的Venn图
由表4可知,在门水平上,与对照组相比,50 mg/kg裸藻组的软壁菌门(Tenericutes)相对丰度显著升高(P<0.05);与50 mg/kg裸藻组相比,100 mg/kg裸藻组、150 mg/kg裸藻组、100 mg/kg酵母组的软壁菌门相对丰度显著降低(P<0.05)。各组之间厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)相对丰度均无显著差异(P>0.05)。

表4 门水平各物种丰富度差异性比较
由表5可知,在科水平上,与对照组相比,50 mg/kg裸藻组和100 mg/kg裸藻组的乳杆菌科(Lactobacillaceae)相对丰度显著升高(P<0.05),Lachnospiraceae相对丰度显著降低(P<0.05);150 mg/kg裸藻组的梭菌科(Clostridiaceae)和S24-7相对丰度显著升高(P<0.05),Lachnospiraceae相对丰度显著降低(P<0.05);100 mg/kg酵母组的Lachnospiraceae相对丰度显著降低(P<0.05),乳杆菌科相对丰度显著升高(P<0.05)。

表5 科水平各物种丰富度差异性比较
由表6可知,在属水平上,与对照组相比,50 mg/kg裸藻组的瘤胃球菌属(Ruminococcus)相对丰度显著降低(P<0.05),100 mg/kg裸藻组的梭菌属(Clostridium)相对丰度显著降低(P<0.05),150 mg/kg裸藻组的乳杆菌属(Lactobacillus)和瘤胃球菌属相对丰度显著降低(P<0.05),100 mg/kg酵母组的瘤胃球菌属和链球菌属(Streptococcus)相对丰度显著降低(P<0.05)。
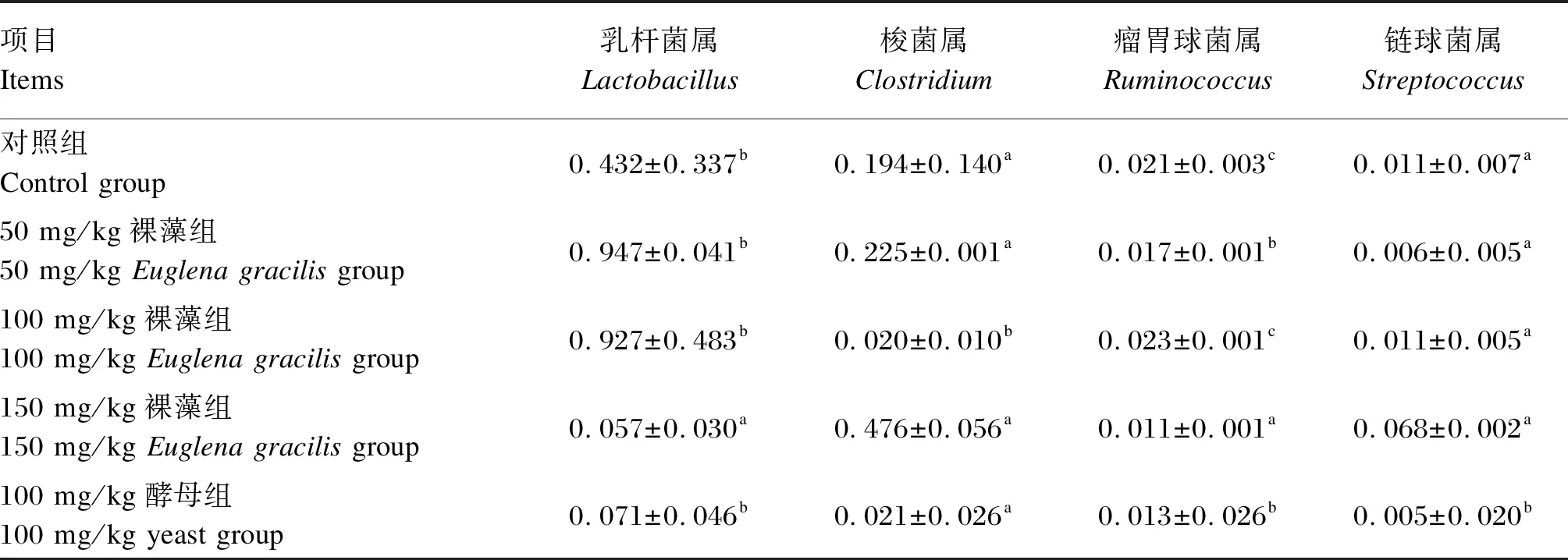
表6 属水平各物种丰富度差异性比较
2.4 Alpha多样性分析
Alpha多样性指数是反映样本微生物群落复杂程度的重要依据,包括群落的丰富度和多样性。有Chao1、Observed species、Goods_coverage、Shannon、Simpson和Pielou-e指数等。群落丰富度可以用Chao1指数表示,其值越高,表明OTU数目越多,群落物种总数越多;群落多样性可以用Simpson指数表示,其值越高,表明群落多样性越大。由图3可知,与对照组相比,100 mg/kg裸藻组的Chao1指数显著升高(P<0.05),150 mg/kg裸藻组的Simpson指数显著降低(P<0.05)。50 mg/kg裸藻组的Chao1指数显著低于100 mg/kg裸藻组(P<0.05)。

图3 肠道微生物alpha多样性指数
2.5 Beta多样性分析
Beta多样性分析用于反映不同样本群落之间的物种差异性。常用主坐标分析(PCoA)描述样本的距离,样本距离越近,物种组成成分越接近。由图4可知,100 mg/kg裸藻组与对照组物种相似性最高。此外,采用Adonis法将2组进行组间差异检验,计算得出相关系数(R2)=0.598 01,P=0.001,其他组与对照组组间样品差异越大,组内样品差异越小,表明分组效果越好,分组合理(图5)。
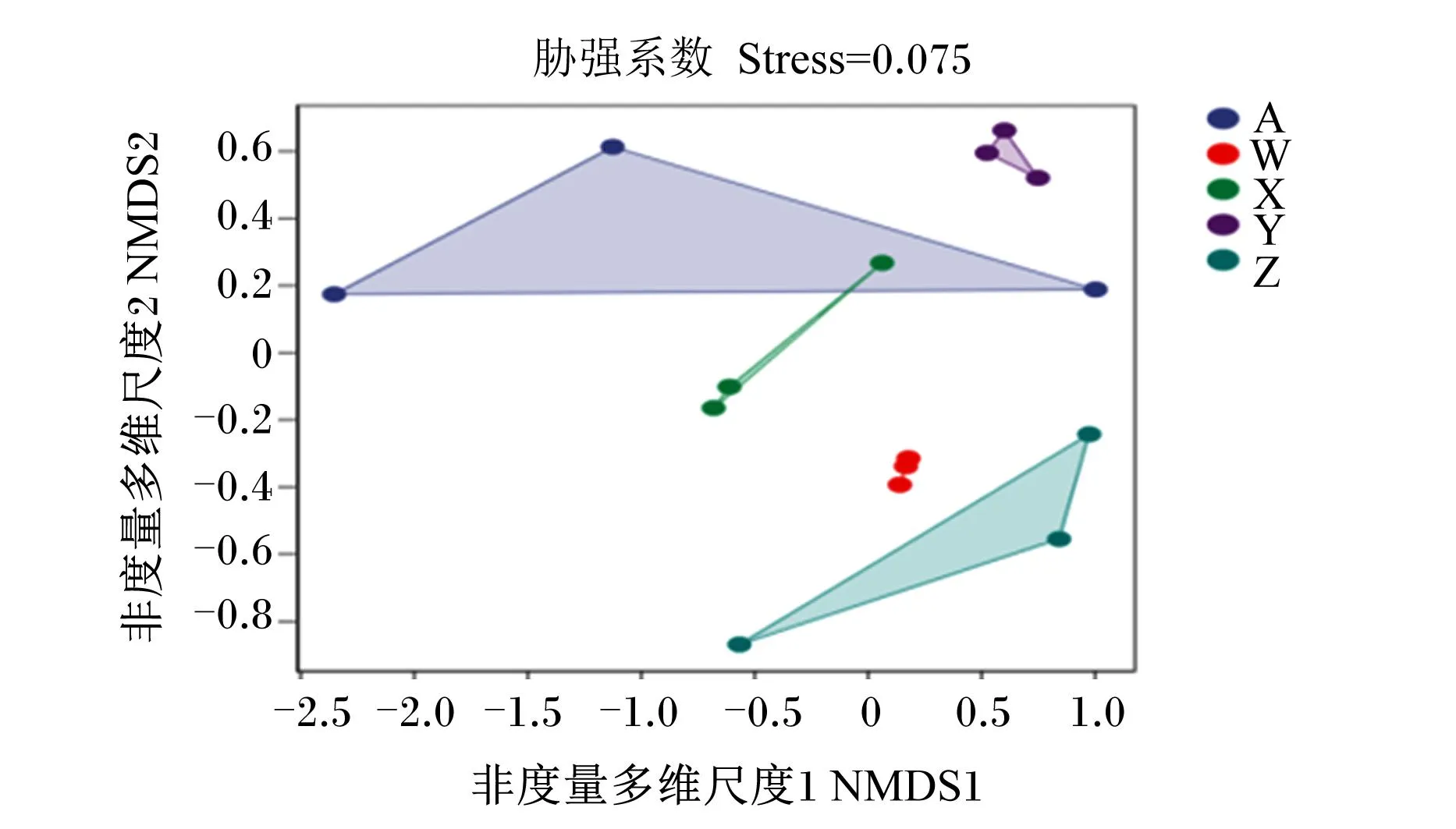
图中每个点代表1个样本,不同颜色的点指示不同的样本(组)。由于非度量多维尺度(NMDS)采用等级排序,因此可近似认为2点之间的距离越近(远),表明2个样本中微生物群落的差异越小(大)。
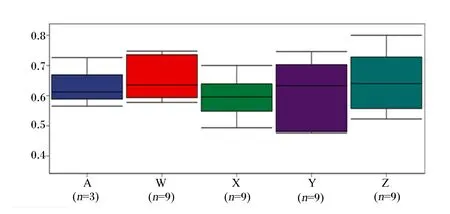
纵坐标为距离的秩 The vertical coordinate is the rank of distance。
3 讨 论
3.1 裸藻β-1,3-葡聚糖对断奶仔猪生长性能的影响
断奶仔猪生长情况和健康状况是由体重的增减所决定的,也是评价β-葡聚糖实用性的关键。在本试验中,100 mg/kg裸藻组的平均日增重最高,料重比最低,说明饲粮中添加100 mg/kg裸藻β-1,3-葡聚糖对断奶仔猪生长性能的改善效果最好。这与之前的Luo等[7]对仔猪的研究结果一致。裸藻β-1,3-葡聚糖富含动物所必需的维生素、矿物营养素、氨基酸、类胡萝卜素、不饱和脂肪酸等59种营养物质。本试验结果显示,添加100 mg/kg裸藻β-1,3-葡聚糖优于同等剂量的酵母β-1,3-葡聚糖,这是由于裸藻不含细胞壁,可高效地吸收营养物质,植物性、动物性2种营养物质都可被有效吸收。而酵母含有细胞壁,因此营养吸收能力较裸藻差。然而,以往对β-葡聚糖的研究结果并不一致。Dritz等[15]研究表明,β-葡聚糖可以显著增加平均日增重,并降低死亡率。张馨等[16]连续90 d给大鼠灌胃0.62、1.25、2.50g/kg的酵母β-葡聚糖,结果发现,大鼠采食量和体重与对照组差异不显著。Schoenherr等[17]研究了添加0、0.025、0.050、0.075、0.100和0.125% β-葡聚糖的19日龄断奶仔猪生长性能,发现前2周没有改善生长性能,但β-葡聚糖总体上改善了生长性能。裸藻β-1,3-葡聚糖能降低仔猪死亡率,可能与β-葡聚糖诱导炎症细胞因子(如IL-6、TNF-α)等产生有关[18],这使仔猪处在过度免疫应激状态,从而影响生长[19]。另外,β-葡聚糖作为免疫调节剂的添加效果与添加量和使用时间有关。研究表明,β-葡聚糖的适宜添加量为0.1%~1.0%,高添加量会导致免疫疲劳,从而降低抵抗力[20-21]。
3.2 裸藻β-1,3-葡聚糖对断奶仔猪血清炎症细胞因子含量的影响
β-葡聚糖作为生物调节剂,大部分存在于膳食藻类和真菌[2-23]。裸藻β-1,3-葡聚糖可触发先天免疫细胞的促炎反应,并通过与巨噬细胞、中性粒细胞的特定受体结合来提高免疫功能。IL-1和IL-6在免疫系统中扮演着重要的角色,裸藻β-1,3-葡聚糖通过提高促炎因子含量来增强免疫力[24]。Kim等[6]研究发现,藻类衍生的β-葡聚糖增强了断奶仔猪的肠道健康和免疫反应。据报道,被感染大肠杆菌后的小鼠饲喂裸藻β-1,3-葡聚糖(1%)后可显著提高存活率,其中抗体、白细胞介素-2(IL-2)、自然杀伤细胞含量等免疫指标显著升高,该试验将酵母β-葡聚糖作为对照,结果显示,饲喂裸藻β-1,3-葡聚糖在小鼠免疫响应效果上明显优于酵母β-1,3-葡聚糖[12],这与本试验研究结果相似。仔猪感染金黄色葡萄球菌后,饲喂β-葡聚糖可以降低血清触珠蛋白含量[17]。以血细胞计数和血清炎症参数为标准,发现补充藻类衍生的β-葡聚糖可减少由细菌感染导致的炎症,加强免疫功能。IL-1不仅可以调节肠道内分泌,还能够对自身和黏膜抗原的耐受中发挥关键作用。根据目前试验中的观察结果,有2种潜在的机制与这些益处有关。第1种,裸藻β-1,3-葡聚糖的加入通过增强紧密连接蛋白的mRNA表达和降低空肠的肠道通透性来改善肠道完整性[25]。第2种,补充裸藻β-1,3-葡聚糖可以增强仔猪的免疫应答,从而停止腹泻和加快回复细菌感染带来的伤害[26]。补充约100 mg/kg裸藻β-1,3-葡聚糖可以缓解断奶仔猪腹泻和炎症的频率。这一结论与Li等[27]通过喂食不同来源的β-葡聚糖,免疫反应得到改善的试验结果一致。酵母来源的β-葡聚糖,结构特点是主链由β-1,3-糖苷键连接,带有由β-1,6-糖苷键连接的分支。裸藻来源的β-葡聚糖由简单的β-1,3-糖苷键组成,然而β-1,3-糖苷键主要负责免疫调节[28],因此裸藻组的免疫功能普遍高于酵母组。
3.3 裸藻β-1,3-葡聚糖对断奶仔猪肠道菌群结构的影响
断奶仔猪生长性能、营养物质代谢和吸收、免疫功能等方面是由肠道菌群平衡所决定的[29]。本试验对盲肠微生物进行Alpha多样性指数测定、Beta多样性分析,评估微生物菌群的相对丰度和多样性。为了避免线性模型的缺点(指PCoA),更好地反映组间差异,应用非线性模型NMDS分析,其结果的优劣用胁强系数(Stress)来衡量,通常认为当Stress<0.1时,是一个好的排序。研究结果显示,100 mg/kg裸藻组与对照组相似性最高,说明2组之间微生物多样性差异较小。影响机体健康的关键是变形菌门相对丰度的改变[30]。胃肠道中的变形菌门细菌大都为兼性厌氧菌,且都为革兰阴性菌,可产生脂多糖(LPS)等促进炎症反应,具有一定致病性[31]。研究表明,猪粪便菌群中的优势菌门为厚壁菌门和拟杆菌门,二者占微生物区系比例较高,相对丰度高于90%,其他菌门相对丰度较低。厚壁菌门和拟杆菌门有益于机体对营养物质的消化,分解纤维,降解碳水化合物[32-33]。本研究对仔猪粪便样本菌群相对丰度分析发现,其厚壁菌门和拟杆菌门是肠道内2个优势菌门,约占98%。主要成因可能是由于厚壁菌门属于革兰氏阳性菌,可抑制病原菌,抗感染,抑制内毒素的产生,维持肠道的微生态平衡,最重要的是可阻止病原菌对肠道的入侵和定植[34]。厚壁菌门含有大量的优势菌,产生的短链脂肪酸可有效的调节免疫系统反应,其中乳杆菌可维持肠道菌群平衡、抑制病原体黏附小肠壁、减少炎症反应[35]。而拟杆菌门既能抵抗病原菌的侵袭,又能降解大量多糖,分解碳水化合物[36]。随着裸藻β-1,3-葡聚糖添加量的增加,拟杆菌门的相对丰度下降,厚壁菌门的相对丰度升高。拟杆菌门和厚壁菌门存在共生关系,相互作用使宿主吸收能力加强,作为肠道的主要菌群,二者比例尤为关键,拟杆菌门相对丰度降低或者厚壁菌门相对丰度升高均有助于加强血脂代谢、提高生长性能、改善菌群结构。在门水平各物种丰富度差异性上,本试验发现各组肠道菌群主要为拟杆菌门和厚壁菌门,这与前人的研究结果[37-38]一致。
4 结 论
饲粮中添加100 mg/kg裸藻β-1,3-葡聚糖能够增加断奶仔猪的采食量,促进生长,降低炎症反应,调节肠道菌群结构。

