陕西省与河南省猪场猪繁殖障碍与呼吸综合征流行病学调查与序列分析
黄雄挺,郭紫晶,周 泷,陈劲松,张志东,李彦敏
西南民族大学动物医学四川省高校重点实验室,四川 成都 610041
0 引言
猪繁殖与呼吸综合征(PRRS)是生猪生产国最常见的病毒性疾病之一。自20世纪80年代暴发以来,PRRS对全球养猪业造成了巨大的经济损失[1-2]。根据遗传和抗原分析,猪繁殖与呼吸综合征病毒(PRRSV)分为2种主要基因型:PRRSV-1(欧洲型)和PRRSV-2(美洲型)[3-4]。PRRS于1995年在中国首次报道,命名为CH-1a,证实了PRRSV在中国的存在[5]。2006年,中国暴发了一种病因不明的“高热”疾病。基本上它是由突变的PRRSV病毒引起的,后来被命名为高致病性PRRSV(HP-PRRSV)。该变异具有独特的NSP2中30(1+29)个氨基酸不连续缺失的特征,并已成为该领域优势的流行毒株[6]。NADC30株于2008年首次在美国被发现,其特征是NSP2缺失131(111+1+19)个氨基酸[7]。NADC30-like株在2013年传入中国,近年来传播迅速,广泛流行至今[8]。
PRRSV是一种小的、包膜的单股正链RNA病毒。PRRSV根据最新分类新归为属于动脉炎病毒属(Arterivirus)、动脉炎病毒科(Arteriviridae)、尼多病毒目(Nidovirales),至少含有11个开放阅读框(ORFs)[9-10]。其中非结构蛋白Nsp2与结构蛋白GP5基因的变异最大,Nsp2是PRRSV基因组中最异质和可变的编码蛋白,在田间菌株中,Nsp2编码区存在自然的替换、插入和缺失,研究发现所有HP-PRRSV毒株在Nsp2中具有相同的不连续30aa缺失,这种独特的遗传模式最初被认为与疾病严重程度有关[11-12],因而该区域常作为区分不同亚型PRRSV的鉴别区域[13]。GP5是由ORF5基因编码的囊膜糖蛋白,欧洲型GP5蛋白约有201aa,而美洲型为200 aa,由于其变异性和免疫学特性,其已成为分析PRRSV遗传变异的主要目标蛋白[14]。因此,Nsp2与GP5基因是监测遗传变异和开展鉴别诊断试验的理想标记物。PRRSV因其较高的突变率和重组率,具有复杂的遗传多样性[15]。中国猪群中多种PRRSV谱系共存,包括谱系1、3、5和8,促进了不同谱系之间的PRRSV重组[16-17]。PRRSV重组不仅会导致新的PRRSV基因型的产生,还会引起致病性的变化[18]。近年的监测发现,我国PRRSV的重组不仅发生在野毒之间,而且会有野毒与减毒活疫苗的重组,这些重组可导致新变种的发展,导致对猪的替代致病性,为现有疫苗预防和控制PRRS带来了新的挑战[19-20]。本研究通过分析陕西、河南2地养殖场采集的PRRSV阳性样品中Nsp2和GP5基因的遗传变异,了解现阶段陕西、河南2地PRRSV的流行特点,为制定有效的防控措施提供参考依据。
1 材料与方法
1.1 材料
1.1.1 样品
2020—2022年,从陕西和河南的猪场采集了252份肺脏、淋巴结、脾脏、肝脏、血液和精液样本,这些样本来自出现高热、呼吸困难和流产症状的疑似感染PRRSV的猪只。
1.1.2 主要试剂
GeneRed 核酸染料,DL-2000标记染料,购自天根生化科技(北京)有限公司;大肠杆菌DH5α感受态细胞,反转录试剂盒,购自TaKaRa;TRIZOL提取试剂,50×TAE均购自赛默飞公司。
1.1.3 主要仪器
梯度PCR、恒温振荡器、微波炉(GALANZ)、水平电泳仪。实时荧光定量PCR仪,鲲鹏基因(北京)科技有限责任公司;智能型多功能核酸蛋白图像工作站,广州博鹭腾生物科技有限公司;超声破碎仪,Branson公司;高速冷冻离心机,上海卢湘仪离心机仪器有限公司。
1.2 方法
1.2.1 引物合成
鉴于中国现在常流行的PRRSV 谱系较为复杂,根据GenBank中PRRSV代表毒株VR-2332(登录号为AY150564) 使用 NCBI 软件选择了保守区域,并使用Primer Premier 5.0软件为PRRSV的Nsp2基因、ORF5基因区域设计病毒特异性引物,上海生物工程有限公司合成。引物具体信息见表1。

表1 引物序列Table 1 Primers sequence
1.2.2 样品处理及核酸提取
取适量样本在组织研磨仪中充分研磨,反复冻融3次,于离心机上6 000 r/min 离心,取200 μL上清液;直接取血清及精液200 μL,用TRIZOL试剂法提取病毒RNA,同时提取 PRRSV阳性对照样品的RNA,使用TaKaRa反转录试剂盒反转录,所有方法按照说明书操作,将得到的核酸于-80 ℃保存,备用。
1.2.3 PCR扩增
根据反转录试剂盒的说明,将RNA反转录为cDNA,并使用表1所列的引物对作为模板进行PCR扩增。PCR扩增系统:2×Taq PCR Master Mix 12.5 μL,上游和下游引物10 μ mol/L,cDNA 模板2 μL,ddH2O补充至25 μL。以ddH2O作为阴性对照。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共37个循环;72 ℃再延伸10 min。取PCR产物用1%琼脂糖凝胶电泳检测。
1.2.4 序列比对及遗传进化分析
从GenBank中选择26株不同基因型、不同谱系PRRSV ORF5基因和Nsp2基因(见表2)序列作为参考序列,包括PRRSV-1型3株、PRRSV-2 型23株,其中谱系1毒株5株,谱系3,5,8毒株各6株[21]。利用MEGA11软件通过邻接法分析遗传变异,构建遗传进化树。
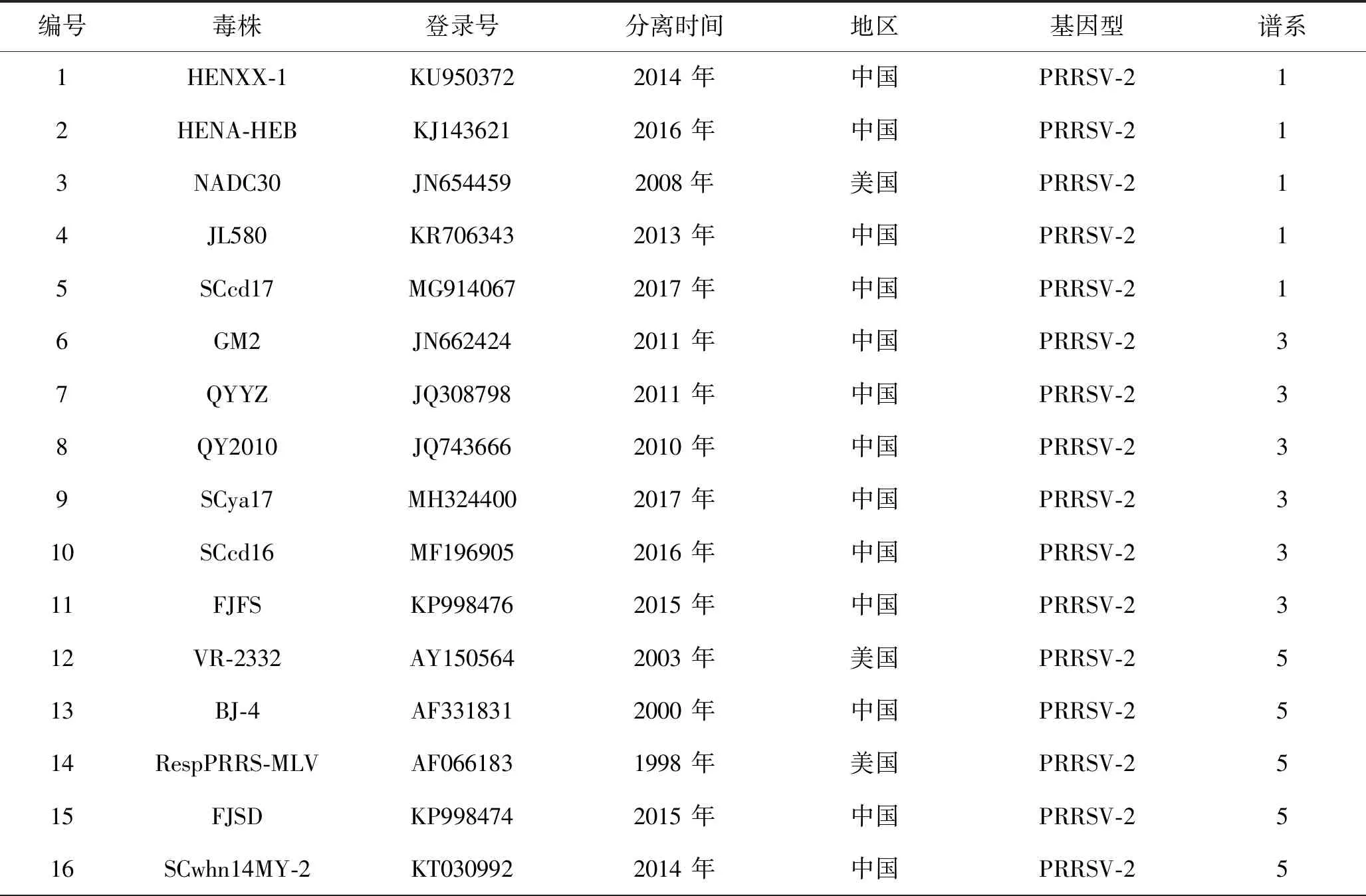
表2 参考毒株信息Table 2 Reference strain information
2 结果
2.1 样品PCR检测
经检测,252份样品中检测出阳性样品39份,阳性率为15.6%(见表3);在39份阳性样品中扩增出10条Nsp2基因全长和5条ORF5基因长,其中GP-10与Nsp2-1为同一株,如表4、表5所示。

表3 PRRSV 样品阳性率统计Table 3 PRRSV sample positive rate statistics
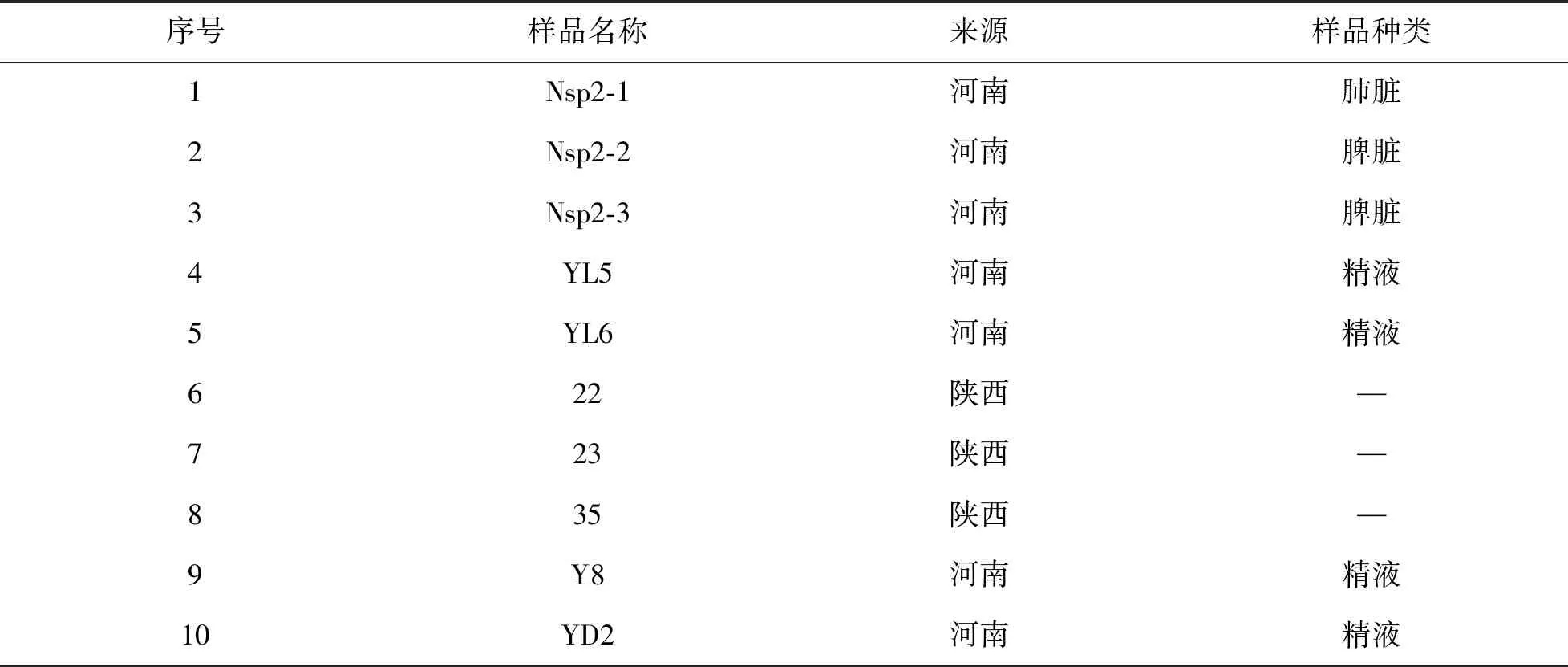
表4 Nsp2阳性样本信息Table 4 Information of Nsp2 positive samples

表5 GP5阳性样本信息Table 5 Information of GP5 positive samples
2.2 序列比对与遗传进化分析
2.2.1 ORF5基因与Nsp2基因序列比对
经核苷酸序列比对分析发现:从陕西与和河南地区获取的5株PRRSV毒株与GenBank中26株参考毒株PRRSV ORF5基因的核苷酸序列同源性为79.7%~99.7%,5株PRRSV ORF5基因序列与PRRSV-2型和PRRSV-1型的同源性分别为79.7%~99.7%、57.9%~63.2%。10株PRRSV毒株与GenBank中26株PRRSV参考毒株的Nsp2基因之间的核苷酸序列同源性为38.2%~92.2%,与PRRSV-2型和PRRSV-1型参考毒株的同源性分别为38.2%~92.2%、48.2%~50.7%。以VR-2332经典株ORF5基因与Nsp2基因序列作为参考,5株ORF5基因与VR-2332株的同源性为85.3%~99.7%,其基因含611个碱基,其中,GP5-10、GP5-7与GP5-5株的ORF5基因在第83、170、与443位碱基出现T碱基突变为C碱基,在第197位碱基由A/C碱基突变为T碱基,在第413位碱基由C碱基突变位T碱基,在第558位碱基有T碱基突变为A碱基;在5株 PRRSV ORF5 基因中,仅有GP5-5株在第31~38位连续插入8位碱基。而Nsp2-1、Nsp2-2与Nsp2-3株在第39位碱基由A/G突变为C,在第62、375位碱基由C/G突变为A,在第77位碱基由A突变为T;Nsp-1与Nsp2-2在第155位碱基由C突变为T,在第498位碱基由T/G/A突变为C。由此可见,ORF5基因与Nsp2基因核苷酸序列存在不同程度的变异,相比于ORF5基因,Nsp2基因总体变异更大。
2.2.2 氨基酸序列比对
经氨基酸序列比对分析发现:从陕西与和河南地区获取的5株PRRSV毒株与GenBank中26株PRRSV参考毒株的ORF5基因推导的氨基酸序列同源性为60.9%~99.5%;5株PRRSV毒株ORF5基因推导的氨基酸序列的同源性为64.9%~99.5%;10株PRRSV毒株与GenBank中26株PRRSV参考毒株的Nsp2基因推导的氨基酸序列同源性为79.4%~91%;10株PRRSV毒株Nsp2基因推导的氨基酸序列的同源性为92.7%~97.8%;5株PRRSV ORF5基因推导的氨基酸序列与参考毒株PRRSV-2型PRRSV-1型的同源性分别为64%~99.5%、30%~35%,10株PRRSV Nsp2基因推导的氨基酸序列与PRRSV-1型参考毒株的同源性为36.6%~38.9%。以VR-2332株ORF5和Nsp2基因推导的氨基酸序列作为参考,如图1框选区域,在诱骗表位V27~N30区,获取的5株PRRSV 有GP5-10、GP5-7和GP5-5株在第28位发生 L→S 突变;在中和表位 S37 ~ L45 区,GP5-10、GP5-7和GP5-5株第37位发生缺失,仅有99L株在地42位发生Y→C 突变;在非中和表位V180~P200区,GP5-10、GP5-7和GP5-5株分别在180位、182位以及195 位发生K→R、L→S和E→R突变。
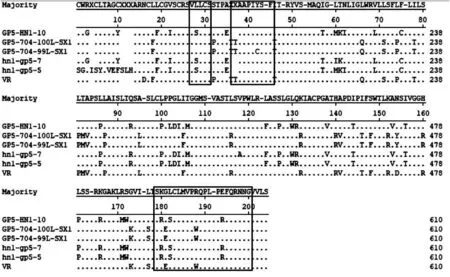
图1 ORF5基因的氨基酸序列分析Figure 1 Amino acid sequence analysis derived from ORF5 gene
如图2框选区域,在诱骗表位V27~N30区,Nsp2-3株在第30位发生 I→T突变;在中和表位 S37 ~ L45 区,Nsp2-1、Nsp2-2、Nsp2-3均未发生突变;在非中和表位V180~P200区,Nsp2-3株分别在184位和196 位发生R→W和N→D突变。

图2 Nsp2基因推导的氨基酸序列分析Figure 2 Amino acid sequence analysis derived from Nsp2 gene
2.2.3 遗传进化分析
基于对PRRSV的ORF5基因序列(600 bp)建立遗传进化树,见图3。

图3 PRRSV GP5基因遗传进化树构建结果Fig.3 Phylogenetic tree construction results based on PRRSV ORF5 gene
由图3可知:5株GP5基因PRRSV毒株均在PRRSV-2型在同一簇,其中有3株为PRRSV-2型第1谱系毒株,2株为PRRSV-2型第5谱系的毒株。谱系1中的3株毒株为GP5-HN1-5、GP5-HN1-7、GP5-HN1-10与代表毒株NADC30亲缘关系最近;另外谱系5的2株毒株GP5-704-99 L-SX1、GP5-704-100 L-SX1与代表VR2332亲缘关系最近。
基于对PRRSV的Nsp2基因序列分析并绘制遗传进化树,见图4。
由图4可知:10株Nsp2基因PRRSV毒株均在PRRSV-2型第1谱系的毒株,与NADC30株的亲缘关系最近。
3 讨论
自2006年HP-PRRSV暴发以来,国内学者对于PRRSV流行及遗传变异情况的研究从未间断,由于PRRSV遗传变异的多样性,PRRSV仍未能得到有效控制[22]。本研究通过对2020—2022年收集来自陕西省与河南省2地猪场猪群中的252份疑似感染PRRSV的猪样品进行检测,阳性样品有39例,总阳性率为15.6%。其中,扩增出10条Nsp2基因、5条ORF5基因,5株ORF5基因PRRSV毒株均在PRRSV-2型在同一簇,3株为PRRSV-2型谱系1毒株(GP5-5、GP5-7、GP5-10)与代表毒株NADC30亲缘关系最近,2株为PRRSV-2型谱系5的毒株(99L、100L)与NADC30代表毒株的亲缘关系最近,其中有1株Nsp2基因与ORF5基因来自于同一株。说明陕西和河南地区发生了第1谱系和第5谱系毒株的混合流行,其中GP5-10与Nsp2-1、Nsp2-2、Nsp2-3均为河南猪场样本,这提示河南地区猪场可能同时存在多种谱系毒株,GP5-10与Nsp2-1来自同一样品皆属于谱系1,推测该猪场毒株可能还未发生重组。同时还发现,本研究扩增的Nsp2基因序列数量多ORF5基因,推测可能是样品中ORF5基因的含量过低或核酸发生降解,或是ORF5基因发生突变,导致检测灵敏性降低。韦丽丽[23]采用RT-PCR方法对91份PRRSV阳性样品的Nsp2与ORF5基因特异性片段进行扩增,只获得18条Nsp2基因序列和48条ORF5基因序列,与本研究的结果类似。因此,研究并开发更高效、精准、低成本的检测方法对 PRRSV 临床检测与诊断具有重要应用价值。
通过对10条Nsp2基因5条ORF5基因的核苷酸序列与氨基酸序列进行分析,发现5株PRRSV ORF5基因序列与PRRSV-2型和PRRSV-1型的同源性分别为79.7%~99.7%、57.9%~63.2%,10株PRRSV Nsp2基因与PRRSV-2型和PRRSV-1型参考毒株的同源性分别为38.2%~92.2%、48.2%~50.7%,10条Nsp2基因序列5条ORF5基因序列均有不同程度的突变,这也表明PRRSV遗传变异是复杂多样的,位于高变区的Nsp2基因和ORF5基因的突变和重组仍然是PRRSV广泛流行的最主要原因,因而对特异性疫苗的研制和PRRSV的防控难度也是与日俱增。
我国Ⅱ型PRRSV目前属于多种PRRSV亚型共存的状态,PRRS广泛流行至今,仍没有研发出理想的疫苗。田间毒株的多样性及频繁变异增加了PRRS的临床诊断、实验室诊断和疫苗控制的难度,且不同地区PRRSV毒株之间存在较大的抗原性差异[24-25],国内通常大规模使用弱毒PRRSV疫苗对养殖场进行免疫,但低剂量疫苗存在安全问题,可能出现病毒毒力返强的现象,为疾病防控带来了难度和挑战[26]。因此,实时监测 PRRSV 株系的基因突变动态,探索其基因变异和重组模式,可以为该疾病的防控提供更科学的参考依据。
4 结论
陕西和河南地区猪场存在谱系1和谱系5毒株的混合流行,但在河南猪场同一样品的Nsp2基因与ORF5基因均在谱系1,推测该猪场目前还未发生毒株重组的现象,PRRS依然是我国猪场中普遍存在且最具威胁的传染病之一。

