背部推法对慢性疲劳综合征大鼠运动行为、氧化应激和炎症反应的影响
林巧婷 钟叶蓓 杨尚林 裴鑫 杨小慧 李武 李铁浪
湖南中医药大学(长沙 410208)
慢性疲劳综合征(chronic fatigue syndrome,CFS)是以持续或反复发作的严重疲劳为主要表现的慢性复杂性疾病,CFS 患者常表现为运动能力降低,并因此而严重影响到了日常生活活动[1]。近些年研究发现,CFS的病因包括工作生活压力剧增、病毒感染后遗症等因素,这些复杂的社会环境作用导致机体氧自由基增加进而引发高氧化应激状态及全身慢性炎症反应,从而表现为持续或反复的疲劳[2-3]。此外,在高氧化应激状态下,骨骼肌还会出现能量代谢障碍、肌纤维组织改变等异常表现,进一步加重机体疲劳,表现为运动能力下降[4]。
中医认为CFS 属于“虚劳”范畴,病机主要为五脏亏虚、气血失调、经络不通[5]。通过对国内外推拿治疗CFS 的文献研究分析发现[6-10],推拿能够缓解CFS 患者疲劳状态,提高患者生活质量和运动能力,且推拿的操作部位多以背部的督脉和两侧膀胱经为主。督脉为“阳脉之海”,总督一身之阳气。足太阳膀胱经为“诸阳之属”,其上有五脏六腑之背俞穴,为脏腑之气汇聚灌注之处。督脉与膀胱经经气可在背俞穴进行交汇,并将阳气布输全身,发挥调补五脏的功能[11]。故推拿作用于背部的督脉与膀胱经可改善五脏虚损,气血失衡状态,达到补虚泻实,疏通经络的治疗作用。因此,本研究选择督脉与膀胱经为干预部位。
推法是指施术者用指、掌或肘等部位着力于机体进行的单方向直线运动,其作为背部推拿中的主要手法之一,具有兴奋肌纤维,加速血液循环,舒筋活络等功效[12]。有临床研究证实[10,13],以推法为主的复合手法施加于患者时能够降低CFS 患者氧自由基水平,增强超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性,达到消除疲劳的治疗效果。另外相关实验研究提示[14-15],推法相关复合手法还可通过降低血清中炎性细胞因子的含量,如肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)等,起到改善患者及大鼠疲劳和运动能力的效果。因此,本研究观察背部推法对CFS 大鼠运动行为、氧化应激和炎症反应的影响,进一步对背部推法改善CFS 疲劳状态及运动行为的可能机制进行探讨。
1 材料与方法
1.1 实验动物
SPF 级健康成年SD 大鼠24 只,雌雄各半,体质量200~250 g,购自湖南斯莱克景达实验动物有限公司,实验动物许可证:SCXK(湘)2019-0004。本实验在湖南中医药大学动物实验SPF 级设施内进行,所有大鼠实验开始前先适应性饲养7 d,无菌饲料及蒸馏水喂养,饲养温度24℃~26℃,湿度50%~70%,换气次数15~20 次/h,压强梯度20~50 Pa,实验室定期紫外线照射消毒。实验方案与伦理由湖南中医药大学实验动物伦理委员会批准,审批号:LLBH-202211060005。
1.2 试剂与仪器
呼吸麻醉机(深圳市瑞沃特生命科技有限公司,型号:R500 通用型);推法刺激装置(自制,专利号:ZL202121852010.X);异氟烷(深圳市瑞沃特生命科技有限公司,批号:R510-22);大鼠旷场视频分析系统[博睿唯思(香港)科技有限公司];大鼠ELISA 检测试剂盒(厦门仑昌硕生物科技有限公司,货号:YD30206、YD35363、YD34817、YD30219、YD30422)等。
1.3 各实验操作具体时间节点
各实验操作具体时间节点见图1。
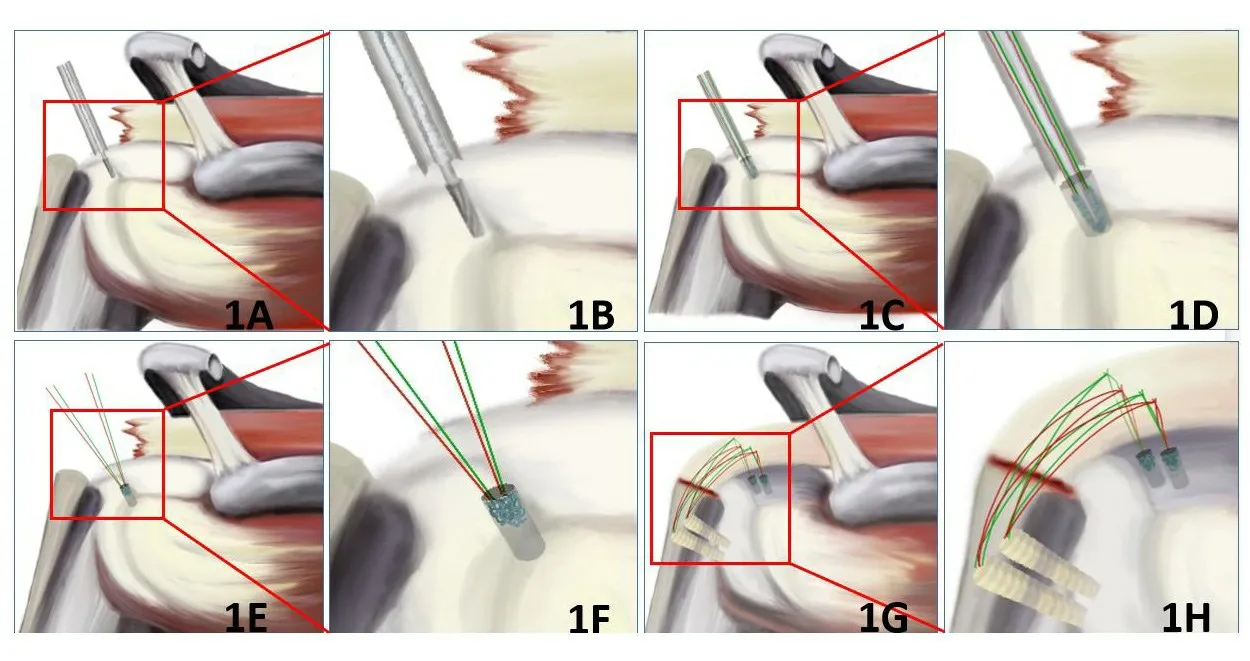
图1 各实验操作具体时间节点
1.4 分组、造模方式及成模标准
24 只大鼠随机分为空白组、模型组、推法组,每组8 只。模型组与推法组采用强迫负重游泳联合慢性应激刺激的方法建立CFS 模型[16],造模周期为21 d。具体方法如下。强迫负重游泳:在大鼠尾部增加自身体质量3%的焊锡丝,于水温25℃± 2℃、水深超过40 cm(确保大鼠完全进入水中而不触碰水桶底部)的水桶内强迫游泳至力竭,力竭标准为大鼠游泳动作失调,口鼻部沉入水下不上浮超过10 s。力竭游泳结束后,迅速将大鼠捞起擦干毛发,并置于饲养笼中休息,每日1次,共21 d。慢性应激刺激:游泳结束后根据随机数字表法每天随机给予大鼠两种不可预知的应激刺激,刺激强度控制在大鼠可承受范围内,每日1 次,共21 d。应激刺激方式包括:①12 h 禁食;②12 h 禁水;③通宵照明;④夹尾1 min;⑤110 dB 量噪音持续干扰1 h;⑥足底电击(强度为1 mA,30 V),30 s/次,每次间隔1 min,共5次。
根据一般情况半定量评分观察表(表1),对大鼠精神状态、粪便性状、皮毛色泽及耳尾颜色进行评价,总评分≥4分表明造模成功[17]。
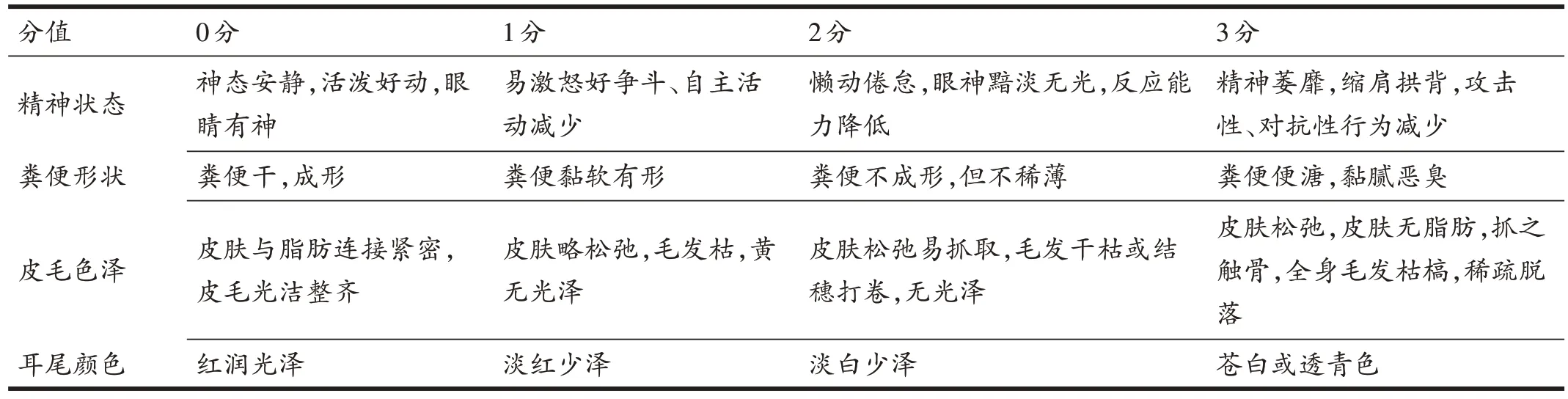
表1 一般情况半定量评分观察表
1.5 干预方式
推法组在造模结束后第1 天开始进行背部推法干预,具体方法如下:通过团队自制的推法治疗仪在大鼠背部推法操作面施以推法。使用浓度3 %的异氟烷对大鼠进行吸入麻醉,麻醉后俯卧位捆绑固定,在背部规定部位上推法刺激,根据前期研究设置大鼠推法参数(压力0.5 kg,频率约15次/min),从颈部往尾部方向单方向操作,推动距离以大鼠实际的背部长度为具体数值,干预时间20 min/次,1 次/d,连续干预14 d。推法操作面包含督脉背段和两条膀胱经第一侧线背段,具体范围:上平大鼠第一胸椎,下平第六腰椎,左右各至背部正中线旁开1.5寸(约6 mm)[18]。
1.6 观察指标及方法
1.6.1 大鼠一般情况半定量评分
于实验第0、7、14、21、28、35 天评价各组大鼠一般情况半定量评分并记录。
1.6.2 大鼠运动行为学评价
力竭游泳时间[19]:具体操作同造模方式中的强迫负重游泳。于实验第0、7、14、21、28、35 天记录各组大鼠力竭游泳时间。
旷场实验运动距离[20]:于实验第0、7、14、21、28、35天,将大鼠放置于100 cm×100 cm×50 cm 的旷场箱地面的中心方格内,记录6 min 内大鼠运动距离。每只大鼠记录结束后,均用75%乙醇擦拭旷场箱。
1.6.3 竖脊肌组织病理形态变化的HE染色
实验结束后,取大鼠两侧背段竖脊肌,一部分置于4%多聚甲醛中固定24 h,按照常规程序脱水,石蜡包埋并制作切片。切片行HE染色后,滴加适量中性树胶封片,24 h 后在光学显微镜下进行观察。并应用Image Pro Plus 软件计算肌纤维横截面积和直径,Origin软件处理绘制肌纤维横截面面积频率分布图。
1.6.4 竖脊肌组织中SOD、GSH-Px及PGC-1α的含量
参照大鼠ELISA 试剂盒说明书检测竖脊肌组织中SOD、GSH-Px 及过氧化物酶体增殖活化受体γ共激活因子-1α(peroxisome proliferation-activated receptorγ-coactivator 1α,PGC-1α)的含量。
1.6.5 血清中TNF-α、IL-1β、IL-6的含量
实验结束后,经腹主动脉取血,静置1h 后离心(4℃,3000 r/min,15 min)取血清。采用ELISA 法检测炎症因子TNF-α、IL-1β、IL-6 含量。参照大鼠ELISA试剂盒说明书检测。
1.7 统计学方法
采用SPSS 26.0 软件进行统计分析。若数据服从正态分布,则用均数±标准差(±s)表示。若数据服从正态分布且方差齐,则采用单因素方差分析,并用LSD 检验进行两两比较。若数据非正态或方差不齐,采用非参数检验。采用重复测量的方差分析对组间同一观察指标不同时间点的数据进行分析,若不同组别与不同时间上的差别均有统计学意义,则进一步采用多元方差分析进行两两比较。P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠一般情况半定量评分变化比较
本次实验共有16 只大鼠参与造模,造模结束后,参与造模的大鼠一般情况半定量评分均≥4 分,均造模成功。整个实验过程无实验大鼠脱落,全部纳入实验数据。
从实验开始至第35 天实验结束,空白组大鼠一般情况半定量评分整体呈上升趋势,但总分均未达到4分;模型组大鼠在实验开始至第21 天期间,一般情况半定量评分持续升高,在第21天至第35天稍降低并趋于稳定;推法组大鼠一般情况半定量评分从实验开始至第21天持续升高,并在第21天至第35天明显下降。
实验第7、14、21、28、35 天,模型组大鼠一般情况半定量评分均显著高于同期空白组(P<0.01)。实验第7、14、21天,模型组大鼠与推法组大鼠一般情况半定量评分同期相比无显著差异,而在第28 天和第35 天,推法组大鼠显著低于同期模型组(P<0.05,P<0.01)。详见图2。
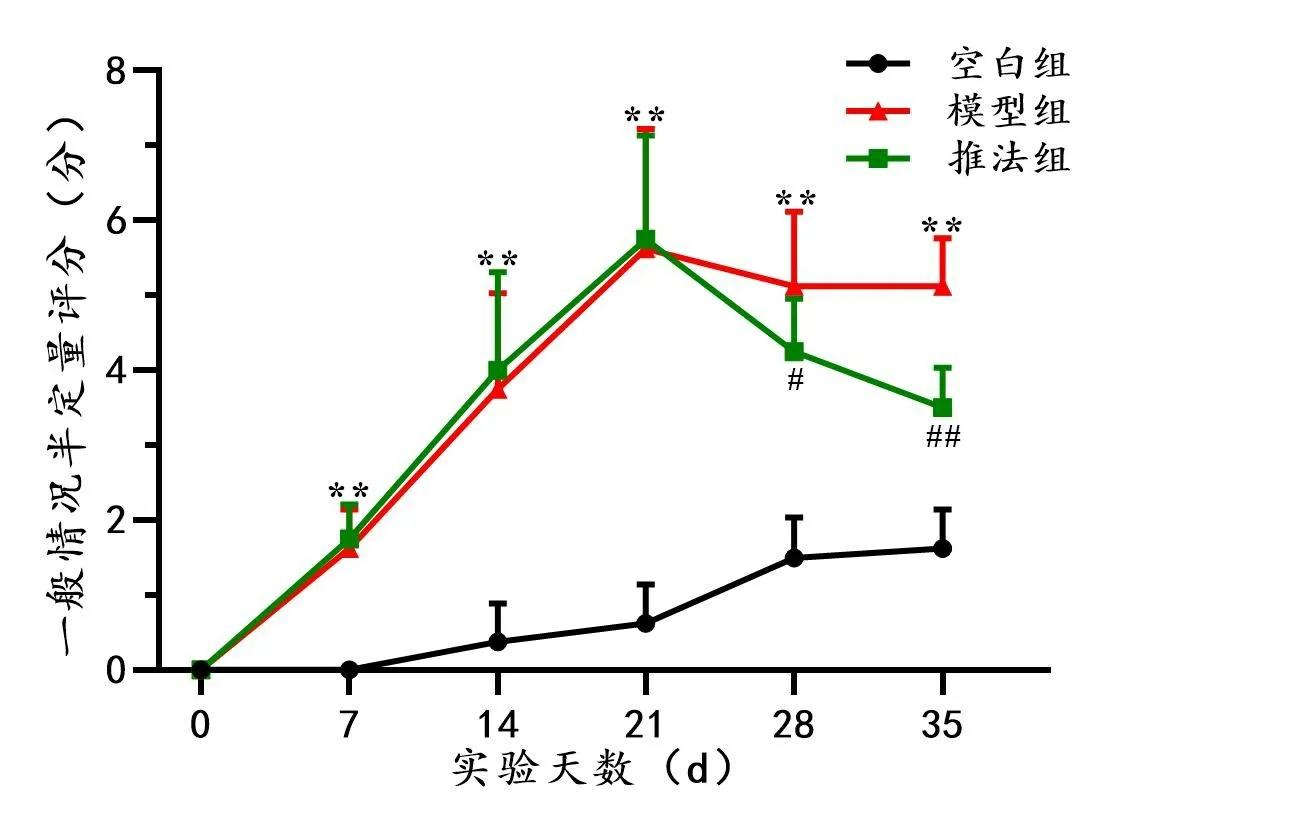
图2 各组大鼠不同时间点一般情况半定量评分的变化情况(±s,n=8)
2.2 各组大鼠力竭游泳时间与旷场实验运动距离变化比较
空白组与模型组大鼠力竭游泳时间整体均呈下降趋势,推法组大鼠力竭游泳时间先呈下降趋势,至实验第28 天以后有所回升。实验第7、14、21、28、35 天,模型组大鼠力竭游泳时间均显著低于同期空白组(P<0.05,P<0.01)。实验第7、14、21 天,模型组大鼠与推法组大鼠力竭游泳时间同期相比无显著差异,而在第35天,推法组大鼠显著高于同期模型组(P<0.05)。
空白组大鼠旷场实验运动距离整体呈下降趋势,模型组与推法组大鼠旷场实验运动距离先呈下降趋势,至实验第21 天后,模型组大鼠旷场实验运动距离稍上升并趋于稳定,推法组大鼠则明显回升。实验第7、14、21、28、35天,模型组大鼠旷场实验运动距离均显著低于同期空白组(P<0.01)。实验第7、14、21天,模型组大鼠与推法组大鼠旷场实验运动距离同期相比无显著差异,而在第35 天,推法组大鼠显著高于同期模型组(P<0.01)。详见图3。
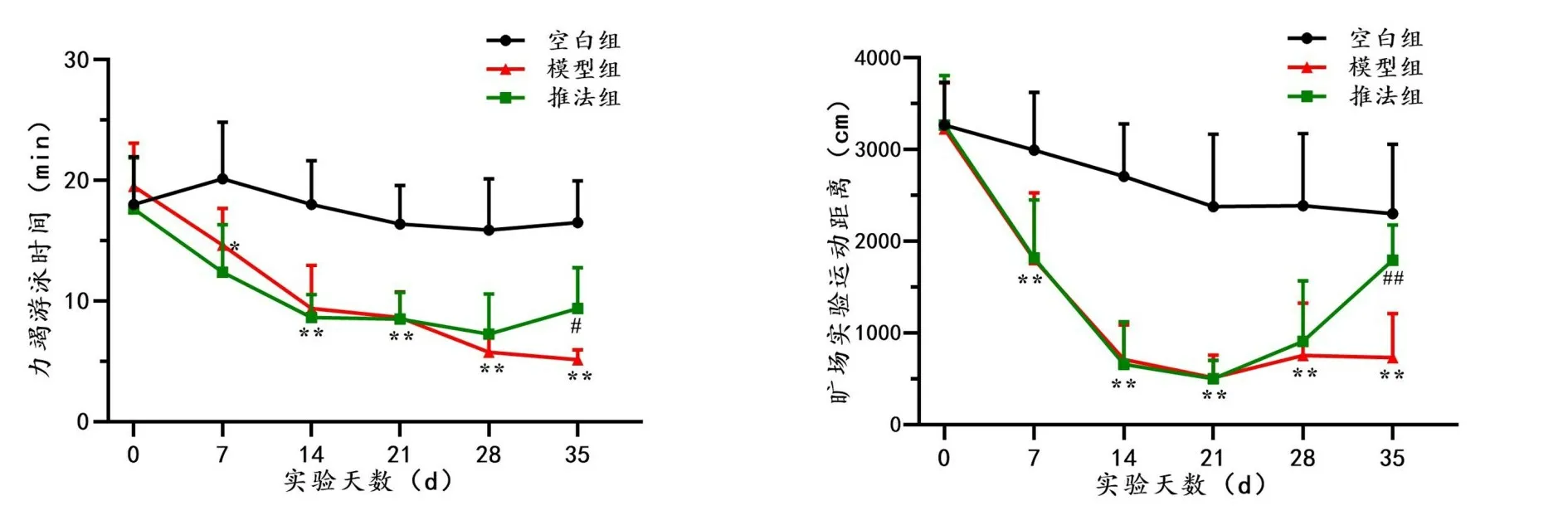
图3 各组大鼠不同时间点力竭游泳时间及旷场实验运动距离的变化情况(±s,n=8)
2.3 各组大鼠竖脊肌组织形态比较
光镜下见空白组大鼠竖脊肌肌纤维排列整齐有序,形态结构正常,细胞核均匀分布在肌纤维边缘;模型组大鼠竖脊肌肌细胞萎缩,细胞间间隙增大;而推法组大鼠肌细胞萎缩程度低于模型组(图4a)。Image Pro Plus 软件计算结果显示,与空白组比较,模型组大鼠肌纤维平均横截面积与肌纤维平均直径均显著降低(P<0.01)。推法组大鼠肌纤维平均横截面积与肌纤维平均直径均高于模型组,且差异具有统计学意义(P<0.01)(图4b)。从Origin软件绘制的肌纤维横截面面积频率分布图(图4c)可见,空白组竖脊肌肌纤维横截面积于1000~2000 μm2范围内分布最广泛,且分布较均匀,模型组大鼠肌纤维面积主要分布于200~900 μm2以内,分布较集中且范围下降明显。而相比于模型组,推法组大鼠竖脊肌肌纤维面积主要分布于500~1500 μm2,分布较均匀且范围上升明显。
图4 各组大鼠竖脊肌组织横切面形态(HE×200)(a)、肌纤维平均横截面积及平均直径(±s,n=8)(b)、肌纤维横截面面积频率分布图(c)的比较
2.4 各组大鼠竖脊肌中SOD、GSH-Px、PGC-1α的含量比较
与空白组比较,模型组大鼠竖脊肌组织中SOD、GSH-Px、PGC-1α含量显著下降(P<0.01)。与模型组相比,推法组SOD、GSH-Px、PGC-1α含量显著升高(P<0.05,P<0.01)。详见图5。
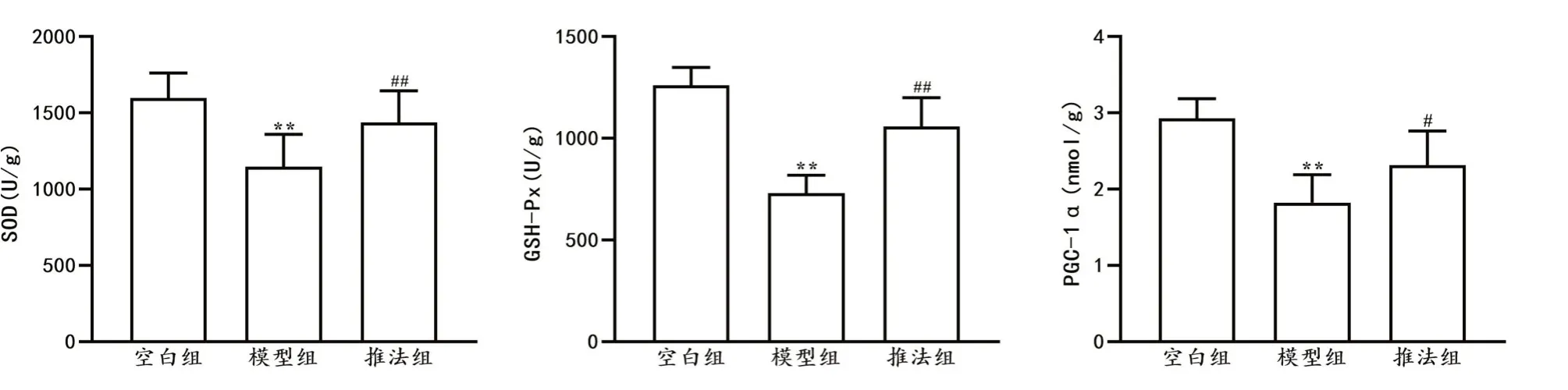
图5 各组大鼠竖脊肌中SOD、GSH-Px、PGC-1α的含量比较(±s,n=8)
2.5 各组大鼠血清中TNF-α、IL-1β、IL-6的含量比较
与空白组比较,模型组大鼠血清中TNF-α、IL-1β、IL-6 含量均显著升高(P<0.01)。与模型组相比,推法组TNF-α、IL-1β、IL-6 含量显著降低(P<0.05,P<0.01)。详见图6。
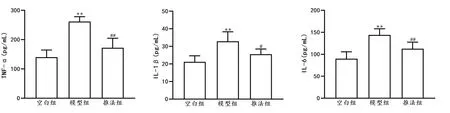
图6 各组大鼠血清中TNF-α、IL-1β、IL-6的含量比较(±s,n=8)
3 讨论
在各种社会压力以及长期疲劳状态的影响下,CFS患者多存在持续静态超负荷的慢性应激刺激,如久坐久卧等。这类慢性刺激可引起CFS 患者组织缺血缺氧的代谢改变,使机体氧化应激失衡,氧自由基堆积而产生不同程度的氧化损伤,降低机体的抗疲劳能力[21]。SOD与GSH-Px是清除氧自由基的主要抗氧化酶,两者能催化氧自由基分解成水和氧气,发挥抗疲劳的作用[22],CFS 患者或大鼠均存在两者水平下降的情况[23-24]。此外,氧化应激反应导致的细胞损伤又可导致机体炎症反应的发生[25]。临床研究结果证实[26],CFS 患者的淋巴细胞对细胞因子的反应缺乏敏感性,促使机体内部分促炎因子分泌增加,其中促炎因子TNF-α、IL-1β、IL-6 在CFS 患者血清中水平明显升高[27-28]。这是由于TNF-α、IL-1β、IL-6除能引导机体炎症反应的发生,对组织细胞产生损害外,同时还广泛参与中枢神经系统与机体各种细胞之间的信号传导,诱导疲劳感的产生,从而导致患者运动能力下降[29]。
高氧化应激导致的大量氧自由基堆积还可对细胞线粒体造成直接损伤,进而对骨骼肌能量代谢产生负面影响,能量供给不足,骨骼肌质量和肌纤维横截面积减少,导致肌肉力量降低,从而产生乏力和运动能力的减弱[23]。PGC-1α主要存在于如骨骼肌等富含线粒体的组织器官,是保持线粒体数量和维护线粒体功能的重要分子[30]。PGC-1α及其相关通路的调节可直接激活抗氧化系统,减少细胞内氧自由基的生成,保护线粒体免受氧化应激损伤,为组织输出足够的ATP[31]。研究发现,CFS 大鼠PGC-1α含量较空白组均有所减少,而中药与针灸能在提高CFS大鼠PGC-1α含量的基础上,改善氧化应激状态,修复骨骼肌损伤[32-34]。
本研究运用一般情况半定量评分、力竭游泳时间和旷场实验运动距离客观综合评定CFS 大鼠疲劳状态及运动行为。力竭游泳实验是反映大鼠疲劳状态的经典行为学实验,并对研究对象的耐力行为评价有一定价值;旷场实验同样可用于评估大鼠运动能力,是评估大鼠自发活动行为的经典实验[35]。结果显示,由强迫负重游泳联合慢性应激刺激的方法制备的CFS 动物模型可以较好地符合CFS 患者持续性疲劳及运动能力下降的临床表现,且在实验第21 天完成造模,进行背部推法干预能够更准确地观察对CFS 模型大鼠的疗效。此外本研究发现,通过背部推法干预可以缓解CFS 模型大鼠的疲劳表现,改善运动行为,且背部推法维持14 d可获得显著疗效。
基于以上结果,本研究对背部推法改善CFS 大鼠疲劳状态及运动行为的机制进行进一步探讨。背部推法作为体表刺激,能够通过缓解肌肉紧张,扩张周围血管,改变血液高凝、粘滞状态,加快血液循环,改善患者缺血缺氧状态[36]。本研究结果显示,相较于空白组大鼠,模型组大鼠竖脊肌组织中的SOD、GSH-Px 含量显著降低。推法组大鼠竖脊肌组织中的SOD、GSH-Px 含量显著高于模型组,这表明背部推法能够通过改善组织氧化应激发挥抗疲劳作用。背部推法改善血液流速、血流形态的同时,可加速体内炎症介质的转运和降解,提高机体的免疫功能,进而促进淋巴细胞转化率,阻碍促炎因子的异常分泌[36]。本研究结果显示,模型组大鼠血清TNF-α、IL-1β、IL-6的含量均高于空白组,提示造模刺激诱发了机体炎症反应。推法组大鼠经干预后,TNF-α、IL-1β、IL-6的含量显著低于模型组,CFS大鼠炎症反应受抑制,疲劳状态得到明显改善,这与既往的临床研究[37]和基础研究[3,14]结果一致。
背部推法除可通过血流调节全身致疲因素外,其机械性刺激还可增加骨骼肌氧的供给,改善肌纤维的营养,减慢肌肉的萎缩,促进已萎缩肌肉的恢复,增强骨骼肌抗疲劳和机体运动能力[38]。本研究结果显示,模型组大鼠竖脊肌中肌纤维平均横截面积、肌纤维平均直径及PGC-1α的含量均显著低于空白组,表明CFS模型大鼠肌纤维缺乏能量供应出现萎缩,直接影响到大鼠的运动行为。推法组大鼠竖脊肌中肌纤维平均横截面积、平均肌纤维直径及PGC-1α的含量显著高于模型组。由此推测背部推法干预可能通过提高CFS 大鼠PGC-1α水平,激活机体抗氧化作用并保障对肌纤维的能量供给,促进肌纤维的修复,从而改善大鼠运动行为。
4 小结
本研究结果表明,背部推法能够改善CFS 大鼠疲劳状态及运动行为,其可能的作用机制涉及以下几个方面:(1)背部推法有抗氧化作用,可提高局部竖脊肌SOD、GSH-Px 水平,调节氧化应激反应,加强CFS 大鼠抗氧化及抗疲劳的能力。同时,背部推法可能通过对局部氧化应激反应的调节作用,减轻机体炎症反应,降低全身TNF-α、IL-1β、IL-6 等促炎因子水平,改善CFS大鼠炎症和疲劳状态;(2)背部推法提高局部竖脊肌SOD、GSH-Px 水平,减轻氧化应激对竖脊肌能量代谢产生的负面影响,并通过提高竖脊肌内PGC-1α含量,改善肌纤维由于高氧化应激、能量供应不足而出现肌肉萎缩的状态,从而改善大鼠运动行为。

