淫羊藿苷调控NLRP3 炎症小体抗脑缺血再灌注损伤机制
曾奇吴雅晨胡茂华笪小云刘杨杨欣邓颖刘明∗
(1. 贵州中医药大学,贵阳 550025;2. 贵州中医药大学中药、民族药药理作用及作用机制研究中心,贵阳 550025)
脑卒中是严重危害我国国民健康的常见心脑血管疾病,是我国成人高致残率及高致死率的首位病因,现患病人数高居世界首位[1]。 其中,缺血性脑卒中的患病人数占全部脑卒中的70% ~80%。缺血性脑卒中发病后,如果错失最佳治疗时机,70%~80%患者会遗有不同程度的认知或运动功能障碍,严重影响患者的生活质量[2]。 现阶段针对缺血性脑卒中的有效治疗为溶栓治疗,快速恢复供血[3],但在此期间由炎症反应引起的脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)严重威胁着患者的预后。
NLRP3 介导的炎症联级反应在缺血再灌注损伤中扮演着极为重要的调控角色。 研究指出,NLRP3 炎症小体一经被激活即能与效应分子pro-Caspase-1 直接结合, 形成炎症小体和成熟的Caspase-1,Caspase-1 在疾病进程中起重要作用[4];Caspase-1 蛋白的激活可促使白介素1β(interleukin-1β,IL-1β)和白介素18(interleukin-18,IL-18)水解释放,引起细胞焦亡,这也是一种细胞死亡,影响急性和慢性脑部疾病发生发展[5]。 因此,通过调控NLRP3 炎症小体及其上下游通路,可能为脑缺血再灌注损伤的研究提供重要依据[6-7]。
淫羊藿,也称仙灵脾,属小檗科植物。 有补肾阳、强筋骨、祛风湿之功,在中国有2000 多年的药用历史。 淫羊藿的化学成分包括黄酮、木脂素、苯酚苷等[8]。 其中,黄酮类成分如淫羊藿苷(icariin,ICA) 是其重要的活性物质[9]。 ICA 分子式C33H40O15,相对分子质量为676.65,研究证实ICA具有抗脑缺血损伤、改善血液流变学抗血栓形成、抗脑衰老及血管性痴呆等作用[10-13]。 课题组前期研究发现ICA 可能通过调控TLR4/NF-κB 信号通路及相关蛋白Bcl-2、Bax、Caspase-3 的表达,改善大鼠脑缺血再灌注后的神经功能缺陷,抑制炎症反应和神经细胞凋亡[10,14]。 但其作用机制是否与调控NFκB 信号通路下游靶点NLRP3 炎症小体有关尚不清楚。 因此,本实验利用线栓法模拟单侧大脑中动脉闭塞(middle cerebral artery occlusion, MCAO),MCAO 闭塞2 h 后取出线栓,造成再灌注损伤,构建CIRI 大鼠模型,观察ICA 对CIRI 大鼠神经功能及病理损伤的影响,测定大脑皮层中炎症小体相关蛋白NLRP3、ASC、Caspase-1、IL-1β、IL-18 的表达,探讨淫羊藿苷治疗大鼠脑缺血再灌注损伤的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
80 只7 周龄SPF 级健康雄性SD 大鼠,体重250 ~280 g,均购于湖南天勤生物技术有限公司【SCXK(湘)2019-0014】,饲养于贵州中医药大学实验动物研究所屏障环境【SYXK(黔)2021-0005】,5 只/笼, 采用12 h 昼夜间断照明,温度为(20 ±2) ℃,相对湿度为(55 ± 5)%,期间自由进食饮水。本动物实验获得贵州中医药大学实验动物伦理委员会批准(20220102)。
1.1.2 主要试剂与仪器
淫羊藿苷(西安欣禄生物科技有限公司,批号YYH20180518,纯度≥98%);苏木素-伊红(HE)染液(均购买于武汉塞维尔生物科技有限公司,批号分别为:ZH202509、CR2011064);丁苯酞软胶囊(石药集团恩必普药业有限公司,批号:20190218);NLRP3,ASC,Caspase-1,IL-1β、IL-18 一抗(美国Affinity 公司, 批号分别为: DF7438, AF5103,AF5418,A13615,A0208);β-actin 内参(abclonal,批号为AC026);羊抗兔二抗(艾博抗(上海)贸易有限公司,批号:ab6721)。
RM2016 型病理切片机,上海徕卡仪器有限公司;BMJ-A 型包埋机,常州郊区中威电子仪器厂;BX51T-PHD-J11 型显微镜,日本Olympus 公司;H2050R 高速低温离心机,湖南湘仪实验仪器厂生产;Image-Pro Plus 多功能真彩色细胞图象分析管理系统,美国Media Cybernetics 公司;DYY-6C 型电泳仪,北京六一生物科技有限公司;IMS-25 制冰机,苏州麦艾仕电器有限公司;Varioska 酶标仪,美国Thermo 公司;MCAO 栓线(250 ~280 g),北京西浓科技有限公司;4-0 带针外科缝线,上海复星医药(集团)股份有限公司淮明医疗器械有限公司。
1.2 方法
1.2.1 动物模型制备及分组
参照文献[10,15]改良制作CIRI 大鼠模型,即:20%乌拉坦腹腔注射(0.6 mL/100 g)麻醉后,在颈部正中略向右侧做1.5 cm 纵向切口,通过温和的钝性分离处理皮下结缔组织和肌肉,精确定位右侧颈总动脉(common carotid artery,CCA),颈外动脉和颈内动脉。 使用缝线对颈外动脉和CCA 近心端进行结扎,CCA 近心端的上部用动脉夹夹闭,CCA 分叉处预留活节(不系紧)缝线固定MCAO 栓线,在动脉夹与CCA 结扎点中间处剪一“V”型小口,插入MCAO 栓线,将栓线从分叉处经颈内动脉缓慢送入18 ~20 mm,缝线外科结固定栓线,阻断大脑中动脉血流2 h 后取出栓线,结扎颈内动脉,缝合。 假手术组仅分离右侧颈总动脉与颈外动脉处理后逐层缝合。 术后24 h,参照LONGA 等[15]评分标准进行神经功能评分,具体操作:肢体活动无异常,计0 分;提大鼠尾部时,不能完全伸展左前爪,计1 分;伴行走时出现向左侧旋转行为,计2 分;发生向左侧跌倒的情况,计3 分;完全不能自由正常活动或无意识表现,计4 分。
选取评分为1 ~3 分的成功模型,随机分为5组, 即模型组 ( Model group )、 丁苯酞组(Butylphthalide group,70 mg/kg)、ICA 高剂量组(ICA-high dose group,80 mg/kg)、ICA 中剂量组(ICA-medium dose group,40 mg/kg)和ICA 低剂量组(ICA-low dose group,20 mg/kg),加上假手术组(Sham operation group)共6 组,每组12 只。 灌胃体积10 mL/kg,每天灌胃给药1 次,连续13 d。 假手术组和模型组给予等容积的生理盐水。
1.2.2 神经功能评分
末次给药1 h 后,按上述方法再次对大鼠进行神经功能评分。
1.2.3 HE 染色法进行病理学观察
每组随机取5 只大鼠,麻醉处死后取大脑,4%多聚甲醛固定48 h 以上,梯度乙醇脱水,石蜡包埋冰冻后,切片4 μm,脱蜡,按试剂盒说明进行HE 染色操作,光学显微镜下观察缺血周围区大脑皮层相同部位视野病理学变化并拍照,计数神经元和完整神经元数目。
1.2.4 免疫组化法测定IL-1β、IL-18 蛋白表达
取“1.2.3”项下大鼠大脑空白切片,在经过脱蜡和脱水后,进行抗原修复。 接着滴加5% BSA 封闭液,随后滴加一抗:抗IL-1β(1 ∶100)、抗IL-18(1 ∶100),最后将切片放置于4 ℃冰箱过夜。 接着滴加生物素标记的二抗,在37 ℃环境中孵育20 min。随后进行PBS 冲洗,滴加SABC,在25 ℃环境中孵育20 min,PBS 洗涤,使用DAB 显色,然后经苏木素复染、分化、封片、晾干处理后,使用光镜进行观察。在随机选择的5 个不重叠缺血周围区大脑皮层视野中,利用IPP 6.0 图像分析系统对阳性着色细胞(胞质及突起内充满棕黄色阳性反应颗粒)进行光密度计数,取得每个样本的平均光密度计数平均值,用以反映大脑皮层IL-1β 和IL-18 蛋白的表达量。
1.2.5 Western Blot 法测定NLRP3、ASC、Caspase-1蛋白表达水平
每组随机选取5 个缺血侧大脑皮层组织,匀浆离心取上清,进行BCA 蛋白定量测定,并于SDSPAGE 凝胶里电泳、转膜、封闭;分别加入一抗NLRP3、ASC、Caspase-1、β-actin(均按1 ∶1000 稀释),4 ℃孵育过夜;TBST 洗涤3 次后加入1 ∶5000羊抗兔二抗室温中速摇晃1 h,再次TBST 洗涤3次,进行显影。 采用Image J 软件对条带进行分析。
1.3 统计学分析
使用SPSS 26.0 软件,所有数据以平均值± 标准差(±s)表示,对多组间的均值进行比较时,采用单因素方差分析(One-way ANOVA),以P<0.05表示差异具有显著性。
2 结果
2.1 大鼠神经功能评分结果
相对于假手术组,模型组大鼠的神经功能评分上升趋势显著(P<0.01)。 与模型组相比,丁苯酞组、ICA 高剂量组、ICA 中剂量组和ICA 低剂量组的神经功能呈下降趋势,其中以ICA 高剂量组和ICA中剂量组的降低最明显(P<0.01,P<0.05),这提示ICA 可能在改善脑缺血再灌注大鼠的神经功能损伤方面具有显著效果。 见图1。
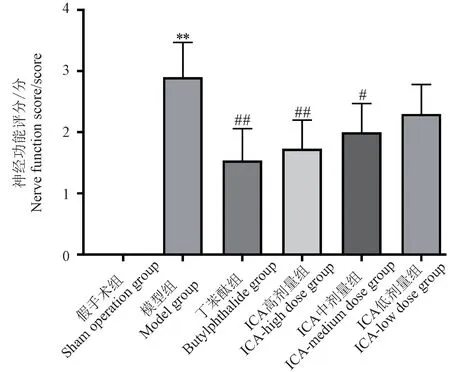
图1 大鼠神经功能评分Note. Compared with sham operation group, ∗∗P <0.01.In contrast to the model group,# P <0.05,## P <0.01.(The same in the following figures)Figure 1 Neurological function score of rats
2.2 大鼠缺血周围区大脑皮层病理表现
假手术组脑组织无缺血性征象,神经元密集,神经元胞浆丰富,淡染,胞核居中,核仁清楚。 模型组的缺血周围区大脑皮层出现为神经元和神经纤维大量发生变性坏死,同时神经元呈稀疏分布。 胞膜胞核轮廓显示不清,胞体皱缩,胞核固缩深染,且神经元脱失现象明显。 与模型组比较,各给药组大鼠缺血周围区大脑皮层正常与坏死细胞相间存在,神经元不同程度坏死或胶质细胞增生。 其中,丁苯酞组及ICA 高剂量组、ICA 中剂量组结构完整可辨的神经元数量较多(P<0.01,P<0.05)。 见图2,图3。
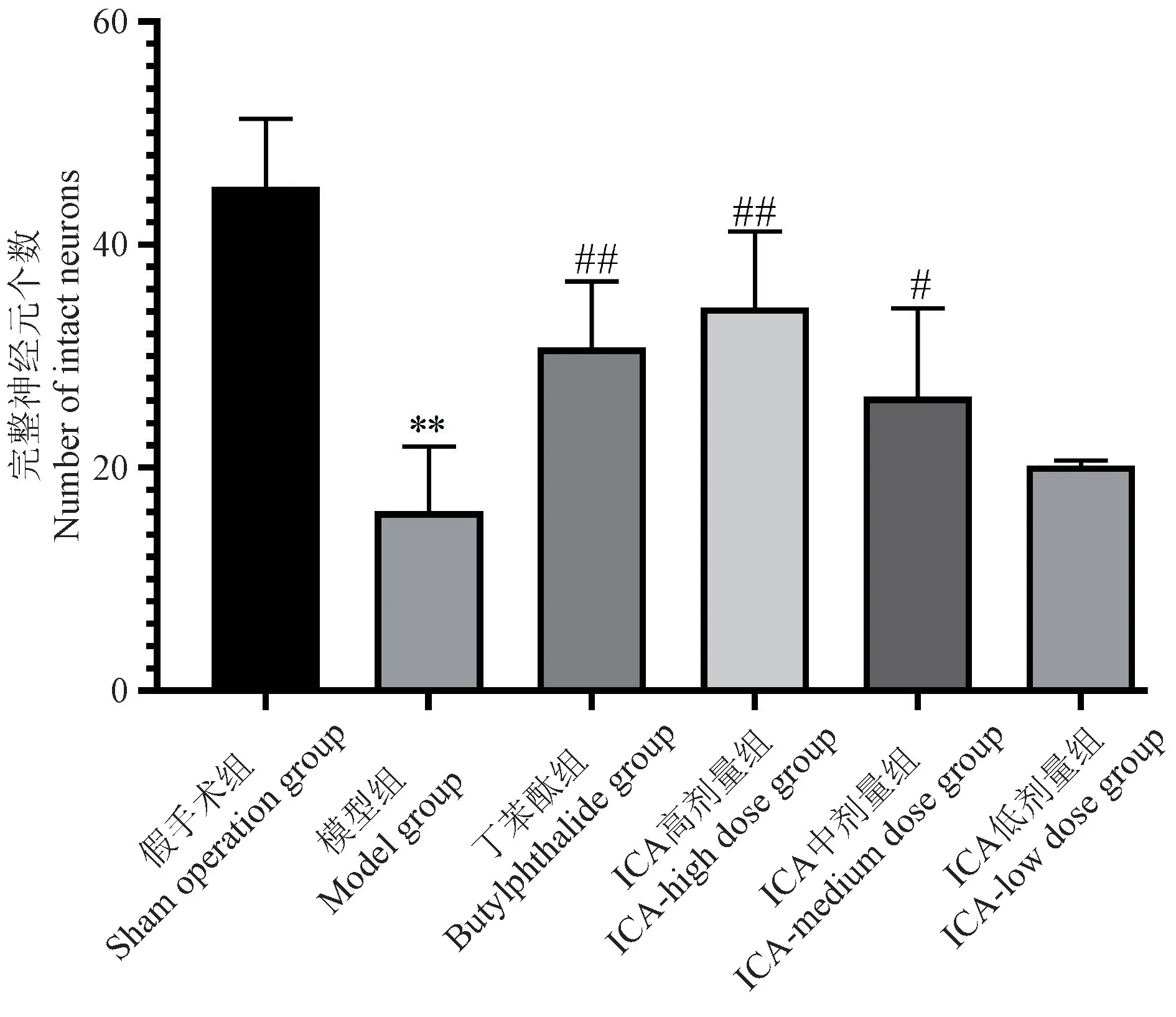
图2 大鼠缺血周围区脑组织完整神经元Figure 2 Intact neurons in ischemic peripheral brain tissue of rats

图3 大鼠缺血周围区脑组织完整神经元Figure 3 Intact neurons in the periischemic brain tissue of rats
2.3 大鼠大脑皮层IL-1β、IL-18 阳性表达结果
IL-1β、IL-18 的阴性细胞呈蓝色,底物呈白色,阳性细胞表现为黄色或棕黄色,其阳性产物主要集中分布在细胞质及细胞间质。 模型组和假手术组相比,大鼠大脑皮层IL-1β、IL-18 阳性表达明显升高(P<0.01)。 与模型组相比,丁苯酞组及ICA 高剂量组、ICA 中剂量组、ICA 低剂量组大鼠大脑皮层IL-1β 阳性均降低,其中以丁苯酞组及ICA 高剂量组下降显著(P<0.01),丁苯酞组和ICA 高剂量组、ICA 中剂量组大鼠大脑皮层IL-18 阳性表达显著降低(P<0.01,P<0.05)。 见图4。
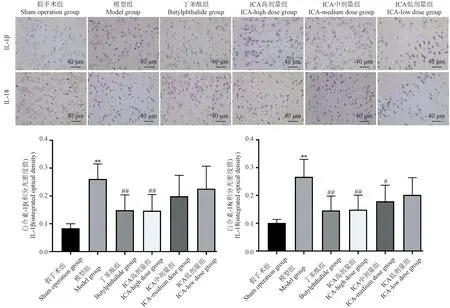
图4 大鼠大脑皮层IL-1β、IL-18 含量检测结果Figure 4 Detection results of IL-1β and IL-18 contents in cerebral cortex of rats
2.4 大鼠大脑皮层NLRP3、ASC、Caspase-1 蛋白表达量
相对于假手术组,模型组大鼠大脑皮层中NLRP3、ASC、Caspase-1 蛋白表达量见显著升高(P<0.01)。 与模型组相比,丁苯酞组和ICA 高剂量组、ICA 中剂量组大鼠大脑皮层中NLRP3、ASC、Caspase-1 蛋白表达均降低明显(P<0.01,P<0.05);ICA 低剂量组Caspase-1 蛋白表达显著降低(P<0.05)。 见图5。

图5 大鼠大脑皮层NLRP3、ASC、Caspase-1 蛋白表达结果Figure 5 Results of NLRP3, ASC, Caspase-1 protein expression in cerebral cortex of rats
3 讨论
根据《中国脑卒中防治报告2021》最新概要报道,我国是卒中发病大国,患病人数居世界首位,卒中是我国成人致死、致残首要病因,严重影响我国居民健康[1]。 缺血性脑卒中在卒中的比例呈逐年升高趋势,即使给与血管内药物溶栓和介入取栓等有效的治疗,诸多患者仍会遗留相关后遗症。 脑缺血再灌注损伤的发生是多机制共同参与的复杂过程,此过程密切相关的因素有氧化应激、钙超载、炎症反应激活及能量代谢异常。 最终这些复杂的生物学变化导致神经元凋亡,不可逆的使神经功能损伤[16-17]。
其中,一系列的炎症联级反应在缺血性脑卒中神经损伤的起重要作用[18]。 缺血性脑卒中发生后,伴随着能量被大量消耗,以及出现神经细胞损伤或死亡,引发脑实质外周循环白细胞浸润,脑组织小胶质细胞和星形胶质细胞活化,触发一系列炎症级联反应,加重外周白细胞浸润和神经细胞的损伤或死亡[19]。 药物在脑缺血再灌注损伤中起神经保护作用的关键机制是促进抑制炎症因子的表达,从而产生抗炎作用。 国内外以往的研究中证实了NLRP3 炎症小体在脑缺血再灌注损伤中的介导作用,同时在脑缺血再灌注的炎症反应中扮演着关键的角色[20-21]。 因此,本实验通过建立大鼠CIRI 模型,探究ICA 对NLRP3 炎症小体的调控作用,进一步研究其对CIRI 的影响机制[22]。
炎症小体是一种分布于细胞浆中的复合物,通过对细胞内外信号刺激的调控,以调节细胞的生理状态。 目前,已陆续发现多个炎症小体家族成员,主要分布在NLRs(nucleotide binding oligomerization domain-like receptors) 家族和 AIM2 ( absentin melanoma 2)家族。 这些家族的成员在感应和调控炎症反应以及维持免疫平衡方面发挥着重要作用。NLRP3 在NLRs 家族中扮演着关键角色,是当前备受关注的炎症小体之一。 NLRP3 炎症小体由NLRP3、ASC 和Caspase-1 前体组合而成的多蛋白复合物[23]。 这一多蛋白复合物在炎症反应调控中发挥关键作用,当NLRP3 炎症小体被激活时,能剪切并活化Caspase-1 前体,生成p20 活性片段,进一步催化促炎因子IL-1β 和IL-18 的形成与成熟,促使排放到细胞外参与炎症反应[23-24]。
本研究旨在深入探讨淫羊藿苷对NLRP3 炎症小体的调控作用,以及其在治疗大鼠脑缺血再灌注损伤中的作用机制。 已有研究显示,在脑缺血再灌注损伤实验中,NLRP3 炎症小体各相关蛋白以及活化产物的表达水平均上升[25],此外,ICA 可以调控NLRP3 炎症小体的激活,进而影响炎症反应[26],也能较好地改善LPS 和IFN-γ 联合诱导的MANF 模型细胞炎症反应,其抑制神经炎症的作用效果明显,其作用机制也与抑制NLRP3 炎症小体及下游相关蛋白表达有关[27]。 本研究结果表明,与假手术组比较,模型组大鼠存在较严重的神经功能缺损,缺血侧大脑皮层病理变化明显,NLRP3 炎症小体相关蛋白表达显著增加。 经过ICA 的治疗后,大鼠脑缺血再灌注后的神经功能缺损和缺血侧大脑皮层病理损伤可显著改善,并降低了缺血侧大脑皮层NLRP3、ASC、Caspase-1、IL-1β、IL-18 蛋白的表达,这表明ICA 能够阻断NLRP3 炎症小体信号通路,抑制炎症反应,改善大鼠神经功能缺陷,从而发挥卒中后的脑保护作用。 本实验研究结果提示,脑缺血再灌注损伤时NLRP3 炎症小体处于被激活状态,ICA 能抑制NLRP3 炎症小体的活化,这可能是其在脑缺血再灌注损伤中发挥神经功能保护的重要机制之一。
综上所述,淫羊藿苷对脑缺血再灌注损伤导致的神经功能缺损症状可有效改善,同时还能减轻大脑皮层神经元病理性损伤,其机制可能与抑制缺血侧大脑皮层中NLRP3 炎症小体,发挥抗炎作用有关。 本实验从神经炎症切入,首次证实淫羊藿苷作用于NLRP3 炎症小体这一新靶点,发挥抗脑缺血再灌注损伤。 需要指出的是,本研究仅初步探索其对脑缺血再灌注损伤大鼠缺血侧大脑皮层NLRP3 炎症小体的影响,作用机制仍有待进一步阐明。 因此,后续实验将深入研究淫羊藿苷抗神经炎症的机制,如淫羊藿苷调控SIRT1/NLRP3 信号通路减轻大鼠脑缺血再灌注炎症损伤的机制,观察其对神经细胞焦亡、自噬的影响。

