西瓜遗传转化体系的优化
李鹏飞 陈子豪 张敏娟 豆峻岭 杨森 刘东明 牛欢欢 杨路明

摘 要:以8種基因型西瓜为试验材料,通过统计不同基因型材料的发芽率、不定芽诱导率,筛选出再生能力较强的基因型,并以其为材料对种子播种后培养时间、外植体造伤方式、菌液浓度、共培养时间及侵染方式等进行优化筛选,旨在建立高效的西瓜遗传转化体系。结果表明,在播种2 d时,YL、CYY298、CYY171及CYY137之间的种子发芽率差异不显著且均显著高于其他材料,但在不同浓度GA3诱导下,YL外植体的不定芽诱导率均最高;以YL材料为基础进行体系优化,发现播种2 d后的种子状态最适于侵染;刀片划伤后的外植体荧光亮度最强,荧光率最高达74.9%;菌液浓度OD600=0.8,共培养时间为3 d时,外植体分化状态最佳且荧光率最高为70.3%;真空负压方式可以显著提高侵染效率,外植体荧光率可达71.8%,愈伤组织诱导率高达60.2%;分化培养基中添加0.5 mg·L-1的GA3后不定芽的诱导率最高为74%;生根培养基中添加0.5 mg·L-1的IBA时生根率最高,平均生根数最多。
关键词:西瓜;遗传转化;转化效率;体系优化
中图分类号:S651 文献标志码:A 文章编号:1673-2871(2024)03-09-11
Optimization of the genetic transformation system in watermelon
LI Pengfei,CHEN Zihao,ZHANG Minjuan,DOU Junling, YANG Sen, LIU Dongming, NIU Huanhuan,YANG Luming
(Horticulture College of Henan Agricultural University, Zhengzhou 450046, Henan, China)
Abstract: In this study, eight watermelon genotypes were used as experimental materials, the germination rates and adventitious buds induction rates of different genotypes were counted and analyzed to screen out the optimal genotype with strong regeneration ability. The efficient watermelon genetic transformation system was optimized and screened through different sowing times, explant injury methods, bacterial liquid concentration, co-culture time, infection methods and other factors. The results showed that the seed germination rates of YL, CYY298, CYY171 and CYY137 had no difference and were significantly higher than that of other materials at 2 days of seeding, but the germination induction rate of YL was the highest at different concentrations of GA3. The system was optimized based on YL material, and it was found that the seed germination state was the best and most suitable for infection after 2 days of sowing. The fluorescence brightness of the explants after scratching the blade was the strongest, and the fluorescence rate was up to 74.9%. When the concentration of bacterial solution was OD600=0.8 and the co-culture time was 3 days, the explants were in the best differentiation state and the fluorescence rate was the highest at 70.3%. The infection efficiency can be significantly improved by negative pressure infection, and the fluorescence rate of explants can reach 71.8%, and the callus induction rate can reach 60.2%. The induction of adventitious shoots was up to 74% after the addition of 0.5 mg·L-1 GA3 to the differentiation medium.The highest rooting rate and the highest average number of roots were observed when 0.5 mg·L-1 of IBA was added to the rooting medium.
Key words: Watermelon; Genetic transformation; Transformation efficiency; System optimization
西瓜(Citrullus lanatus)是最受欢迎的园艺作物之一,因果肉多汁和口感甜美而备受消费者青睐。西瓜栽培历史悠久,地域广泛,近年来随着种植面积和产量的增加,个性化育种需求也在不断增加。高效稳定的遗传转化技术对于改良西瓜品种具有巨大潜力[1]。大量研究表明,西瓜是一种较难进行遗传转化的作物,转化效率低仍是目前阻碍西瓜转基因的主要难题[2]。传统育种方法在西瓜优良性状改良中存在育种周期长、难度大和遗传性状不稳定等问题,因此,利用转基因技术改良西瓜性状尤为重要。尽管转基因技术在许多作物上已取得突破,但在西瓜中的应用进展缓慢且大部分研究仍集中在如何提高转化效率方面。因此,通过优化影响西瓜遗传转化效率的因素,建立高效稳定的西瓜遗传转化体系对创制优良西瓜种质具有重要意义[3]。
植物遗传转化是一种通过将外源基因或DNA片段有目的地插入到受体植物基因组中,通过再生体系诱导获得新植株的技术[4-5]。目前,遗传转化主要使用基因枪法[6-7]、花粉管通道法[8]、DNA浸胚法[9-10]和农杆菌介导法[11-15]等技术手段将外源基因导入植物基因组,以农杆菌介导法最为常用,具有操作简单、转化效率高和遗传稳定性强等特点[16]。农杆菌能够将携带外源基因的Ti质粒上的一段DNA转移到植物细胞中,并整合到植物基因组中以实现表达[17-18]。通过农杆菌侵染,实现了外源基因向植物细胞的转移和整合,进一步利用植物细胞的全能性,通过细胞或组织培养,最终由一个转化细胞再生成完整的转基因植株。通过植物遗传转化技术,可以向西瓜中导入具有抗病性[19]、耐逆性[20]、提高产量和品质[21]等优良性状的外源基因,从而改良或增加西瓜的优异性状。然而,目前西瓜的遗传转化研究仍处于起步阶段,急需进一步优化。
西瓜离体再生能力和转化效率受多种因素的影响,包括种子贮存时间[22]、基因型[23]、苗龄[24]、外植体类型[25-26]和子叶部位[27]等内部因素,以及培养基中激素种类如6-卞基腺嘌呤(6-BA)、萘乙酸(NAA)、吲哚丁酸(IBA)和浓度[24,28]、预培养时间[28]、共培养条件[29-30]等外部因素。笔者以8个基因型西瓜为试验材料,通过统计不同基因型种子的发芽率、不定芽诱导率,最终筛选出YL为最优受体材料。以YL材料为基础,通过对培养基中激素浓度、侵染方式、外植体造伤方式、菌液浓度、共培养时间等条件进行优化,筛选出高效且稳定的西瓜遗传转化体系,以期为西瓜基因功能研究及优良种质创制提供技术支持。
1 材料与方法
1.1 材料及地点
供试西瓜材料共8种,分别为YL、M08、CYY171、CYY298、CYY137、WT2、WT4和WT8。其中YL、M08由西北农林科技大学李征教授实验室馈赠;WT2、WT4、WT8是由河南农业大学瓜类作物基因组与分子育种实验室从商品种中经多代自交分离纯化的自交系,CYY171、CYY298、CYY137是由河南豫艺种业科技发展有限公司谭慧明老师提供的育种材料。
试验于2021年9月至2022年4月在河南农业大学园艺学院瓜类作物基因组与分子育种实验室进行。
1.2 培养基配方及方法
1.2.1 培养基配方 播种培养基:6.7 g 琼脂粉溶解于1 L超纯水。侵染液:4.43 g MS 519,30 g蔗糖,溶解于1 L超纯水,加入6-BA(终质量浓度1.5 mg·L-1),调pH至5.8~6.0。共培养培养基:4.43 g MS 519,30 g蔗糖,溶解于1 L超纯水,加入6-BA(終质量浓度1.5 mg·L-1),调pH至5.8~6.0。分化培养基:4.43 g MS 519,30 g蔗糖,溶解于1 L超纯水,加入6-BA(终质量浓度1.5 mg·L-1),调pH至5.8~6.0,加入特美汀(终质量浓度200 mg·L-1)。芽伸长培养基:4.43 g MS 524,30 g蔗糖,1 g肌醇,500 μL SH有机溶剂(0.5 g烟酸、0.5 g维生素B1、0.05 g维生素B6溶解于500 mL无菌水),溶解于1 L超纯水,分别加入6-BA(终质量浓度0.1 mg·L-1)、NAA(终质量浓度0.1 mg·L-1),调pH至5.8~6.0,加入特美汀(终质量浓度200 mg·L-1)。生根培养基:4.43 g MS 519,30 g蔗糖,溶解于1 L超纯水,调pH至5.8~6.0,加入特美汀(终质量浓度200 mg·L-1)。除播种培养基及侵染液外,其余培养基均需调pH后加入7 g·L-1的琼脂粉以使培养基凝固;所有培养基均须在121 ℃下灭菌20 min。
1.2.2 种子处理及发芽率统计 挑选饱满健康的西瓜种子,用适量55 ℃的无菌水浸种30 min后剥去外种皮,置于无菌三角瓶后移至超净工作台,先用75%乙醇浸泡30 s,无菌水冲洗2~3次;再用5%次氯酸钠浸泡10 min(期间不断摇晃),无菌水清洗4~5次,置于播种培养基上,放于28 ℃恒温培养箱进行暗培养。每个西瓜材料设置3个重复,每个重复40粒种子,播种2 d后观察每个基因型材料的发芽状态,并分别统计发芽率,待种子下胚轴伸长至1~2 cm并有根毛长出时,获得外植体并进行不定芽诱导。
发芽率/%=发芽种子数/种子总数×100。 (1)
1.2.3 不定芽的诱导培养 将上述8种适于不定芽诱导的西瓜种子,用无菌刀片于超净工作台上将子叶远胚轴端,胚轴及子叶近胚轴端的部分组织切去(图1-Ⅰ),将剩余部位的上下两片子叶均匀切成12个外植体(图1-Ⅱ),将外植体接种至含有不同赤霉素(GA3)质量浓度梯度(0、0.5、1.0、1.5和2.0 mg·L-1)的分化培养基上,在正常光周期(28 ℃,光照16 h·d-1,黑暗8 h·d-1,光照度3000 lx)条件下进行不定芽的诱导。每个处理设置3个重复,每个重复接种100个外植体,每个培养皿接种10个外植体。14 d后继代一次,28 d后观察出芽情况并统计不定芽的诱导率,根据结果筛选出再生能力最佳的基因型和不定芽诱导率最高时的GA3浓度。
不定芽诱导率/%=产生不定芽的外植体个数/接种外植体个数×100。 (2)
1.2.4 种子播种后培养时间的筛选 以筛选出的最佳基因型材料为基础,比较种子在不同播种时间后(第1、2 、3 、4天)的发芽状态及外植体的不定芽诱导率。每个培养时间设置3个重复,每个重复接种100个外植体,外植体放置在分化培养基上进行培养,14 d后继代一次,28 d后统计不定芽诱导率,根据结果筛选出最适宜的种子培养时间。
1.2.5 不定根的诱导及生根率的统计 不定芽诱导28 d后,在超净工作台上将生长状态较好的不定芽转移至芽伸长培养基中,待不定芽伸长至2~3 cm时,将其转移至生根培养基中诱导生根。设置添加IBA质量浓度梯度为0、0.5、1.0、2.0 mg·L-1的处理,每个处理3次重复,每个重复10个不定芽,培养20 d后观察生根情况并统计生根率。
生根率/%=生根的不定芽数/总不定芽数×100。 (3)
1.2.6 菌液浓度及共培养时间筛选 将用于侵染的菌株接种至含有相应抗性的YEB液体培养基中,于28 ℃、230 r·min-1的摇床中过夜培养,用紫外分光光度计检测菌液浓度。设置菌液浓度OD600为0.5、0.8、1.0共3个浓度梯度,同时设置共培养2、3、4 d,3个共培养时间,将以上3个浓度梯度与3个共培养时间相互组合成9组处理(A-I),每个处理3个重复,每个重复120个外植体,置于分化培养基5 d后统计外植体荧光率,采用购自上海路阳仪器有限公司(型号:LUYOR-3415RG)的手持荧光仪进行外植体荧光的筛选,外植体有荧光的计入统计,通体无荧光的不计入统计。根据荧光率筛选最适的菌液浓度和共培养时间。
外植体荧光率/%=荧光外植体数/总外植体数×100。 (4)
1.2.7 外植体造伤方式筛选 以筛选出的最佳基因型材料、种子培养时间、菌液浓度和共培养时間为基础,对获得的外植体进行不同造伤处理,分别采用CK处理(不进行造伤)、刀片划伤(用无菌刀片在外植体表面轻划3刀)以及纳米刷造伤(用纳米刷在外植体表面刷3次)3种处理方式。每个处理3个重复,每个重复120个外植体,并在侵染后观测外植体荧光率和分化状态。荧光强度以“+”表示,“+”越多表示荧光越强。
1.2.8 侵染方式的筛选 进一步以筛选出的最佳基因型材料、种子培养时间、菌液浓度和共培养时间、外植体造伤方式为基础,分别选择浸泡侵染、真空负压侵染和超声波辅助侵染3种方式,每个处理3次重复,每个重复120个外植体,共培养后置于分化培养基5 d后统计外植体的荧光率及愈伤组织诱导率。
愈伤组织诱导率/%=产生愈伤组织的外植体数/总外植体数×100。 (5)
1.3 数据统计与分析
利用Excel 2019进行试验数据统计与作图,采用SPSS 26.0进行差异显著性分析。
2 结果与分析
2.1 不同基因型西瓜材料发芽率及发芽状态对比
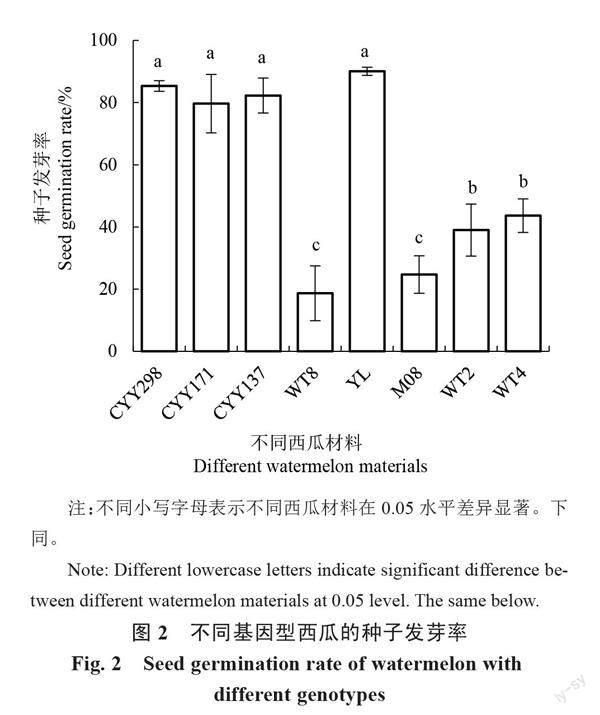
以8个基因型西瓜为研究对象,每个基因型3个重复,每个重复40粒西瓜种子,统计发芽率(图2),并观察播种培养2 d后的发芽状态(表1)。结果表明,YL、CYY298、CYY171及CYY137基因型之间的发芽率差异不显著,分别为90.1%、85.3%、79.7%和82.3%,但均显著高于其他材料;WT8和M08的种子发芽率最低,仅为18.7%和24.7%,显著低于其他材料;WT2和WT4居中,分别为39.0%和43.6%。发芽状态的观察结果表明,CYY298和YL均可发芽且均有根毛出现以及胚根的伸长;CYY171和CYY137的萌发状态无差异,基本均可发芽且根毛出现并有部分胚根伸长;WT8、M08、WT2和WT4在第2天时的状态整体较差,除M08有少部分根毛出现外,其余3种基因型均无根毛的出现以及胚根的伸长。由以上结果可知,YL和CYY298整体的发芽率及发芽状态较好,适合选为再生材料。
2.2 不同GA3浓度对不同基因型西瓜不定芽诱导的影响
不同GA3浓度对8个不同基因型西瓜不定芽诱导的影响如图3所示,在不同GA3浓度下YL的不定芽诱导率均远高于其他基因型,CYY298次之;8个基因型西瓜在0.5 mg·L-1 的GA3浓度下不定芽诱导效果均最佳,YL的诱导率最高为74%,CYY298次之,但仅为45%。随着GA3浓度的升高,8个基因型西瓜的不定芽诱导率均呈先上升后下降的变化趋势。由此可知,添加一定浓度的GA3可以促进不定芽的诱导,而YL的不定芽诱导率远高于其他基因型材料,因此更适合作为再生材料。
2.3 不同基因型对不定芽诱导的影响
笔者进一步通过在分化培养基中添加0.5 mg·L-1的GA3,观察外植体在分化培养1周后的状态(图4-Ⅰ),并统计外植体诱导28 d后的不定芽诱导率(图4-Ⅱ),探究相同GA3浓度下不同基因型的不定芽诱导能力。结果表明,在分化培养1周后,不同基因型外植体的分化状态不同,YL在分化1周后诱导出浅绿色愈伤组织,且形态致密紧凑,分化状态最佳;CYY298、CYY171及CYY137次之,WT8、WT2及WT4的外植体虽然有膨大但效果不及CYY298、CYY171和CYY137;M08的外植体分化效果最差,整体呈现淡黄色,边缘愈伤组织分化也不明显。不定芽诱导率的结果表明,YL早期的外植体分化状态最佳,后续的不定芽诱导率也最高,达75.0%,显著高于其他基因型材料;CYY298和CYY171的诱导率次之,分别为41.7%和43.0%,两者的差异不显著;M08早期外植体的分化效果虽然最差,但后续的不定芽诱导率与CYY137之间无差异,且均显著高于WT8、WT2;8种基因型中WT8和WT2的不定芽诱导率最低,仅为17.0%和21.0%。
由以上结果可知,不同基因型材料的再生能力存在差异,播种2 d后种子的发芽率、不同GA3浓度对不定芽诱导率,以及不同基因型之间不定芽诱导率的统计结果综合分析,发现8种基因型材料中YL是最适合的再生材料,可作为遗传转化体系优化的受体材料。
2.4 种子播种后培养时间对不定芽诱导的影响
以YL为研究对象,设置4个种子播种后培养时间(第1、2、3、4天),观察种子萌发状态(图5-Ⅰ)并获取外植体后,分别接种至分化培养基,培养28 d后统计不定芽诱导率(图5-Ⅱ)。结果表明,播种培养1 d后,仅有少数种子的下胚轴开始伸长,并且不定芽诱导率也较低,为36.7%;播种培养2 d后,除极个别種子外,下胚轴均伸长至1~2 cm,此状态下的外植体不定芽诱导率最高,可达74.6%;播种3 d后,少数种子的两片子叶展开,下胚轴已伸长至3 cm左右,不定芽的诱导率下降至46.9%;播种4 d后,种子的胚根已伸长超过6 cm,根毛大量分化,2片子叶呈现嫩黄、展开的状态,不定芽的诱导率最低,仅为27.5%。由此可知,播种2 d后的种子最适宜于后续不定芽的诱导。
2.5 不同IBA浓度对生根效果的影响
以播种2 d后的YL为研究对象,通过观察生根状态(图6-I)、统计每个不定芽的平均生根数量(表2)以及统计生根率(图6-II),探究不同IBA浓度对生根效果的影响。结果表明,IBA质量浓度为0.5 mg·L-1时,生根率最高为72.4%,平均生根数量最多,为6.3个,且根系健壮并有须根产生;随着IBA质量浓度增加,不定芽生根率降低,平均生根数量减少,IBA质量浓度为1.0 mg·L-1时,生根率为59.6%,平均生根数量4.3个;IBA质量浓度为2.0 mg·L-1时,其生根率仅为14.4%,平均生根数量为1.8个。综上,较高质量浓度的IBA处理会抑制不定芽生根,IBA质量浓度为0.5 mg·L-1时生根效果最佳。
2.6 不同菌液浓度和共培养时间对转化效率的影响
以YL为研究对象,将3个菌液浓度梯度(OD600为0.5、0.8、1.0)与3个共培养时间(2、3、4 d)共设置成9组处理(A~I),观察5 d后外植体的生长状态(表3)并统计荧光率(图7),探究菌液浓度和共培养时间对转化效率的影响并对其生长状态进行观察。
结果表明,当共培养时间为2 d时,OD600=0.8和1.0时的外植体生长状态良好,且荧光率之间无显著差异,分别为46.1%和44.6%,均显著高于OD600=0.5的荧光率;共培养3 d,OD600=0.8时的外植体生长状态及荧光率均最高,荧光率达70.3%,显著高于OD600=0.5和1.0时的荧光率;共培养4 d时,OD600=0.5,0.8和1.0时的荧光率分别为47.4%,60.2%和21.4%,虽然OD600=0.8时的荧光率最高,但部分外植体边缘已有菌液溢出;在9组处理中,共培养4 d,OD600=1.0时的荧光率最低,外植体分化状态也最差。因此,最适合的菌液侵染浓度为OD600=0.8,最适宜的共培养时间为3 d,此时的外植体分化状态较好且荧光率也最高。
2.7 不同造伤方式对转化效率的影响
以YL为研究对象,在播种后培养2 d,菌液浓度OD600为0.8、共培养时间为3 d时,设置3种外植体造伤方式,通过观察外植体分化状态(表4)并统计荧光率(图8),探究不同造伤方式对转化效率的影响。
结果表明,在CK处理下,外植体正常膨大,但后续边缘仅有部分区域诱导出芽,外植体荧光率为59.7%;纳米刷造伤处理后,虽然造伤处的荧光信号加强,但外植体表面分化白色愈伤,后期不定芽分化缓慢,但荧光率达到65.2%,高于CK;刀片划伤处理后,外植体在共培养阶段膨大较好且边缘呈现绿色的愈伤组织,外植体荧光率也最高,可达74.9%。综上可知,采用刀片划伤外植体的方式可以进一步提高转化效率,且不会影响外植体再生状态。
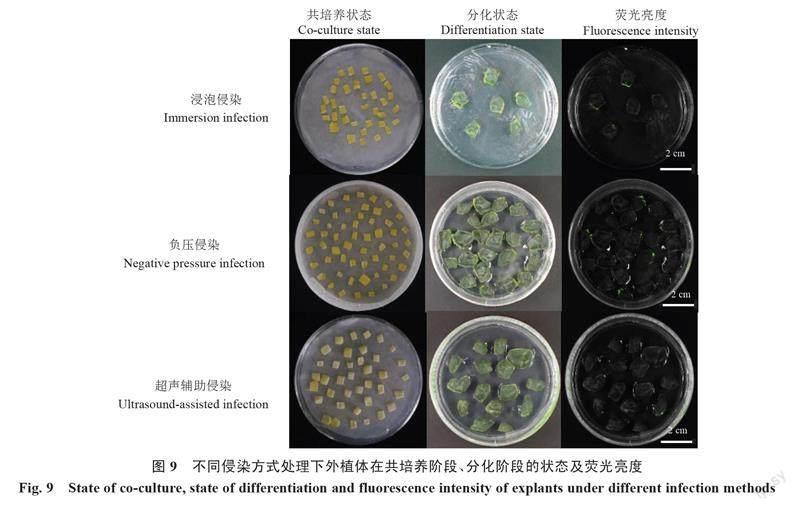
2.8 不同侵染方式对转化效率的影响
以播种培养2 d后的YL为研究材料,在菌液浓度OD600=0.8、共培养时间为3 d的优化体系下,设置3种侵染方式,分别观察外植体的分化状态,统计荧光率和愈伤组织诱导率(表5),探究不同侵染方式对转化效率的影响。结果表明,在浸泡侵染下,外植体在共培养后的荧光率最低,仅为30.6%;在负压侵染处理下,外植体的荧光率和愈伤组织诱导率均最高,分别为71.8%和60.2%;超声辅助侵染后外植体荧光率显著高于浸泡侵染处理,但显著低于负压侵染,而愈伤诱导率最低,仅为33.6%。此外,在植物活体成像仪观察下发现,负压侵染处理后外植体膨大状态及分化状态均较好且荧光更亮(图9)。综上可知,负压侵染为最佳侵染方式,可以有效提高转化效率。
3 讨论与结论
植物遗传转化是转基因及以转基因技术为基础的基因组编辑、功能基因组研究以及分子设计育种的关键。相对于基因组学和基因编辑技术的迅速发展,转基因技术中再生体系的优化和建立成为目前限制功能基因组学快速发展的瓶颈。影响植物离体器官再生的主要因素有基因型、外植体部位和植物生长调节剂等[31]。目前对西瓜遗传转化的研究虽然已有报道,但外植体再生效率低,以及遗传转化体系的不稳定仍是制约其在西瓜中高效利用的主要因素[32]。
基因型是目前制约西瓜高效遗传转化的关键因素之一,极大地影响着外植体的再生能力。笔者以8种不同西瓜基因型材料为基础,通过对比8种材料在相同时间内种子的萌发速率,外植体产生不定芽的速率,发现不同基因型之间存在较大差异,但综合对比发现,YL的表现最佳,最适宜于作为西瓜遗传转化的受体材料。试验结果表明,YL种子在播种培养后的第2天即可达到适于后续不定芽再生的最佳状态;在分化早期阶段,外植体边缘可形成浅绿色愈伤组织,并且该状态的愈伤组织在后期也表现出最好的再生能力,而其余基因型材料在分化早期,边缘形成愈伤组织的能力均弱于YL,这也可能是其后期不定芽诱导率显著低于YL的原因。除了基因型的差异影响不定芽再生之外,目前也有研究表明,通过在转化载体中添加不定芽再生促进基因,可以显著提高转化效率。Debernardi等[33]发现过表达小麦生长调节因子GRF4和GIF1组成的嵌合蛋白提高了小麦再生效率和再生速度,同时增加了可转化小麦基因型的数量;潘文波等[34]发现在西瓜中共表达AtGRF5和AtGIF1可以显著提高西瓜遗传转化效率;冯琴等[35]通过在转化载体中过表达内源嵌合基因ClGRF4和ClGIF1,在西瓜中实现了高效的、不依赖基因型的遗传转化。因此,笔者所优化的遗传转化体系,可在后续的试验中同时融合不定芽再生促进基因,以获得更高的遗传转化效率。此外,在后续研究中还可以通过继续探究不同生长调节因子对转化效率的影响,以期获得完全不依赖基因型的高效西瓜遗传转化体系。
除基因型的影响因素外,适宜的激素浓度也是提高不定芽诱导率的关键,与宋道军等[36]在诱导不定芽阶段使用的激素不同,笔者通过在分化培养基中添加适宜质量浓度的GA3,有效提高了外植体分化效率,并且还发现GA3诱导不定芽的再生存在剂量效应,0.5 mg·L-1时的诱导效果最佳,结果可为探究GA3对其他作物外植体不定芽诱导的影响提供参考。此外,研究还发现不同播种天数的西瓜种子,外植体不定芽诱导率之间差异显著。笔者采用播种后2 d的西瓜YL材料,获得了较高的不定芽诱导率,相较于赵彩萍等[37]认为苗龄4~5 d时子叶诱导率最高的结果缩短了1~2 d的播种时间。在诱导生根阶段,笔者通过在生根培养基中添加0.5 mg·L-1的IBA有效提高了不定芽生根速率及生根数目,研究结果与刘静等[38]使用0.4 mg·L-1的IBA诱导不定芽生根的结果略有差异,可能是由于所用西瓜基因型不同,但也由此表明适宜浓度的IBA才可更好地诱导西瓜不定芽生根。
农杆菌菌液浓度和共培养时间也是目前植物遗传转化体系优化中重点关注的因素,菌液浓度过低则影响外植体的侵染效率,而菌液浓度过高时外植体周围极易出现溢菌现象。笔者研究认为,农杆菌菌液浓度为OD600=0.8且共培养时间为3 d时,荧光效率较高,与张志忠等[39]的研究结果一致。造伤处理外植体可以通过增加菌液附着在外植体上的概率,进而影响侵染效率。笔者在本研究中共采用了3种造伤方式处理外植体,发现刀划造伤处理下的侵染效率最高。虽然已有研究表明,纳米刷造伤处理外植体可以获得较高的转化效率,但在本研究中发现,经纳米刷处理后的外植体虽然在短时间内具有较高的荧光率,但随着培养时间的延长荧光亮度逐渐减弱,并且在分化后期边缘易产生白色愈伤组织,极大地影响了后期不定芽的再生能力。不同侵染方式对西瓜转化效率也有影响,相较于直接浸泡侵染和超声辅助侵染,通过负压侵染處理外植体,可以获得较高的转化效率,可能是由于真空负压状态下,外植体细胞壁更加松弛,进而提高了转化效率。超声辅助侵染后,外植体虽然有较高的荧光率,但愈伤组织诱导率下降,这可能与超声处理后外植体在一定程度上受损有关,后续可进一步通过优化超声波的强度和时间继续探索其对转化效率的影响。
综合以上试验结果,笔者发现选用YL作为受体材料,种子播种2 d后,外植体在添加0.5 mg·L-1GA3的培养基中不定芽的诱导率最高;YL诱导出的不定芽在IBA质量浓度为0.5 mg·L-1时生根效果最佳;采用负压侵染与刀划造伤外植体相结合的方式,菌液浓度OD600=0.8且共培养3 d时的外植体荧光率最高。
参考文献
[1] 黄华宁,杨小振,马建祥,等.中国西瓜遗传育种研究进展[J].北京农业,2014(12):22-26.
[2] 赵小强,牛晓伟,范敏.农杆菌遗传转化西瓜的影响因素及应用研究进展[J].浙江农业学报,2016,28(1):171-178.
[3] 陈磊,庞晓虹,刘宏宇.西瓜组织培养及遗传转化的研究进展[J].北方园艺,2009(2):136-140.
[4] 周宇晴,任豆.再生体系及农杆菌介导的遗传转化体系的构建[D].广州:华南农业大学,2018.
[5] 李君,李岩,刘德虎.植物遗传转化的替代方法及研究进展[J].生物技术通报,2011(7):31-36.
[6] 任春梅,董延瑜,洪亚辉,等.基因枪介导的西瓜遗传转化研究[J].湖南农业大学学报(自然科学版),2000,26(6):432-435.
[7] SURATMAN F,HUYOP F,WAGIRAN A,et al.Biolistic transformation of Citrullus vulgaris Schrad (Watermelon)[J].Biotechnology,2010,9(2):119-130.
[8] CAO S,NIU J,CAO Q,et al.Transformation of the rolB gene via the pollen-tube pathway to obtain transgenic pomegranate plants[J].Acta Horticulturae,2019,1245:19-26.
[9] 刘传雪,潘国君,张淑华,等.应用浸胚法转化寒地水稻的试验研究[J].北方水稻,2009,39(2):8-11.
[10] 丁锦平.用浸胚法将大豆DNA导入番茄初步研究[J].广东农业科学,2013,40(21):131-135.
[11] BATES R,CRAZE M,WALLINGTON E J.Agrobacterium-mediated transformation of oilseed rape (Brassica napus)[J].Current Protocols in Plant Biology,2017,2(4):287-298.
[12] TABEI Y,YAMANAKA H,KANNO T.Adventitious shoot induction and plant regeneration from cotyledons of mature seed in watermelon(Citrullus lanatus L.)[J].Plant Tissue Culture Letters,1993,10(3):235-241.
[13] WU H W,YU T A,RAJA J A,et al.Generation of transgenic oriental melon resistant to Zucchini yellow mosaic virus by an improved cotyledon-cutting method[J].Plant Cell Reports,2009,28(7):1053-1064.
[14] BEZIRGANOGLU I,HWANG S Y,SHAW J F,et al.Efficient production of transgenic melon via Agrobacterium-mediated transformation[J].Genetics and Molecular Research,2014,13(2):3218-3227.
[15] 王平勇,徐永阳,赵光伟,等.发根农杆菌介导西瓜转基因过表达体系的建立[J].果树学报,2019,36(12):1763-1770.
[16] 熊换英,钟伟光,张寿文.农杆菌介导的植物遗传转化影响因素研究进展[J].安徽农业科学,2012,40(17):9214-9217.
[17] 李文砚,孔方南,卢艳春,等.农杆菌介导的草莓遗传转化研究进展[J].黑龙江农业科学,2016(3):143-146.
[18] 高佩,尹锐,林彦萍,等.农杆菌介导的番茄遗传转化研究进展[J].北方园艺,2016(14):192-197.
[19] PARK S M,LEE J S,JEGAL S,et al.Transgenic watermelon rootstock resistant to CGMMV(Cucumber green mottle mosaic virus)infection [J].Plant Cell Reports,2005,24(6):350-356.
[20] 孙治图.农杆菌介导的甜菜碱基因转化西瓜的初步研究[D].重庆:西南大学,2008.
[21] 常尚連.西瓜糖代谢及甜瓜酸性转化酶反义基因的西瓜遗传转化[D].山东泰安:山东农业大学,2006.
[22] 王果萍,刘剑华,高平平,等.贮存时间对西瓜种子活力的影响[J].山西农业科学,1998(4):56-59.
[23] 孙治图,许勇,张海英,等.西瓜离体再生高效基因型材料的筛选[J].中国瓜菜,2008(3):5-9.
[24] YU T A,CHIANG C H,WU H W,et al.Generation of transgenic watermelon resistant to Zucchini yellow mosaic virus and Papaya ringspot virus type W[J].Plant Cell Reports,2011,30(3):359-371.
[25] 秦新民,张丽珍,李文兰.西瓜高效再生系统的研究[J].广西师范大学学报(自然科学版),2003,21(2):75-78.
[26] 董焱,张洁,张海英,等.西瓜未成熟胚高效再生体系的建立[J].中国瓜菜,2014,27(3):10-13.
[27] 万勇,张铮,刘红梅,等.西瓜组织培养快速繁殖的初步研究[J].江西农业学报,2002,14(4):47-50.
[28] CH M A,MOON C Y,LIU J R,et al.Agrobacterium-mediated transformation in Citrullus lanatus[J].Biologia Plantarum,2008,52:365-369.
[29] 刘丽锋.西甜瓜转基因抗病毒研究[D].武汉:华中农业大学,2015.
[30] SRIVASTAVA D,ANDRIANOV V,PIRUZIAN E.Tissue culture and plant regeneration of watermelon (Citrullus vulgaris Schrad. cv. Melitopolski)[J].Plant Cell Reports,1989,8(5):300-302.
[31] 王團团,缑晨星,夏磊,等.黄瓜10个基因型材料外植体内源激素水平及比例对其离体再生的影响[J].园艺学报,2021,48(9):1731-1742.
[32] 张曼,徐锦华,刘广,等.西瓜‘SM1高效遗传转化体系的构建[J].分子植物育种,2021,19(2):498-503.
[33] DEBERNARDI J M,TRICOLI D M,ERCOLI M F,et al.A GRF-GIF chimeric protein improves the regeneration efficiency of transgenic plants[J].Nature Biotechnology,2020,38(11):1-6.
[34] PAN W,CHENG Z,HAN Z,et al.Efficient transformation and genome editing of watermelon assisted by genes that encode developmental regulators [J].Cold Spring Harbor Laboratory,2022,23(4):339-344.
[35] FENG Q,XIAO L,HE Y,et al.Highly efficient, genotype-independent transformation and gene editing in watermelon(Citrullus lanatus)using a chimeric ClGRF4-GIF1 gene [J].Journal of Integrative Plant Biology,2021,63(24):2038-2042.
[36] 宋道军,陈若雷,尹若春,等.西瓜高效组织培养再生体系的初步研究[J].中国西瓜甜瓜,2000,13(4):8-11.
[37] 赵彩萍,王荣华,张治平,等.西瓜植株再生优化体系的研究[J].安徽农业大学学报,2009,36(2):303-308.
[38] 刘静,赵强,王旭英,等.西瓜高效离体培养再生植株的研究[J].北方园艺,2012(4):108-110.
[39] 张志忠,吴菁华,吕柳新.西瓜高频再生系统的研究[J].中国农学通报,2004,20(2):151-153.
收稿日期:2023-10-10;修回日期:2024-01-04
基金项目:河南省科技研发计划联合基金(222103810009);河南省重大科技专项(221100110400);河南省农业良种联合攻关项目(2022010503)
作者简介:李鹏飞,男,在读硕士研究生,研究方向为蔬菜遗传育种。E-mail:2275147174@qq.com
通信作者:牛欢欢,女,讲师,研究方向为蔬菜遗传育种。E-mail:niuhh@henau.edu.cn
杨路明,男,教授,研究方向为蔬菜遗传育种。E-mail:lumingyang@henau.edu.cn

