比较两种固定液过度固定乳腺癌组织对FISH法检测HER2基因的影响
缪 琛,贺 骁,韩 雪,宋国新
FISH技术常用于检测和定位染色体上特定的DNA序列[1],有利于病理鉴别诊断[2]、指导临床靶向用药[3]和监测肿瘤的复发[4]。组织标本的前处理对确保临床检验结果的准确性尤为重要,固定是组织处理中最重要的环节,也是整个制片过程中最无法补救的一步[5],组织过度固定或固定不足均会对检测结果造成影响[6]。乳腺癌穿刺样本,在离体后即加入固定液中保存,由于周末节假日等原因,部分样本未能及时送至病理科,穿刺组织体积较小易出现固定过度,在制片中常存在消化难和杂交背景亮等问题。本科室在日常工作中摸索一种环保固定液在组织过度固定的情况下,比经10%中性福尔马林液过度固定组织染色效果好,现报道如下。
1 材料与方法
1.1 临床资料收集2023年5~6月我院病理科非特殊类型浸润性乳腺癌30例标本,每例取大小2 mm×2 mm×5 mm的细长条状癌组织2条,模拟乳腺穿刺组织,随机分成2组,其中一组采用10%中性福尔马林液固定,另一组采用环保固定液固定(南京天优生物公司),分别固定72 h。
1.2 HE染色标本均经二甲苯、梯度乙醇脱蜡至水;苏木精染细胞核,1%盐酸乙醇分化数秒,饱和碳酸锂水溶液返蓝;伊红着染细胞质,梯度乙醇脱水,二甲苯透明,中性树胶封固,镜检。依据《临床技术操作规范·病理学分册》中的质控评分标准,对病理切片进行质量分级评定(表1)。
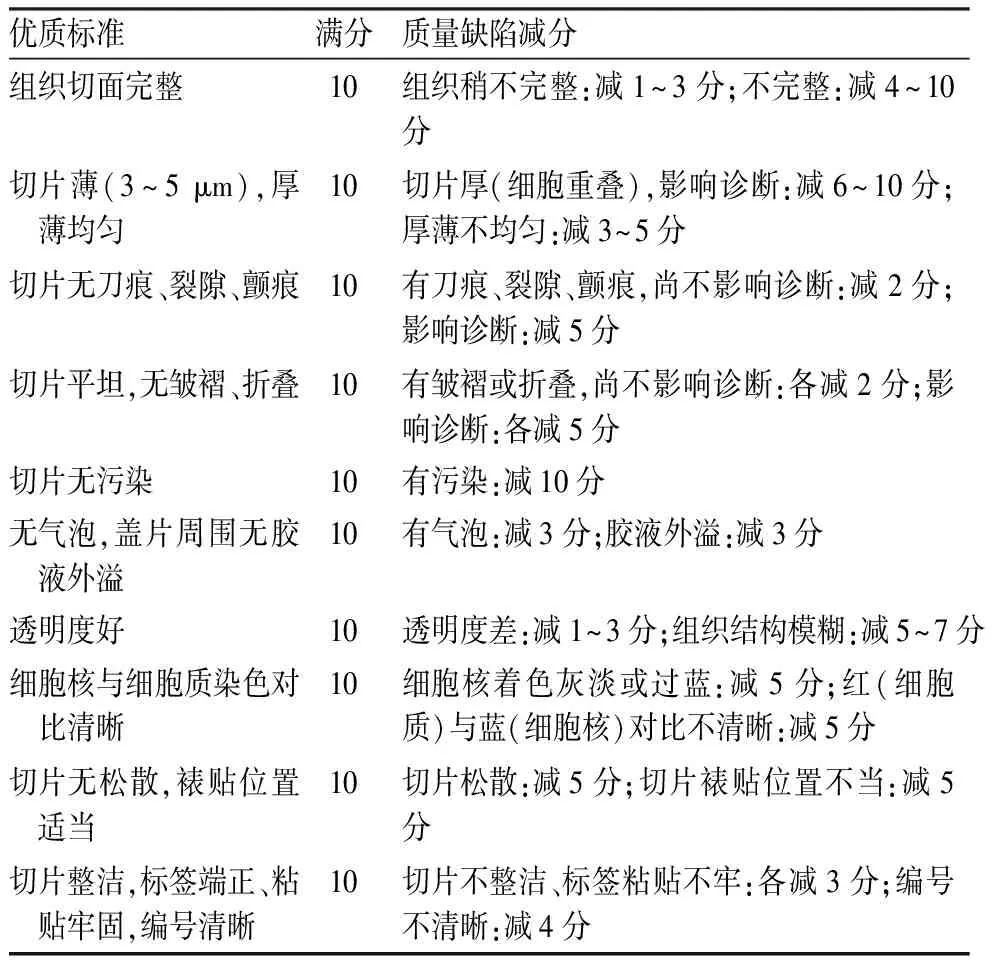
表1 病理常规石蜡包埋HE染色切片质量评分标准
1.3 FISH法(1)切片:石蜡组织固定后,脱水包埋,切片3~4 μm厚,置于防脱载玻片上。(2)烤片和脱蜡:70 ℃ 烤片1 h以上,再依次脱蜡至水。(3)修复:水浴煮沸25 min。(4)消化:胃酶工作液(2.5 mg/mL)于水浴锅中37 ℃统一消化1 min。(5)洗片:将玻片置于2×SSC溶液中室温漂洗2次,每次5 min;将玻片依次置于70%、85%、100%梯度乙醇中脱水各3 min,自然晾干。(6)添加探针:配置HER2基因探针(北京金菩嘉公司),移液器吸取10 μL滴于组织上,用盖玻片封固。(7)变性和孵育:杂交仪上经83 ℃变性10 min,于37 ℃过夜孵育。(8)洗片和复染:次日取出玻片,轻轻取下盖玻片,防止损伤组织,70 ℃置于0.4×SSC溶液2 min;室温2×SSC漂洗2 min后,置于70%乙醇溶液3 min,并于暗处自然晾干;每张切片加15 μL的DAPI复染,暗处静置10 min后在荧光显微镜下阅片。
1.4 FISH消化时间验证依照以上FISH实验方法,将经10%中性福尔马林液过度固定组的中等片和差片分别消化5、10 min,探针杂交后观察荧光染色效果。
1.5 结果判断FISH检测:当红绿信号比值≥2.0或信号连接成簇时判为阳性;特殊情况下依据2019版《乳腺癌HER2检测指南》进行判读。(1)优质:探针定位准确、信号强、核轮廓完整、背景荧光弱;(2)良好:探针定位准确、信号较强、核轮廓完整、但有少许背景;(3)中等:探针定位准确、信号弱、核轮廓欠完整、背景荧光强;(4)差:探针定位不准、信号弱、核轮廓不完整、背景强。染色优良率=(优质片数+良好片数)/总片数。
1.6 统计学分析采用SPSS 21.0软件进行统计学分析,两组间比较采用t检验,分类变量组间比较采用Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 两组固定液HE染色比较依据HE染色切片质量标准和评分表进行评估,经两组固定液制片的切片HE染色均色彩艳丽,细胞核着色清晰,红蓝对比鲜明(图1)。环保固定液组和10%中性福尔马林液固定组HE染色评分均值分别为95.53、95.57分,两组间差异无统计学意义(P>0.05)。
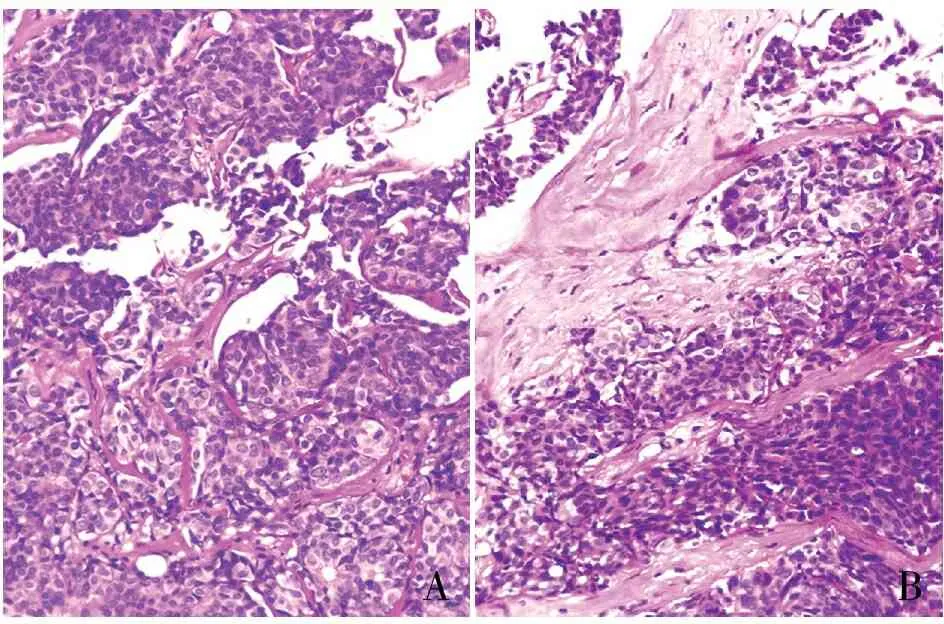
AB
2.2 两组固定液HER2基因FISH检测比较环保固定液组和10%中性福尔马林液固定组FISH染色优质切片分别为24、8张,良好切片分别为6、10张,中等切片分别为0、5张,差切片分别为0、7张,两组间差异有统计学意义(P<0.05,表2)。实验显示:10%中性福尔马林液固定组更易出现组织轮廓较模糊、背景荧光重和信号不明显等问题,而环保固定液组的组织轮廓清晰完整、背景干净、探针定位准确,可见耀眼的红/绿荧光信号(图2)。为了进一步验证,延长消化时间能否改善10%中性福尔马林液过度固定造成的背景荧光较重现象,本组对10%中性福尔马林液固定组中等切片和差切片进行不同消化时间验证,结果发现延长消化时间至5或10 min,均不能完全裸露细胞核、改善背景荧光较重的现象。
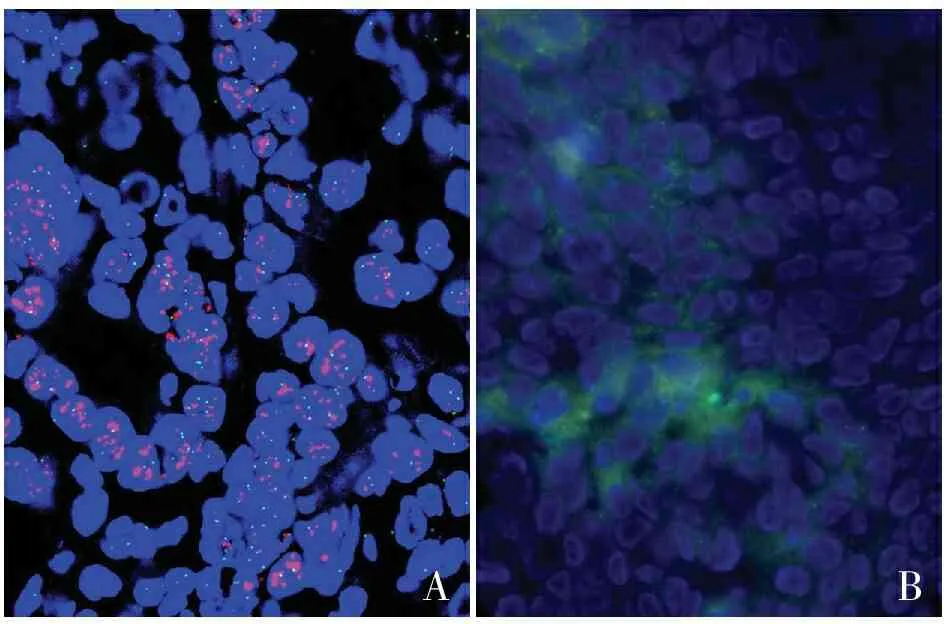
AB
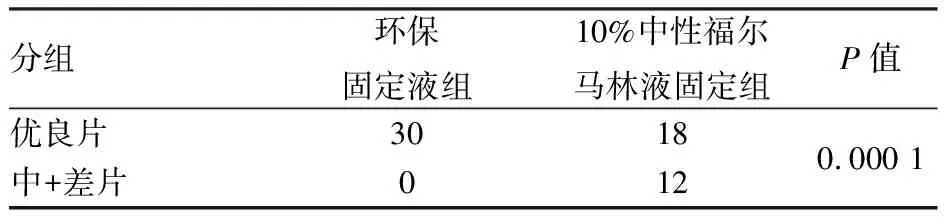
表2 两种固定液的HER2荧光染色评分
3 讨论
病理工作中高质量的FISH切片应具有较强的荧光信号和较低的背景着色,以降低阅片难度,提高诊断的精确度[7]。
然而,如何获得高质量的FISH切片是病理技术人员亟需解决的难题。乳腺穿刺组织、淋巴结穿刺组织等由于标本较小和送检流程等问题,易导致组织固定时间过久影响FISH检测。因此,探讨一种对FISH检测影响较小的固定方法非常重要。
10%中性福尔马林过度固定的标本,为了消化出清晰的轮廓,延长消化时间至10 min,依然不能改善背景荧光重和信号不明显等现象。已有研究表明,消化时间过长也会对细胞核有一定破坏,出现信号丢失的情况[6]。目前,环保固定液以醇溶结构为基础固定效果较好,与10%中性福尔马林液的交联固定有本质区别[8]。文献报道以醇溶为基础固定的石蜡标本更有益于PCR检测,并且长时间的固定对核酸质量影响较小,能有效避免过度固定[9]。因此,本组进一步分析环保固定液在FISH检测HER2实验中的应用效果,结果发现与10%中性福尔马林液固定组相比,环保固定液组的HER2荧光信号清晰,背景干净,细胞核轮廓完整清晰,易于阅读诊断,用于FISH检测更具有优势。
综上所述,穿刺组织建议统一采取环保固定液固定,避免因为标本过度固定,影响基因检测,该方法值得临床推广。

