三阴型乳腺癌基于组织学、免疫组化分型的分析
连 婧,黄 莉,步 鹏,苏 红,郗彦凤
乳腺癌是严重威胁妇女健康的恶性肿瘤,近年流行病学调查显示,女性乳腺癌与高发病率有关。2021年美国癌症协会统计显示:乳腺癌新发病例超过28.155万,占女性恶性肿瘤的30.3%,高于肺癌(13%)、结直肠癌(8%)[1]。2022年我国国家癌症中心统计数据显示:乳腺癌位居女性新发肿瘤的第一位(16.72%),已成为45岁以下女性恶性肿瘤死亡的主要原因。三阴型乳腺癌(triple-negative breast cancer, TNBC)是指免疫组化检测ER、PR、HER2均阴性,占乳腺癌的10%~15%[2-3]。TNBC与其他类型乳腺癌相比,具有分化差、侵袭性高、易转移、预后差等特点,患者早期易出现内脏转移和中枢神经系统转移[4]。现阶段TNBC未能从内分泌、抗HER2靶向治疗中受益,治疗以化疗为主。采用基因表达谱测序技术可以将TNBC划分为不同亚型,每个亚型均有独特的基因表达模式,可进行分型治疗[5-6]。由于基因表达谱测序分析价格昂贵、检测流程复杂、测序分析耗时等,使其在常规临床应用中受到限制。为了构建更加完善、易操作的TNBC分型系统,复旦大学附属肿瘤医院根据TNBC的RNA测序数据建立“四分型”[5]。本文利用组织学和免疫组化结果将TNBC分为不同亚型,探讨各亚型的临床病理特征、免疫表型及与预后的关系,为病理诊断分型、精准判断预后和分型治疗提供参考。
1 材料与方法
1.1 材料收集2017~2019年我院93例TNBC石蜡包埋组织,患者临床、随访资料完整。患者行乳腺癌改良根治术或单侧乳腺切除+前哨淋巴结切除术,术前均未行新辅助治疗,术后均行4~6周期以蒽环类为主的化疗。
1.2 方法
1.2.1免疫组化染色 手术切除的组织标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm厚切片,采用HE、免疫组化EnVision两步法染色。抗体ER、PR、HER2、AR、CD8、FOXC1、PD-L1分别购自Gene、Ventana和Abcam公司。
1.2.2组织学分型 (1)大汗腺分化特征:>50%肿瘤细胞界限清楚,具有丰富的、嗜酸性胞质,核/质比为1 ∶2或更大,泡状核、核仁突出,根据以上指标评估肿瘤细胞具有大汗腺分化特征。(2)肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TIL):根据2014年国际TIL工作组会议共识的建议进行评估[7],其中>50%为高表达,<50%为低表达。(3)间叶化生:肿瘤细胞由上皮样细胞形态转变为梭形细胞形态,或伴间叶性黏液样基质形成。
1.2.3TNBC分型 AR阳性:≥10%浸润癌细胞核呈不同程度着色。CD8阳性:肿瘤间质浸润CD8+淋巴细胞所占面积/肿瘤间质总面积≥20%。FOXC1阳性:≥10%浸润癌细胞核着色。PD-L1:浸润性癌和周边的肿瘤细胞相关间质中免疫细胞PD-L1无表达或表达区域<1%为阴性、≥1%为阳性。根据形态学特点、免疫组化标志物AR、CD8、FOXC1表达进行分型:腔面雄激素受体型(luminal androgen receptor, LAR)、免疫调节型(immunomodulatory, IM)、基底样免疫抑制型(basal-like and immune-suppressed, BLIS)、间充质型(mesenchymal-like subtype, MES)(图1),比较TNBC各亚型临床病理特征、无瘤生存率之间的差异。
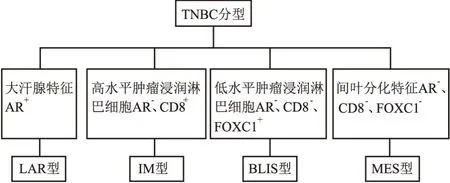
图1 基于组织学、免疫组化的TNBC分型方法
1.2.4HER2分组 以无膜染色或≤10%浸润癌细胞呈不完整、微弱/难以察觉的细胞膜染色为0,>10%浸润癌细胞呈不完整、微弱/难以察觉的细胞膜染色为1+,>10%的浸润癌细胞呈弱-中等强度的完整细胞膜染色为2+[8]。HER2低表达定义为免疫组化1+或2+,且原位杂交未扩增[9]。
1.3 随访通过门诊和电话对患者进行随访,了解患者手术后病情是否稳定、有无复发转移或死亡。无复发生存时间(relapse-free survival, RFS)定义为患者首次外科手术至局部或全身复发或截止随访的时间。患者死于乳腺癌意外原因者记录为失访病例,疾病进展定义为乳腺癌复发、转移或死亡。
1.4 统计学分析采用SPSS 20.0软件进行统计学分析,应用确切概率法比较各亚型临床病理特征。运用Kaplan-Meier法经Log-rank检验,比较TNBC亚型无瘤生存率之间的差异,并绘制生存曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 TNBC亚型与复旦大学“四分型”的比较本组队列的TNBC分型:LAR型23例(24.7%),IM型24例(25.8%),BLIS型39例(42.0%),MES型7例(7.5%)(图2)。4种亚型的构成比,与复旦大学附属肿瘤医院基于RNA测序数据进行TNBC分型的结果一致,差异无统计学意义(P=0.512,图3)。
ABCD
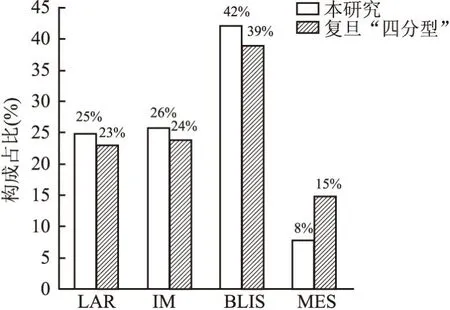
图3 本研究TNBC亚型构成比与复旦大学附属肿瘤医院“四分型”对比
2.2 TNBC亚型的临床病理特征本组93例TNBC患者初诊时年龄26~86岁,平均51.2岁。肿物最大径0.7~4.5 cm,平均2.25 cm,淋巴结转移17例(18.3%);各亚型间pT分期差异有显著性(P=0.030),其中LAR型患者的pT分期比其他亚型高。组织学分级均为Ⅱ或Ⅲ级,以Ⅲ级为主(86%),各亚型间的组织学分级差异有显著性(P<0.001),其中LAR型患者组织学分级Ⅱ级占比显著高于其他亚型。亚组间HER2-0、HER2低表达差异有统计学意义,LAR型具有较多的HER2低表达(P=0.029,表1)。
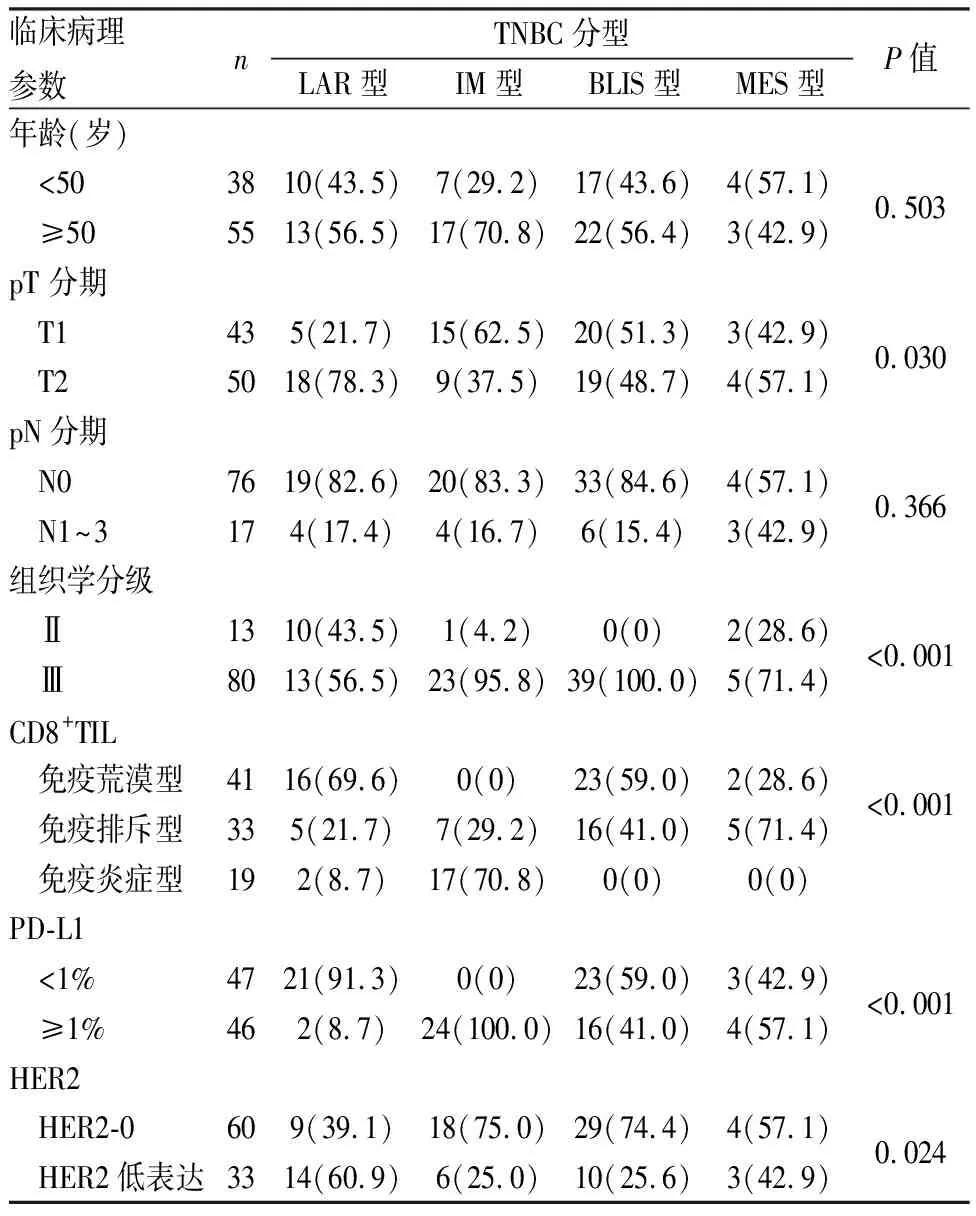
表1 TNBC不同亚型临床病理特征的比较[n(%)]
2.3 免疫表型分型根据免疫组化CD8表达将TNBC分为3种免疫表型。(1)免疫荒漠型:肿瘤实质中CD8+TIL<10%,癌巢周围间质中CD8+TIL<30%;(2)免疫排斥型:肿瘤实质中CD8+TIL<10%,癌巢周围间质中CD8+TIL≥30%;(3)免疫炎症型:肿瘤实质中CD8+TIL≥10%。亚型间免疫表型的分布差异有显著性(P<0.001),IM型患者主要为免疫炎症型,其他亚型患者主要为免疫荒漠型、免疫排斥型(图4)。
PD-L1的阳性率为49.6%(46/93),在各亚型的表达差异有显著性(P<0.001),其中以IM型中的阳性率最高。
2.4 预后患者随访时间12~58个月,平均、中位随访时间均为40个月,平均和中位RFS时间分别为41、40岁,无瘤生存率为88.2%。本组11例患者疾病有进展,包括BLIS型5例,IM型3例,MES型2例,LAR型1例。LAR型有较长的RFS,各亚型间的无瘤生存率差异无统计学意义(P>0.05,图5A)。单因素分层生存分析:pT1分期(最大径≤2 cm)TNBC的4个亚型无瘤生存率差异有统计学意义(P=0.011,图5B);其余患者年龄、淋巴结转移、组织学分级与无瘤生存率差异无统计学意义(P>0.05)。
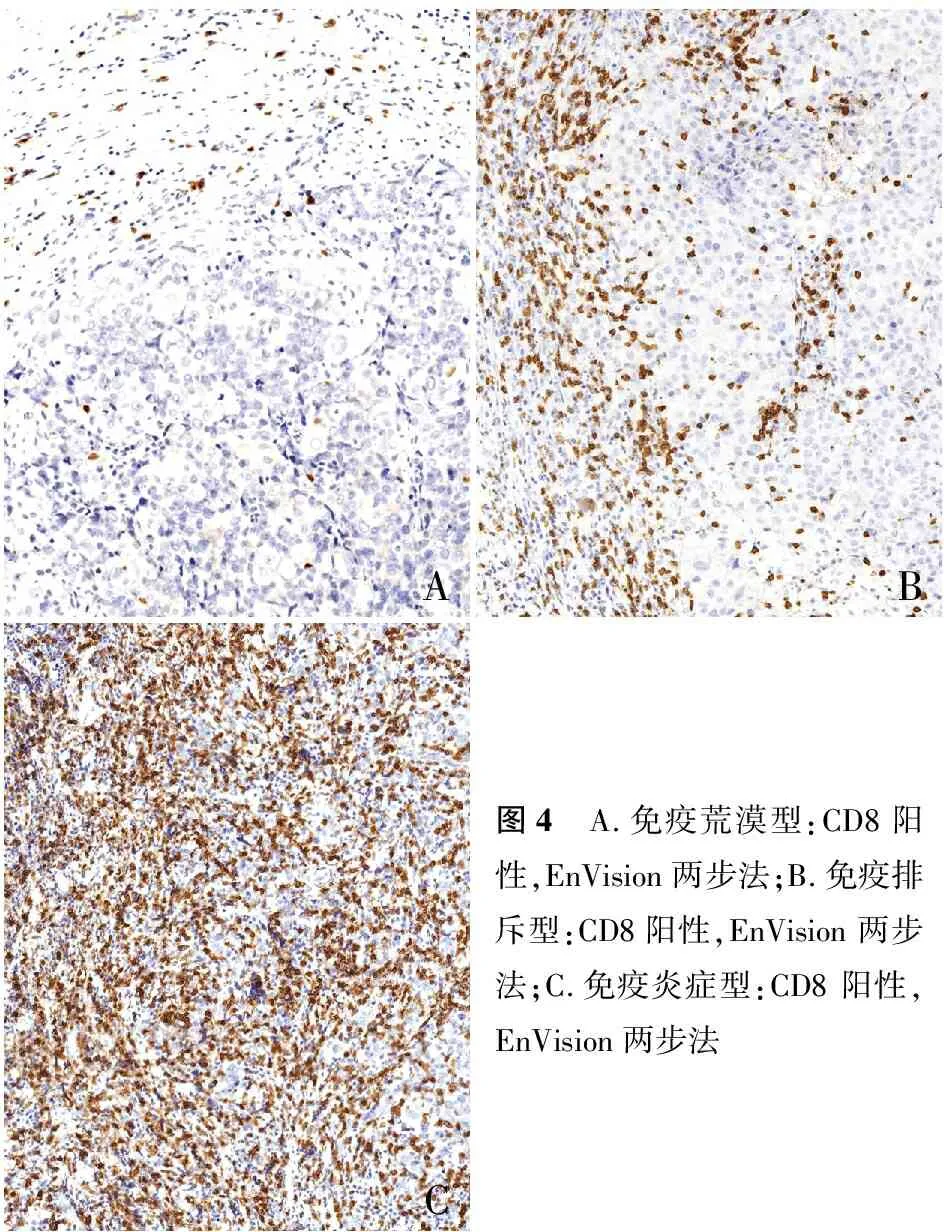
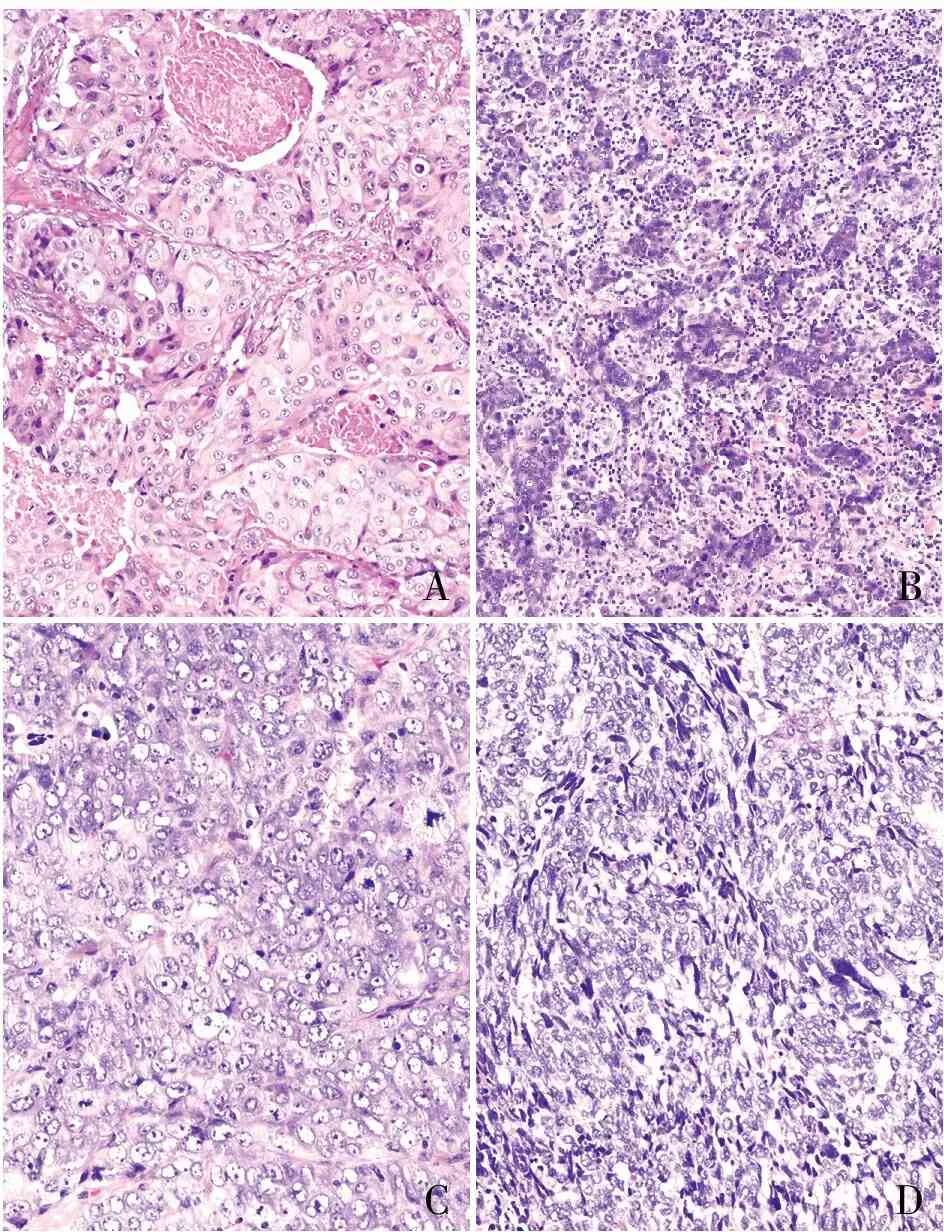
ABC图4 A.免疫荒漠型:CD8阳性,EnVision两步法;B.免疫排斥型:CD8阳性,EnVision两步法;C.免疫炎症型:CD8 阳性,EnVision两步法
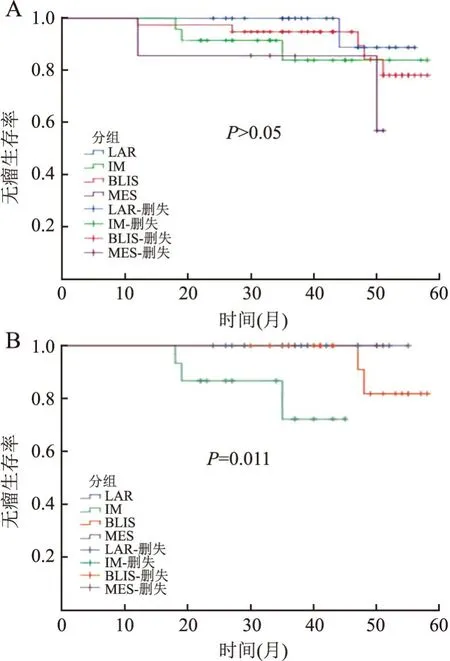
图5 A. TNBC的4种分型与无瘤生存率的关系;B. pT1期TNBC的4种分型与无瘤生存率的关系
3 讨论
乳腺癌基因表达谱分析是鉴定乳腺癌分子分型最有效的检测工具,但其价格昂贵、操作流程复杂、结果分析耗时,在临床应用中受到较大限制。同时,仅依靠筛选的免疫组化标志物分型与基因测序数据并不完全吻合,可能会导致部分患者错失相应的分子亚型治疗机会。本实验根据组织学、免疫组化标志物对TNBC进行分型,与复旦大学附属肿瘤医院“四分型”[5]报道一致。
本组93例浸润性乳腺癌患者平均年龄51.2岁,与文献报道不一致,但各亚型间差异无统计学意义。本组还显示TNBC各亚型的临床病理特征、组织学和免疫表型也不相同,pT分期、组织学分级、肿瘤间质淋巴细胞浸润模式、PD-L1、HER2低表达,差异均有统计学意义。单因素分层生存分析显示:pT1分期的无瘤生存率差异有统计学意义,各亚型间的无瘤生存率差异无统计学意义。LAR型最早由Farmer等[10]报道,与大汗腺细胞表现出相同的组织学特点—AR表达和相应的基因表达谱。Arciero等[11]报道LAR型患者的总生存率显著高于其他亚型,本组pT分期在TNBC各亚型间差异有统计学意义,LAR型pT分期较高,无瘤生存率较长,预后较好,与文献报道一致。多项临床研究发现AR信号通路有可能成为此型肿瘤的治疗靶点,因此AR拮抗剂可能在晚期TNBC患者的临床治疗中发挥重要作用[12-14]。有研究显示,LAR型肿瘤更易出现HER2基因、PI3K激酶信号通路、细胞周期信号通路突变,提示信号通路靶向药物具有潜在的治疗价值,抑制剂间的联合阻滞治疗将成为未来研究的重点[12]。
肿瘤微环境作为肿瘤细胞的“土壤”,随着肿瘤细胞的发生与其共同进化,两者相辅相成,共同促进肿瘤的发展。免疫细胞是微环境中能直接杀伤肿瘤细胞的成分,包括TIL、巨噬细胞和中性粒细胞等。TIL是临床预后的重要标志物,其中T细胞属于优势细胞[15]。CD8是可靠的T细胞免疫组化生物学标志物,CD8+TIL可作为基底样乳腺癌患者提高生存率的独立预后因素[16]。本组根据TIL中CD8+细胞的分布特点分为免疫荒漠型、免疫排斥型和免疫炎症型,IM型以高水平的TIL浸润为特征,70.8%(17/24)的IM型患者属于免疫炎症型,而其他亚型患者多表现为免疫荒漠型或免疫排斥型,TNBC各亚型间免疫表型的分布差异有统计学意义。免疫表型的单因素分层生存分析:各亚型间的无瘤生存率差异无统计学意义,但pT1分期的无瘤生存率差异有统计学意义,其中IM型无瘤生存率较短,与文献报道不一致,可能需积累更多病例和长时间随访进一步分析。Ahn等[17]发现PD-L1+TNBC肿瘤具有免疫基因组特征,包括高水平的TIL和相对较好的预后。本组49.6%的病例PD-L1阳性,各亚型间表达差异有统计学意义,IM型的高表达率提示该亚型可能更受益于PD-L1免疫检查点抑制剂。
FOXC1属于FOX家族成员,其表达于多个器官。在乳腺癌中FOXC1可通过增强基底样标志物P-cadherin表达,降低上皮标志物E-cadherin表达,诱发上皮细胞-间质转化,增强基底样表型乳腺癌细胞的增殖、迁移、侵袭[18]。研究显示,单独检测FOXC1能够识别基底样表型乳腺癌,可作为预测脑转移发生的生物学标志物[19]。本组BLIS型在TNBC中占比最多,其组织学分级高、TIL水平低,5例患者出现疾病复发或死亡,提示BLIS型患者预后较差。
MES型具有乳腺癌干细胞相关基因富集,与肿瘤细胞失黏附性和间叶化生的组织学特征有关[5]。上皮细胞-间质转化是乳腺癌细胞获得转移能力的重要机制,可促进肿瘤侵袭、转移和耐药,对乳腺癌的预后、治疗等具有重要意义。本组只有7.5%病例属于MES型,患者初诊时年龄较小,6例伴肉瘤样梭形细胞,1例伴间叶性黏液样基质形成。71.4%的MES型肿瘤表现为免疫排斥型,即具有低水平的CD8+瘤内TIL、高水平的CD8+瘤周TIL,可能比以免疫荒漠型为主的BLIS型患者预后较好,提示免疫治疗可能对其有效。有研究显示,MES型中JAK/STAT、PI3K/AKT、Wnt/β-catenin等信号通路活化,针对该通路的靶向治疗有望提高患者生存率[20-22]。
在化疗、靶向治疗、免疫治疗后,细胞毒性药物和靶向单抗偶联的抗体药物偶联物(antibody drug conjugate, ADC)将肿瘤的治疗带入新时代。研究显示,以HER2为靶点的ADC药物在乳腺癌中显示优异的临床疗效[23]。本组HER2低表达在各亚组间差异有统计学意义,结果显示LAR型中有较多患者可以从ADC药物中获益。
本组根据组织学、免疫组化标志物对TNBC进行分型,使基因表达谱测序分型能够较好地转化为简单易行的分型系统。通过筛选相应的分子生物学标记指导临床病理诊断分型,为TNBC的分型和靶向治疗提供理论依据。鉴于TNBC不同亚型的患者预后不同,因此需积累更多病例和更长的随访时间以便进一步分析。

