MCM5在卵巢癌中的作用及机制分析
陈 冬,张明薇,孙菲菲,李 丽,
2022年我国卵巢癌发病率位居女性生殖系统肿瘤的第三位,病死率高,严重危害女性健康。研究卵巢癌的发生机制,有助于早期发现和有效预防,为患者提供潜在的治疗靶点。微小染色体维持蛋白(minichromosome maintenance, MCM)家族是从古老低等生物到真核生物中广泛存在、高度保守的蛋白质[1],在真核生物中MCM2~7形成异六聚体,与加载器Cdt1、起始识别复合物ORC相互作用,发挥解旋酶作用,激活起始复制源,启动DNA复制[2-5]。MCM5在多种肿瘤中高表达,与预后不良相关[6-8]。其在恶性肿瘤中的研究均为蛋白表达分析,缺乏相应机制研究。本课题组前期发现,MCM5在子宫内膜浆液性癌中呈弥漫强表达,且与TP53突变相关,过表达MCM5促进子宫浆液性癌细胞增殖、侵袭和迁移。高级别浆液性卵巢癌与子宫内膜浆液性癌均以TP53突变为特点[9],组织学和生物学行为相似,MCM5在卵巢癌中是否也发挥同样的作用值得深入分析。本文着重探讨MCM5在卵巢癌发生、发展中的作用和功能,分析作用机制和临床意义,为卵巢癌的临床诊断和治疗提供理论依据。
1 材料与方法
1.1 临床资料收集2020~2021年山东大学齐鲁医院行手术治疗的118例卵巢癌组织,患者年龄38~80岁,中位年龄59岁。本组高级别浆液性癌95例,低级别浆液性癌7例,子宫内膜样癌5例,透明细胞癌6例,黏液性癌5例。本实验经山东大学齐鲁医院伦理委员会批准,患者均知情同意。
1.2 材料与试剂卵巢癌细胞系HEY、SK-OV-3来自山东大学细胞生物学实验室。MCM5小干扰序列由上海博尚公司合成;CCK-8试剂盒购自Beyotime公司;ER、PR、p53、Ki67单克隆抗体和SP两步法试剂盒,均购自北京中杉金桥公司。AnnexinV-FITC细胞凋亡检测试剂盒,购自上海贝博生物公司。
1.3 方法
1.3.1生物信息学分析 TCGA癌症基因组图谱数据集从http://gdac.broadinstitute.org/下载,收集426例卵巢癌和88例正常卵巢组织临床病理资料。GSEA分析使用GEO数据集GSE9891(280例不同级别卵巢肿瘤)和GSE12172(90例卵巢肿瘤),从NCBI GEO数据库(http://www.ncbi.nlm.nih.gov/geo)下载。
1.3.2免疫组化与结果判断 标本均经10%中性福尔马林固定,烤片,脱蜡和水化,采用免疫组化SP 两步法染色。切片高压修复5 min,3% H2O2抗原修复,山羊血清封闭,一抗4 ℃孵育过夜。PBS冲洗后滴加二抗,室温孵育30 min,DAB显色,苏木精染色,脱水,透明,封固。
ER、PR、p53和Ki67均为细胞核着色,>10%的肿瘤细胞着色判为ER、PR阳性。p53肿瘤细胞呈细胞核弥漫强阳性或均阴性为“突变型”,散在、低至中等强度着色为“野生型”。MCM5阳性定位于细胞核,采用H-score法进行判读[10]:0~3分为阴性,4~9分为阳性,其中4~6分为低表达,7~9分为高表达。
1.3.3Western blot、CCK-8和EDU实验 Western blot检测: 经蛋白提取,测定浓度,上样后电泳转膜、封闭、电泳,一抗过夜孵育,二抗孵育1 h,显影。CCK-8法:细胞置于96孔板内,加入10 μL CCK-8试剂,孵育2 h,酶标仪490 nm波长下检测吸光度。EDU实验:按细胞6 000个/孔加入EDU工作液,孵育2 h,固定、甘氨酸孵育、加通透液后,放入Click-T反应混合物,DAPI染色,拍照、分析。
1.3.4克隆形成、Transwell小室、划痕实验 克隆形成实验:细胞800个/孔,观察克隆生长情况,标本经4%多聚甲醛室温固定15 min,弃上清,2.5%结晶紫避光染色10 min,实验步骤参考文献[11]。Transwell小室实验:检测细胞侵袭、迁移能力,实验步骤参考文献[12]。划痕实验:将处理后的细胞均匀种植在6孔板中,划痕后进行拍照,实验步骤参考文献[12]。
1.3.5流式细胞术 采用凋亡检测试剂盒,使用不含EDTA的胰蛋白酶消化细胞,加入培养基重悬,4 ℃经800 r/min离心5 min;使用预冷的PBS缓冲液清洗细胞2次,离心后弃上清,加入400 μL Binding Buffer和5 μL Annexin V-FITC,4 ℃避光孵育30 min;加入10 μL PI染色液并混匀,4 ℃避光孵育5 min,用400目滤网过滤后,应用流式细胞仪检测凋亡[11]。
1.4 统计学分析使用Graphpadprism 9.0软件进行统计学分析,计量资料组间比较采用双侧t检验,应用Pearson相关系数评估相关性和Kaplan-Meier法分析预后。实验均重复3次,以P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析卵巢癌中MCM5 mRNA的表达TCGA数据库分析426例卵巢癌和88例正常卵巢组织,与正常卵巢组织相比,卵巢癌中MCM5 mRNA水平明显升高(P=0.007 8,图1A)。在GEO数据集GSE9891中分析280例不同级别卵巢肿瘤,结果显示:不同分级卵巢肿瘤中MCM5 mRNA的表达,差异有统计学意义(P=0.005 4,P=0.021 1),卵巢肿瘤分级越高,MCM5 mRNA表达水平越高。GSE9891数据集中包括18例卵巢低度恶性潜能肿瘤(即交界性肿瘤)和262例卵巢癌,卵巢低度恶性潜能肿瘤中MCM5 mRNA表达水平显著低于卵巢癌(P=0.008 4)。在GSE12172数据集中分析90例卵巢癌,与卵巢低度恶性潜能肿瘤(n=30)相比,卵巢癌(n=60)中MCM5 mRNA表达水平明显升高,差异有统计学意义(P=0.006 1,图1B~D)。
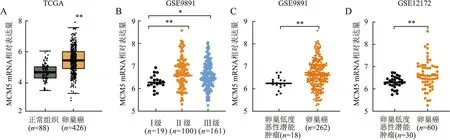
图1 生物信息学分析卵巢癌中MCM5 mRNA的表达:A.TCGA数据库中MCM5 mRNA在卵巢癌中的表达;B.不同级别卵巢肿瘤中MCM5 mRNA的表达;C. GSE9891数据库中MCM5 mRNA在卵巢癌与卵巢低度恶性潜能肿瘤中的比较;D. GSE12172数据库中MCM5 mRNA在卵巢癌与卵巢低度恶性潜能肿瘤中的比较;*P<0.05,**P<0.01
2.2 卵巢癌中MCM5表达与临床病理特征的关系本组118例卵巢癌中,p53突变型92例(77.97%,表1)。高级别浆液性癌呈乳头状、腺样生长,有显著核异型性(图2A);低级别浆液性癌的肿瘤细胞形成微乳头结构,轻至中度核异型性(图2B);子宫内膜样癌的肿瘤性腺体呈腺管状、筛状(图2C);透明细胞癌呈微囊状、乳头状生长,乳头轴心有玻璃样变,肿瘤细胞呈鞋钉状(图2D);黏液性癌肿瘤性腺体融合,呈膨胀性浸润(图2E);正常输卵管上皮为单层柱状上皮(图2F)。MCM5在输卵管上皮组织中不表达,在不同组织学类型的卵巢癌中有不同程度的表达(图2G~L)。MCM5在卵巢癌中阳性率为48.3%(57/118),与正常输卵管组织(0/6)相比,卵巢癌中MCM5表达明显升高(P=0.004 2)。同时,MCM5在高级别浆液性癌中呈弥漫强表达,在其他类型多为弱至中等强度表达。MCM5与ER表达呈负相关(P=0.002 2),与p53突变型(P=0.000 3)、Ki67增殖指数高相关(P=0.003 2,表1)。MCM5与ER在95例高级别浆液性癌中呈显著负相关(P=0.000 3),与Ki67增殖指数高明显相关(P=0.000 3),与患者年龄、FIGO分期、PR表达均无明显相关性(表2)。本组结果显示,MCM5高表达与卵巢癌ER表达水平低、Ki67增殖指数高和肿瘤恶性程度高均相关。
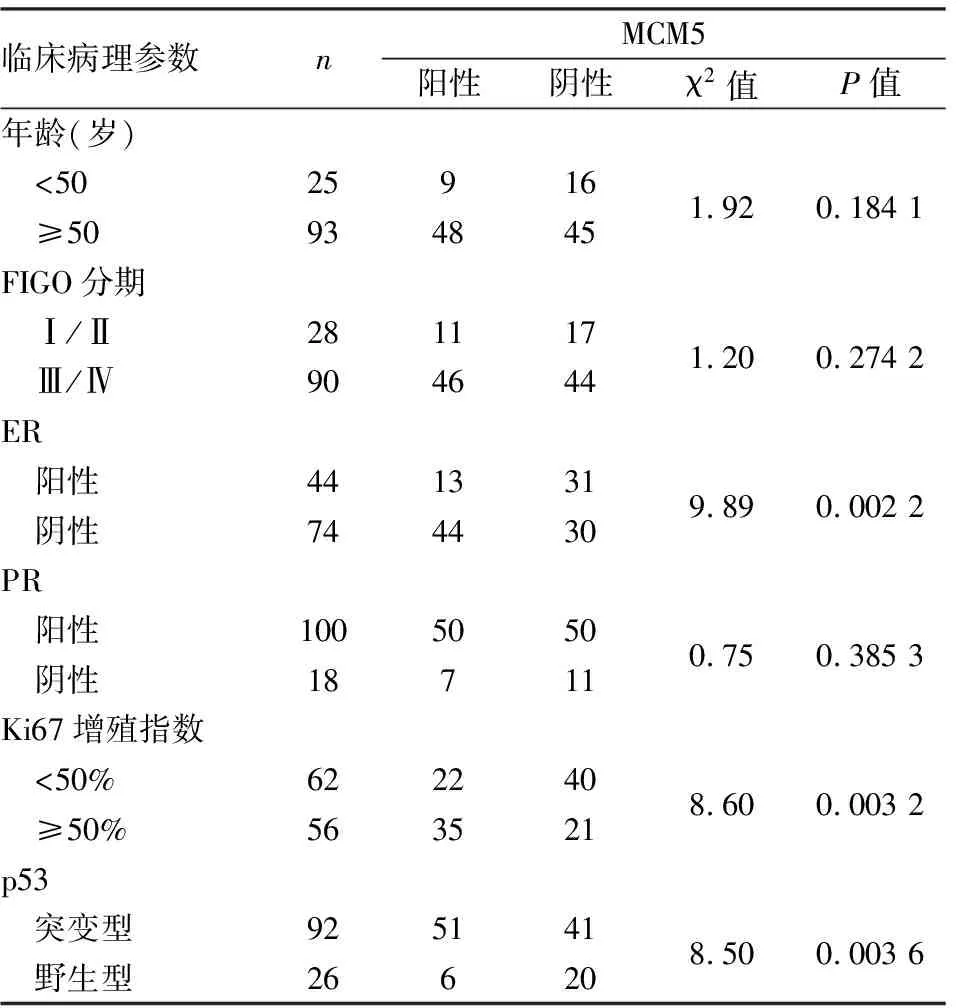
表1 118例卵巢癌中MCM5表达与临床病理特征的关系
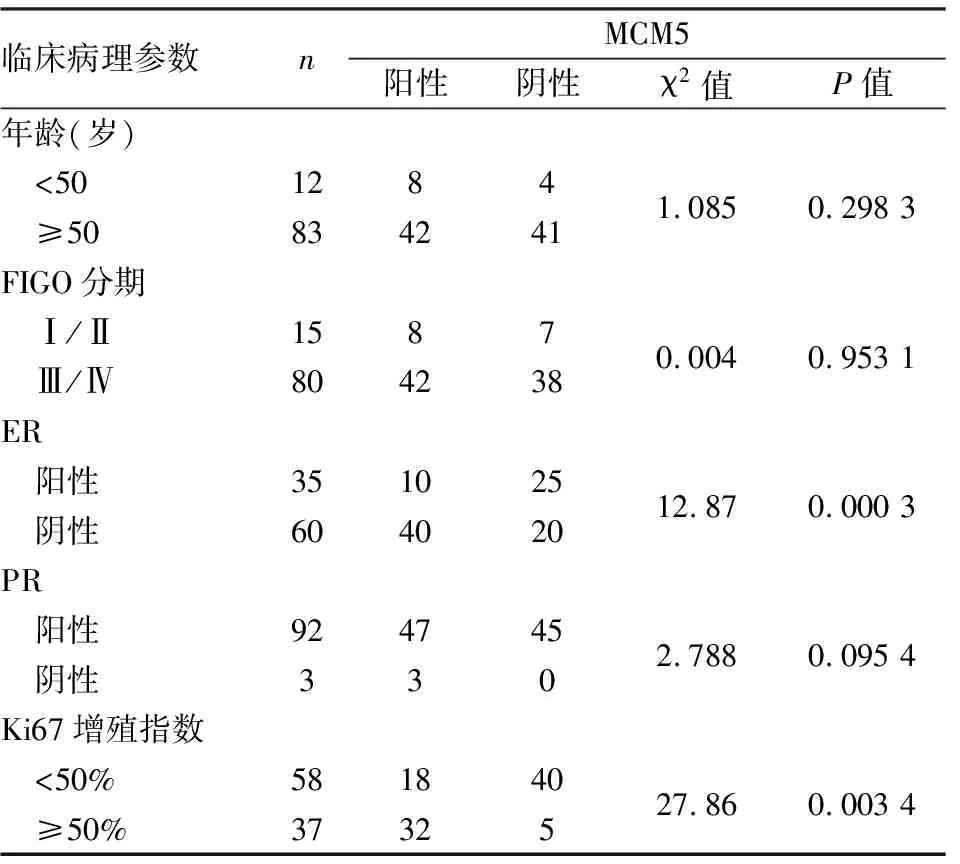
表2 95例高级别浆液性癌中MCM5表达与临床病理特征的关系
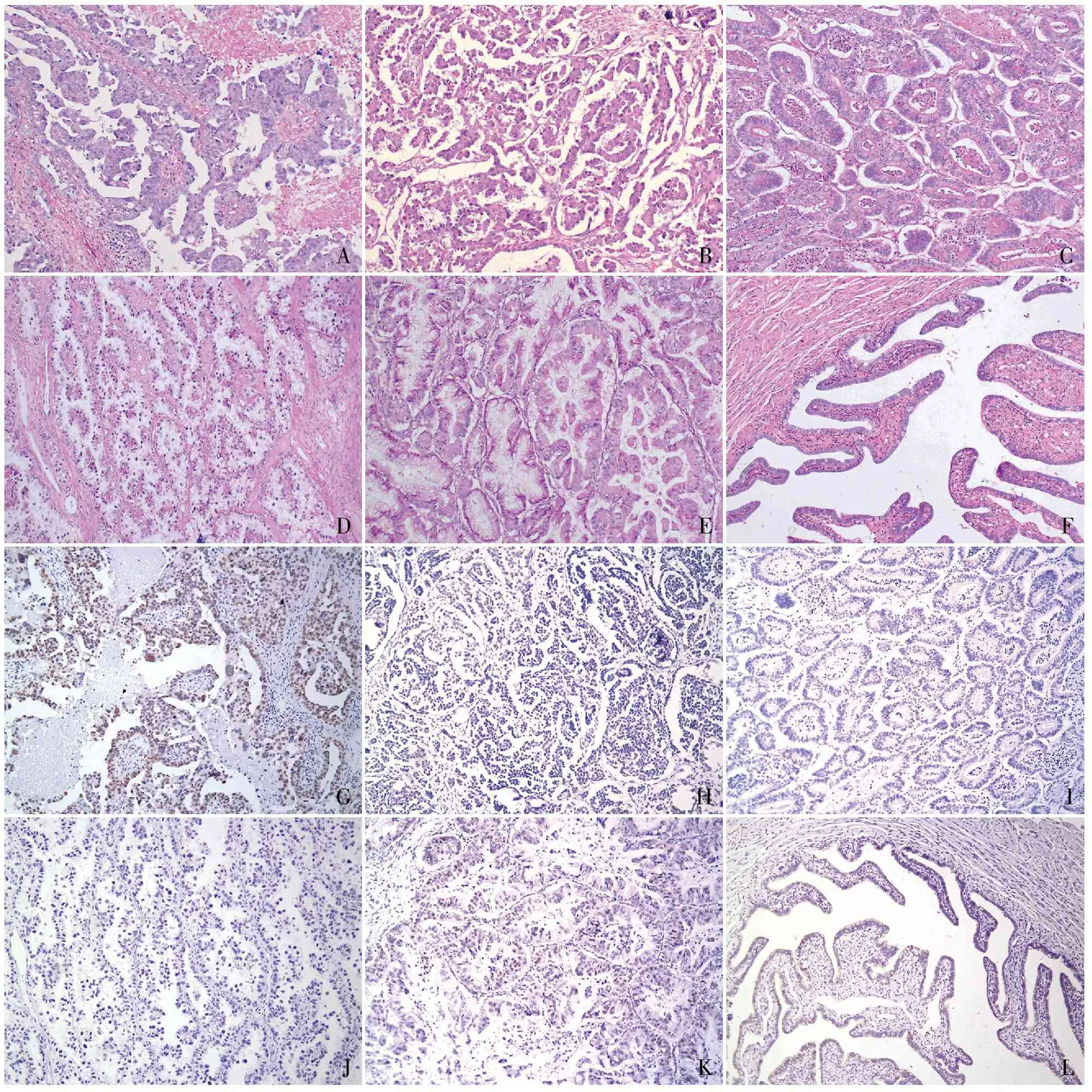
ABCDEFGHIJKL
2.3 干扰MCM5对卵巢癌细胞增殖能力的影响采用CCK-8、EDU实验检测MCM5对卵巢癌细胞增殖能力的影响,应用平板克隆实验检测卵巢癌细胞克隆形成能力的影响。在卵巢癌细胞SK-OV-3和Hey细胞中,分别使用2条不同的小干扰序列敲低MCM5。EDU实验显示,与对照组相比干扰MCM5后卵巢癌细胞增殖能力明显降低(图3A~C)。CCK-8实验显示,干扰MCM5后SK-OV-3和Hey细胞活性明显降低(图3D、E)。上述结果表明,干扰MCM5降低卵巢癌细胞增殖能力。平板克隆实验显示,MCM5干扰组细胞克隆形成能力明显低于对照组(图3F、G),表明干扰MCM5抑制细胞平板克隆形成。
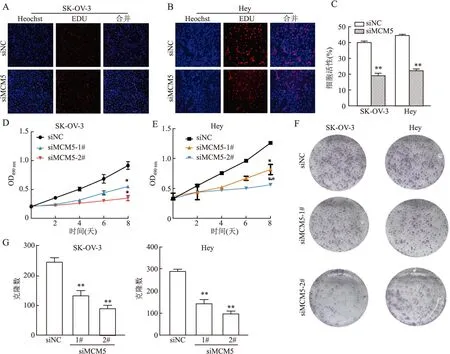
图3 干扰MCM5抑制卵巢癌细胞增殖能力:A.EDU实验:在SK-OV-3细胞中干扰MCM5检测卵巢癌细胞增殖;B.EDU实验:在Hey细胞中干扰MCM5检测卵巢癌细胞增殖;C.直方图;D. CCK-8实验:在SK-OV-3细胞中干扰MCM5检测细胞活性;E.CCK-8实验:在Hey细胞中干扰MCM5检测细胞活性;F. 平板克隆实验:在SK-OV-3和Hey细胞中干扰MCM5检测细胞克隆形成;G.直方图;*P<0.05,**P<0.01,NC:阴性对照,siMCM5-1#与siMCM5-2#分别代表2条靶向MCM5的不同的小干扰序列
2.4 干扰MCM5对卵巢癌细胞侵袭、迁移能力的影响采用划痕实验检测MCM5对细胞迁移能力的影响,结果显示SK-OV-3和Hey细胞中,干扰MCM5后肿瘤细胞划痕愈合能力明显低于对照组(P=0.004、P=0.021,图4A、B)。Transwell小室实验显示,MCM5干扰组Transwell小室细胞数量明显低于对照组(P=0.002 1、P=0.041 4、P=0.003 2、P=0.021 4),表明干扰MCM5抑制卵巢癌细胞迁移、侵袭(图4C、D)。
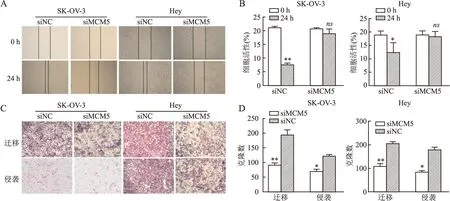
图4 干扰MCM5抑制卵巢癌细胞侵袭迁移能力:A. 划痕实验:在SK-OV-3和Hey细胞中干扰MCM5检测细胞迁移;B.直方图;C. Transwell小室迁移实验和侵袭实验:干扰MCM5检测细胞迁移、侵袭;D. 直方图;*P<0.05,**P<0.01,NC:阴性对照,ns:无统计学意义
2.5 干扰MCM5对卵巢癌细胞凋亡的影响为进一步分析MCM5促进卵巢癌恶性进展的机制,本组进行细胞凋亡实验。在SK-OV-3和Hey细胞中,干扰MCM5后细胞凋亡显著升高,提示MCM5可以通过调控细胞凋亡影响卵巢癌细胞生长(图5)。
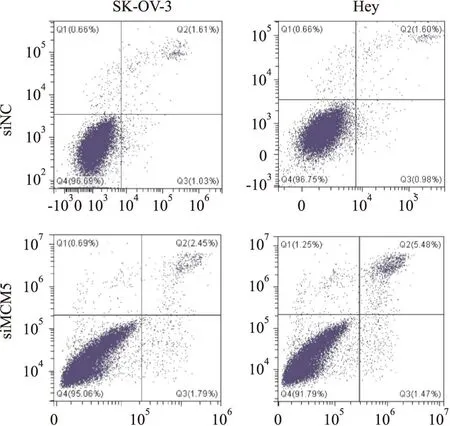
图5 干扰MCM5促进卵巢癌细胞凋亡:在SK-OV-3和Hey细胞中干扰MCM5后,流式细胞术检测细胞凋亡
2.6 卵巢癌中MCM5表达与患者预后的关系使用在线分析网站Kaplan-Meier进行生存分析,采用50%作为截断值。结果显示,MCM5低表达组中位无进展生存期为24.7个月,高表达组为19个月(P=0.014 1,图6A),MCM5高表达患者无进展生存期比低表达者短。此外,TP53突变型卵巢癌中,MCM5低表达组中位无进展生存期为20.0个月,MCM5高表达组为16.8个月,MCM5高表达与无进展生存期短相关(P=0.007 5,图6B)。在TP53野生型肿瘤中,MCM5高表达与卵巢癌患者预后无明显相关性,中位无进展生存期分别为23.1和15.5个月(P=0.065 1,图6C)。上述结果,提示MCM5高表达患者预后较差。
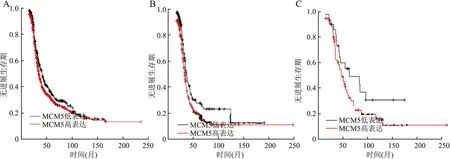
图6 卵巢癌中MCM5高表达与患者预后的关系:A.卵巢癌中MCM5高表达组与低表达组患者无进展生存期的关系;B.TP53突变型卵巢癌中,MCM5高表达组与低表达组患者无进展生存期的关系;C. TP53野生型卵巢癌中,MCM5高表达组与低表达组患者无进展生存期的关系
3 讨论
卵巢癌患者就诊时多数已为晚期,术后2~3年常发生复发和转移,化疗易耐药,晚期患者5年生存率不足30%。目前,学者们对卵巢癌发生、发展的分子机制尚不清楚,缺乏有效的早期诊断和治疗策略。
卵巢癌主要分为5种组织学亚型,即高级别浆液性癌、低级别浆液性癌、子宫内膜样癌、透明细胞癌和黏液性癌[13-14]。卵巢癌中以高级别浆液性癌最为常见,该类型以TP53基因突变、基因组高度不稳定性为特点,生长迅速,侵袭性强,预后较差,5年总生存率仅40%。
本组采用生物信息学分析和免疫组化法等分析卵巢癌中MCM5 mRNA和蛋白水平的变化,结果显示两者在卵巢癌中的表达均高于正常输卵管上皮,其中以高级别浆液性癌升高最为明显,提示MCM5或在卵巢癌尤其是高级别浆液性癌的发病中发挥重要作用。同时,本组发现MCM5高表达患者比低表达患者无进展生存期短,在TP53突变的卵巢癌中,该趋势更为明显。TP53突变的卵巢癌主要为高级别浆液性癌,提示MCM5高表达卵巢癌患者预后不良。此外,MCM5高表达与肿瘤Ki67增殖指数高、ER低表达相关,进一步证实MCM5高表达与患者预后差相关。国内外研究也提示MCM5高表达与多种肿瘤的预后不良相关,Wang等[15]研究显示MCM5高表达急性髓性白血病患者预后不良;Xiong等[16]发现MCM5可以预测结直肠癌患者生存期。也有文献报道,MCM复合物可能是卵巢癌患者的潜在预后标志物[17-18]。
为了进一步分析MCM5作用和功能,本组进行体外实验选择高表达MCM5的卵巢癌SK-OV-3和Hey细胞系。干扰MCM5后,卵巢癌细胞增殖能力、细胞活性、克隆形成能力和侵袭迁移能力均明显降低,提示MCM5可能通过调控卵巢癌细胞的增殖、侵袭和迁移能力,参与卵巢癌的发生、发展。MCM5参与DNA复制起始,在DNA复制过程中发挥调控作用,并影响细胞周期进程。MCM5在静止期细胞中表达极少,G1期表达开始增加,G1/S检验点达到峰值,当细胞进入分裂晚期、G0期或发生衰老时,水平逐渐下降。一旦细胞进入S期,多种机制阻止新的MCM5加载,防止过度复制导致基因组不稳定。多种机制导致的MCM5表达升高,均可引起过度复制,从而导致细胞过度增殖和基因组高度不稳定性,因此MCM5高表达肿瘤常为高度恶性,存在染色体不稳定性。本实验结果显示干扰MCM5促进细胞凋亡,提示MCM5可能同时通过调控凋亡,促进肿瘤细胞增殖。然而,MCM5通过何种机制促进卵巢癌侵袭、迁移,需要深入分析。有研究表明,MCM5通过调控细胞周期促进结肠癌的进展[19],且可通过上皮细胞-间充质转化促进结肠癌的转移[20]。
Sharma等[21]发现MCM5在膀胱癌的初步诊断中具有良好的准确性,Stockley等[22]报道MCM5是兼具敏感性和特异性的新肿瘤标志物,可用于检测尿液中的卵巢癌和子宫内膜癌肿瘤细胞。本组显示与正常卵巢组织和输卵管上皮相比,卵巢癌组织中MCM5表达明显升高,且与其他亚型相比,高级别浆液性癌中呈弥漫强阳性,提示免疫组化检测p53和MCM5可用于鉴别卵巢癌组织学类型和高级别浆液性癌的早期诊断,并可作为卵巢癌潜在预后标志物。由于免疫组化技术简单、无创,在临床诊断的应用中更容易推广。
综上所述,MCM5在卵巢癌尤其是高级别浆液性癌中表达显著升高,MCM5高表达提示患者预后不良。MCM5通过促进卵巢癌细胞增殖、迁移和侵袭以及抑制细胞凋亡发挥促癌作用,有望成为卵巢癌预后标志物和治疗靶点。

