WHO(2020)女性生殖系统肿瘤分子分型在子宫内膜癌中的应用与临床意义
曹立宇,田壮壮,祝利利,白真真,张 聪
子宫内膜癌(endometrial carcinoma, EC)是女性生殖系统常见的恶性肿瘤,根据2023年全球癌症统计数据显示,EC的发病率和病死率分别占女性恶性肿瘤的7%和5%[1]。近年我国女性EC的发病率与病死率均呈上升趋势,严重影响女性健康。WHO(2014)女性生殖系统肿瘤分类依据组织学特征和免疫表型将EC分为2型:Ⅰ型为低级别、激素受体依赖型,临床惰性;Ⅱ型为非激素受体依赖型,常伴p53基因突变,有更强的侵袭性。两者的部分患者临床特征、形态学和免疫表型均有重叠,不能充分反映肿瘤的生物学行为和判断患者的预后。随着分子生物学技术的发展,2013年美国癌症基因图谱(the Cancer Genoms Atlas, TCGA)应用微卫星不稳定性和测序法检测POLE基因突变,将EC分为4种分子亚型[2]:POLE突变型、高度微卫星不稳定型(高突变)、低拷贝型(子宫内膜样)和高拷贝型(浆液样)。该分子分型能更好地反映肿瘤的生物学行为和判断预后,具有较好的重复性和可行性,但该分子分型检测费用昂贵,难以推广。有研究发现,采用免疫组化染色和测序法检测将EC分为POLE突变型、错配修复缺陷型(mismatch repair deficient, MMRd)、无特异性分子谱型(no specific molecular profile, NMSP)和p53突变型,该分型检测费用低,易于临床推广[3-4]。WHO(2020)女性生殖肿瘤分类中采用该分子分型[5],目前国内对EC该分子分型的研究尚处于起步阶段。本文回顾性分析POLE基因突变,探讨4种分子分型在EC中的应用及临床意义。
1 材料与方法
1.1 临床资料收集2019年10月~2023年9月安徽医科大学附属阜阳医院病理科手术切除62例EC标本。患者均为子宫内膜样癌,年龄39~74岁,平均56.8岁;其中,年龄≤60岁者20例,>60岁者42例。
1.2 方法
1.2.1免疫组化 标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚连续切片,分别行HE、免疫组化EnVision法染色。另切取5 μm厚石蜡切片5~10张,脱蜡至水后刮取肿瘤组织,常规提取、纯化DNA后行POLE基因突变检测。患者术前均未行放、化疗和免疫治疗,临床病理资料完整。一抗MLHl(ES05)、MSH2(MX061)、MSH6(MX056)、PMS2(EP51)、ER(EP51)、PR(EP51)、Ki67(EP51)和p53(MX008),均购自福州迈新公司。二抗和免疫组化试剂盒购自上海罗氏公司,Benchmark Ventana全自动免疫组化染色,阳性染色定位于细胞核,用PBS代替一抗作阴性对照,用已知阳性切片或肿瘤间质淋巴细胞作阳性对照。MLHl、MSH2、MSH6和PMS2无肿瘤细胞染色判读为表达缺失,有1个或以上蛋白表达缺失则为MMRd型,无表达缺失则为错配修复正常[6-7]。p53阳性定位于细胞核,>80%的肿瘤细胞核染色或完全失表达则判为p53蛋白异常表达,否则判为野生型表达,p53免疫组化染色可准确反映p53基因突变[8]。
1.2.2荧光PCR检测 POLE基因检测试剂盒购自北京阅微基因公司,根据待测样本DNA浓度确定加入基因组DNA数量,PCR扩增体系为20 μL,扩增32个循环,具体操作步骤按试剂盒说明书进行。按WHO(2020)女性生殖系统恶性肿瘤分类中的分子分型标准进行综合判断[5]。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析,率的差异性用χ2检验或Fisher精确概率计算法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征本组62例EC组织学类型均为子宫内膜样癌;组织学分级:低级别(Grade I者37例和GradeⅡ者21例)、高级别(Grade Ⅲ者4例);无肌层浸润或浸润深度<1/2子宫肌层者51例,浸润深度≥1/2子宫肌层者11例。62例EC中有38例未行盆腔淋巴结清扫,无法评估淋巴结转移;24例患者行子宫+附件切除+盆腔淋巴结清扫术,其中3例有盆腔淋巴结转移;脉管侵犯9例,无明确脉管侵犯53例。按2023年国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)EC最新标准进行分期:I期50例,Ⅱ期8例,Ⅲ期4例(表1)。
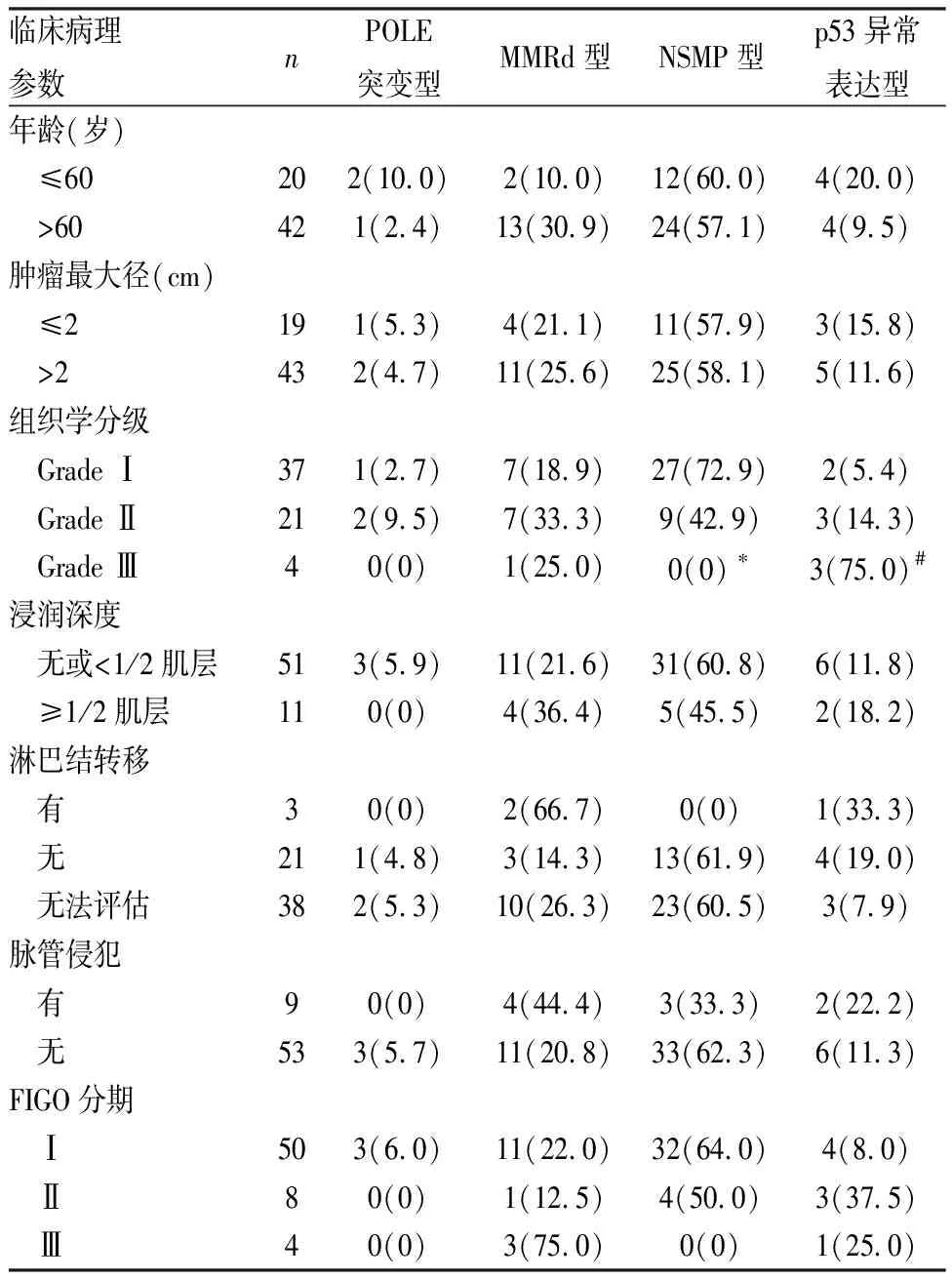
表1 EC分子分型与临床病理特征的关系[n(%)]
2.2 EC分子分型与临床病理特征的关系本组62例EC患者,首先采用免疫组化检测MMR、p53、ER、PR和Ki67等表达,其次用PCR法检测POLE基因的突变。结果显示:POLE基因突变型3例(3/62,4.8%),MMRd型15例(15/62,24.2%),NMSP型36例(36/62,58.1%),p53突变型8例(8/62,12.9%)。3例POLE基因突变均在第14号外显子,碱基变化为c.1366G>C,氨基酸变化为p.A456P(图1),其属于POLE基因上的致病性变异(PMID:31829442),可能导致POLE核酸外切酶失活。3例患者组织学分级均为低级别,FIGO分期均为I期;MMRd型患者15例(15/62,24.2%),其中MSH2表达缺失5例,PSM2表达缺失4例,MSH6表达缺失2例,MLH1表达缺失1例,MSH2和MSH6共同表达缺失2例,MLH1和PSM2共同表达缺失1例(图2)。15例MMRd型患者中,有1例可见p53蛋白过表达,2例完全失表达;组织学分级中,Grade I级7例,Grade Ⅱ级7例,Grade Ⅲ级1例;FIGO分期I期11例,Ⅱ~Ⅲ期4例,可见2例淋巴结转移。NMSP型36例(36/62,58.1%)组织学分级均为低级别(P<0.05),与其它临床病理特征均无关(P>0.05),FIGO分期为Ⅰ~Ⅱ期,未见组织学Ⅲ级和FIGO Ⅲ期患者。p53突变型8例(8/62,12.9%),其中>80%的肿瘤细胞核染色3例,p53蛋白完全失表达5例,8例p53异常表达患者中,病理组织学Grade I级2例、Grade Ⅱ级3例和Grade Ⅲ级3例,p53突变型与组织学高级别(Grade Ⅲ级)有关(P<
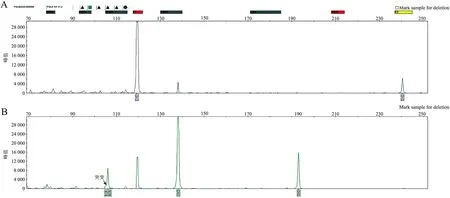
图1 A.正常组织对照,未见POLE基因突变,B.POLE基因第14外显子突变(箭头),碱基变化为c.1366G>C,氨基酸变化为p.A456P(PMID:31829442)
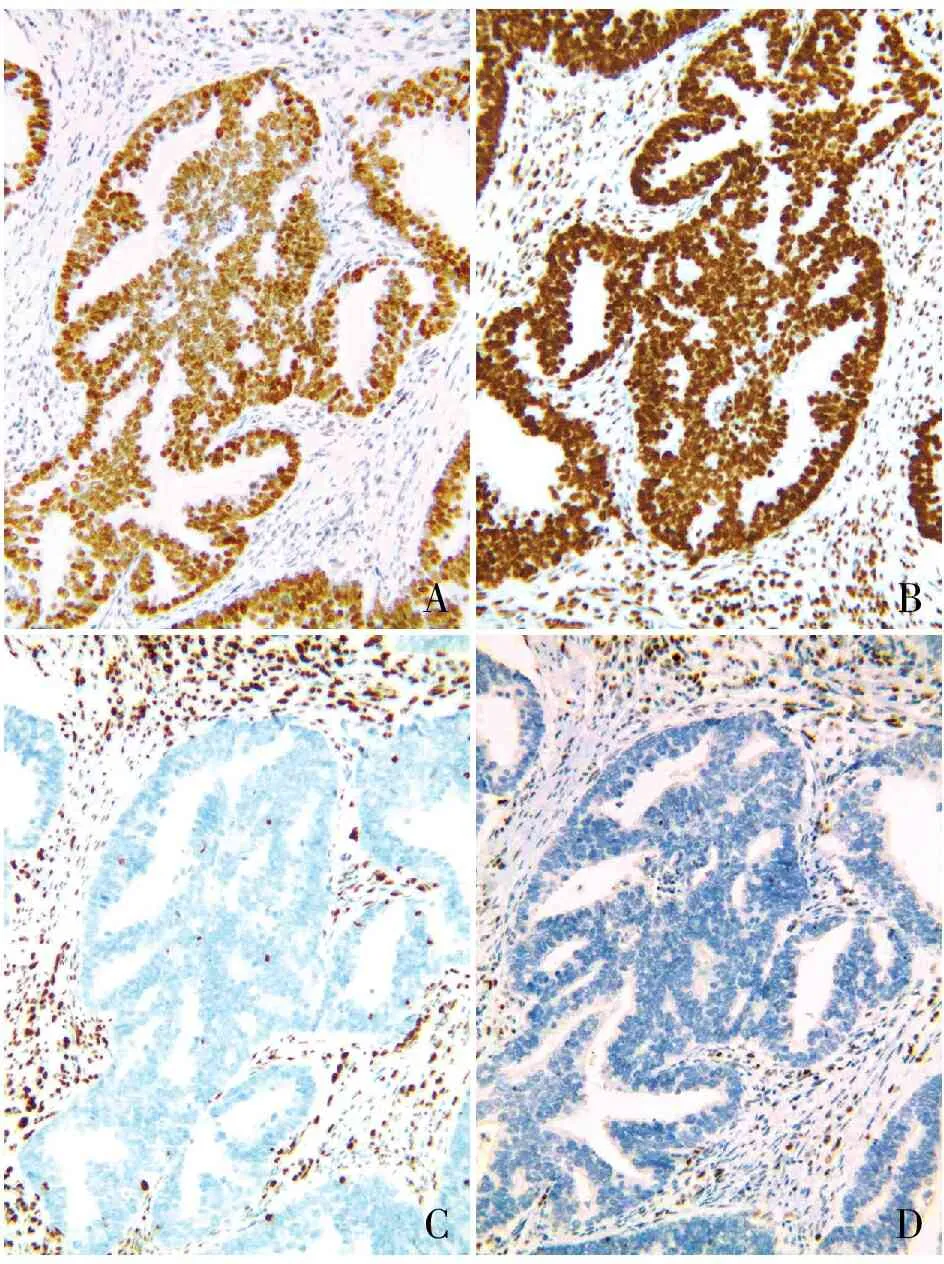
ABCD
0.05,图3、4);浸润深度≥1/2子宫肌层者2例,可见淋巴结转移1例,FIGO分期为I期4例,Ⅱ期3例,Ⅲ期1例,其组织学分级、淋巴结转移和临床分期的几率高于其它分子分型组(表1)。另见1例p53蛋白过表达和2例完全失表达患者同时伴MMRd,按WHO(2020)女性生殖系统恶性肿瘤分子分型方案归入MMRd型。
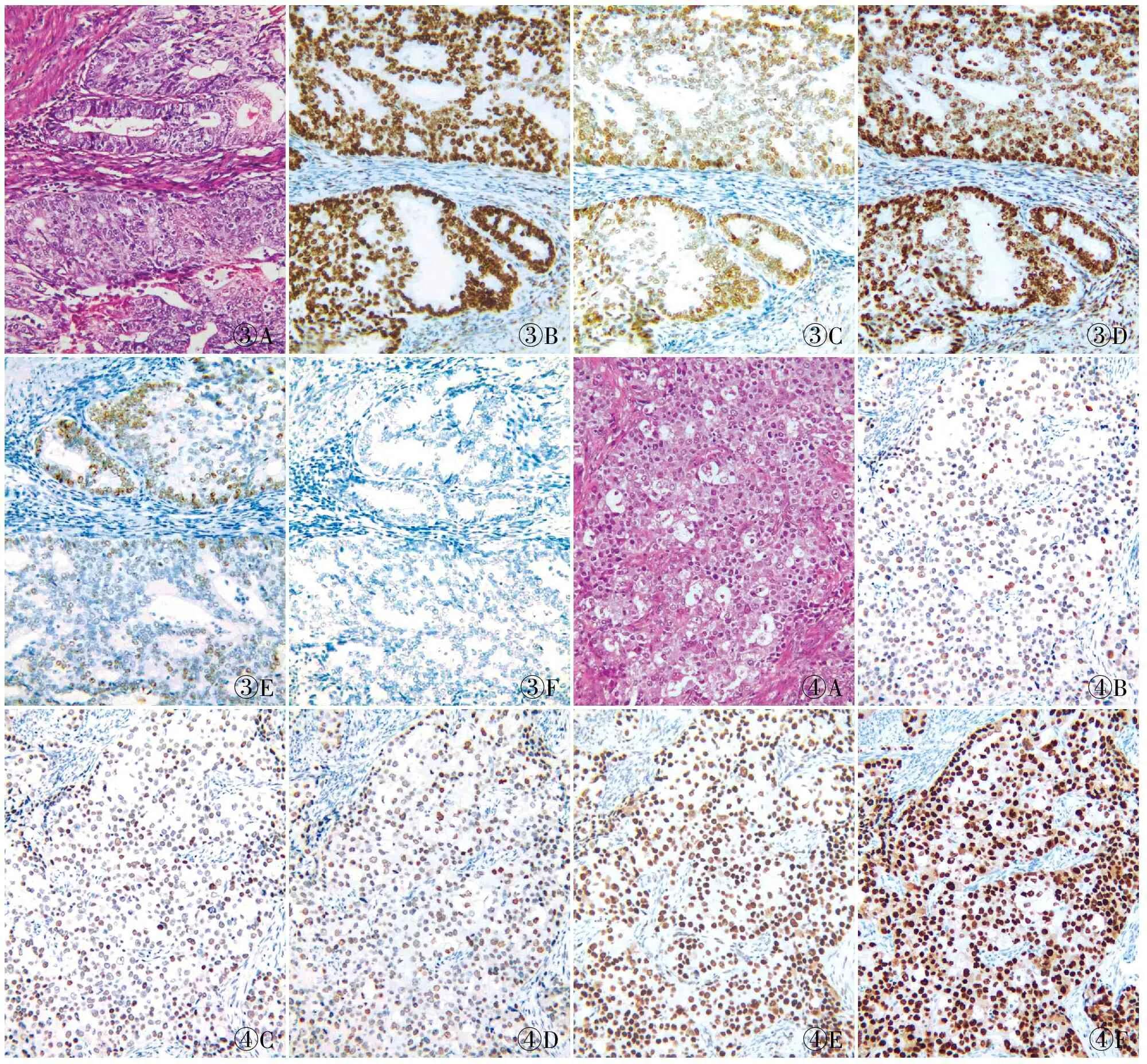
③A③B③C③D③E③F④A④B④C④D④E④F
3 讨论
2013年美国TCGA对EC进行分子分型,该分型为判断患者预后和临床治疗提供重要参考。WHO(2020)女性生殖系统肿瘤分类采用该分子分型,并优化了检测方法[5]。2021年美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)推荐其在临床中应用[9],2021年中国专家组制定《子宫内膜癌分子检测中国专家共识(2021)》[10]。本组收集62例EC患者标本,在已进行免疫组化检测MMR、p53蛋白表达的基础上检测POLE基因突变,探讨EC的临床病理特征和4种分子分型在EC中的临床意义,结果显示EC患者多见于中老年人,平均年龄56.8岁,组织学均为子宫内膜样癌,以低级别子宫内膜样癌多见;浸润深度≥1/2子宫肌层者较少,淋巴结转移率低,FIGO分期多为Ⅰ~Ⅱ期,肿瘤增殖指数低,多为雌激素依赖性肿瘤,提示多数患者预后良好,与文献报道EC临床病理特征一致[3-5]。WHO(2020)女性生殖系统肿瘤分类中POLE基因突变率约为12%[5],Eggink等[11]报道EC中POLE基因突变发生率7%~12%,且POLE突变在I期高级别癌症患者中多见。本组62例EC患者中,根据免疫组化和PCR检测显示:POLE基因突变型3例、MMRd型15例、NMSP型36例和p53异常表达型8例,分别占4.8%(3/62)、24.2%(15/62)、58.1%(36/62)和12.9%(8/62)。POLE突变率和p53异常阳性率略低于文献报道,可能与样本量低和PCR法不能完全检测到POLE基因突变有关,需进一步行二代测序(next generation sequencing, NGS)验证。分析不同分子亚型与临床病理特征关系发现,3例POLE基因突变患者均为子宫内膜样癌,2例为WHO Ⅱ级、1例为WHO I级,均未见脉管侵犯和淋巴结转移,FIGO分期为I期,提示患者组织学有一定异型性,临床分期一般较早,患者可能预后较好,与文献报道一致[12]。POLE突变型EC患者预后较好可能与肿瘤突变负荷(tumor mutation burden, TMB)较高有关[12],基因突变刺激机体产生大量肿瘤新生抗原,诱发机体抗肿瘤免疫反应。本组3例患者病理组织学在癌组织周围均可见较多淋巴细胞浸润,可能与该机制有关。鉴于本组病例数较少,需扩大样本量检测并进一步随访证实。
微卫星是基因组中的一类短串联重复DNA序列,一般由1~6个核苷酸组成,其稳定性依赖于MMR进行修复,包括MLH1、MSH2、MSH6和PMS2,如≥1个蛋白表达缺失导致MMRd型或微卫星不稳定性。评估MMR状态对临床免疫检查点抑制剂的应用至关重要,传统的PCR(即微卫星不稳定性PCR)是确认MMR状态的金标准。Amemiya等[13]应用免疫组化检测14种肿瘤类型284例患者的319个样本中MMR状态,与微卫星不稳定性PCR检测符合率为98.1%(313/319),提示单独采用免疫组化检测可评估MMR的状态。研究发现具有MMRd型的EC常伴不良预后因素,如组织学分级较高、脉管侵犯等[14]。25%~30%的EC患者为该亚型,免疫检查点抑制剂可改善MMRd型患者的抗肿瘤免疫反应,提高患者临床治疗效果[2]。本组62例EC中免疫组化检测发现15例为MMRd型,约占24.2%(15/62),与文献报道一致[15],其中MSH2、PSM2、MSH6和MLH1蛋白单独表达缺失分别为5、4、2和1例,另见2例MSH2/MSH6共同表达缺失和1例MLH1/PSM2共同表达缺失。15例MMRd型患者病理组织学分级中,Grade Ⅰ级7例,GradeⅡ级7例,Grade Ⅲ级1例;浸润深度≥1/2肌层和淋巴结转移率增高,提示与POLE突变型相比,MMRd型患者可能预后相对较差。部分EC患者同时具有POLE突变型与其它基因突变类型,如POLE突变/MMRd或MMRd/p53突变[16]。本组15例MMR缺失表达患者中,可见3例p53异常表达,可能与MMR缺失的EC患者继发p53基因突变有关,应归入MMRd亚型[16]。
研究发现:EC的4种分子分型中,p53异常型多为POLE野生型、MMR正常,临床需行放、化疗,预后较差,50%~70%的EC患者死亡与p53异常表达有关。p53异常在浆液性EC中的比例约为93%,在癌肉瘤中约85%,在透明细胞EC中约38%,在高级别(Grade Ⅲ级)子宫内膜样EC中约为22%,而在低级别(Grade I和Ⅱ级)子宫内膜样EC中仅为5%[17],提示p53异常是判断EC预后的指标。Vermij等[18]发现p53行免疫组化染色与NGS检测一致性为90.7% (95%CI:87.6%~93.8%),敏感性为83.6%(95%CI:79.7%~87.5%),特异性为94.3% (95%CI: 91.8%~96.7%),提示p53免疫组化染色异常可代替p53基因突变检测,在子宫内膜活检标本中亦达到有效验证[8]。本组62例EC中,p53异常表达8例,发生率约12.9%(8/62)。p53异常表达与组织学高级别有关(P<0.05),Ki67增殖指数较高、淋巴结转移率高、FIGO分期晚提示患者预后较差,可能是由于p53基因突变导致肿瘤抑制功能减弱,促进肿瘤恶性转化和侵袭转移等[19]。本组8例p53突变型患者中有3例p53蛋白过表达,提示p53基因发生错义突变;5例p53蛋白完全失表达,提示p53基因发生无义突变。另见1例p53蛋白过表达和2例完全失表达患者同时伴错配修复缺陷,按WHO分子分型归为MMRd型。本组显示NSMP型36例(58.1%,36/62),略高于文献报道,可能与POLE基因突变检出率和p53蛋白异常表达检出率较低有关。该组患者均为低级别,NSMP型与组织学低级别有关(P<0.05)。NSMP型患者肿瘤浸润深度较浅,常无淋巴结转移,FIGO分期较早,提示该组患者预后相对较好。文献报道,NSMP型患者与MMRd型相比,预后无明显差异[20]。
总之,WHO(2020)女性生殖系统肿瘤的分子分型对EC患者治疗和预后有重要意义。部分EC患者有多重分子表型,如POLE基因突变型和MMRd型可继发p53基因突变,仅采用免疫组化检测p53蛋白可能会因异常表达而误判为p53异常型EC。虽然免疫组化检测p53和MMR蛋白表达与基因检测一致性高,但仍有少部分病例不一致导致错误的分子分型。本实验病例数较少,还需积累更多样本以进一步分析其作用机制。

