中肾样腺癌的病理学诊断与鉴别诊断
方 媛,黄文斌
中肾腺癌(mesonephric adenocarcinoma, MA)起源于正常或增生的中肾(Wolffian)管残余,属于罕见的侵袭性肿瘤,最常发生于子宫颈侧壁。2016年McFarland等[1]首次报道了中肾样腺癌(mesonephric-like adenocarcinoma, MLA),其属于罕见的妇科肿瘤,收入WHO(2020)女性生殖系统肿瘤分类中[2]。MLA在形态学、免疫表型和分子改变上与MA有重叠,易与其他类型的妇科肿瘤混淆。由于MLA有较高的侵袭性,FIGO分期常为Ⅱ~Ⅳ期,易在早期复发和远处转移。因此,正确诊断MLA有重要意义。本文对MLA的临床病理学特征、免疫表型、分子特征、鉴别诊断、治疗和预后等进行全面阐述,为临床与病理医师提供参考。
1 组织学发生
在胚胎早期发育中,Wolffian管和副中肾(Müllerian)管共存[3]。男性Wolffian残余物形成附睾和输精管,睾丸来源的睾酮驱动Wolffian管产生附睾、输精管和精囊[4]。由于女性缺乏抗苗勒激素,Müllerian管发育成输卵管、子宫、子宫颈和阴道的上1/3,女性睾酮的缺失会导致Wolffian管的退化。然而,小的残余物或包涵体可能会持续存在,它们通常分布于子宫颈外侧壁间质的深处,但这些胚胎残余也存在于卵巢门、阔韧带、子宫体和阴道壁。在极少数情况下,也可见于肾盂和肾实质、膀胱颈和纤维腺体周围。MLA与Wolffian管起源的MA不同,前者是发生于子宫内膜和卵巢的新肿瘤类型,肿瘤中无胚胎的Müllerian管残余。MLA被认为起源于Müllerian管,卵巢MLA与Müllerian管起源的病变共存,如子宫内膜异位症、浆液性交界性肿瘤和低级别浆液性癌,支持Müllerian管病变可能是MLA的起源[5-8]。此外,MLA与Müllerian管源性肿瘤混合性存在时,两者具有相同的驱动基因(KRAS/NRAS)突变和基因组拷贝数变异,各自也有不同的分子改变。基于形态学和分子遗传学的分析,存在两种主流假说:(1)MLA可能直接来源于Müllerian管,并向Wolffian管方向分化;(2)与女性生殖系统中的许多苗勒源性肿瘤具有肠道分化特征相似,MLA与Müllerian源性肿瘤在来源上密切相关,两者可能起源于同一早期干细胞,在KRAS/NRAS突变驱动下发生恶变,并在差异性分子改变的作用下向苗勒管和(或)Wolffian管方向分化[9-10]。
2 临床特征
MLA最常发生于子宫,其次为卵巢,少数可见于输卵管、结肠系膜或泌尿道[11-13]。MLA患者好发于绝经后妇女,发病年龄26~91岁,平均59岁,中位年龄60岁。临床表现为盆腔巨大肿物、阴道出血、异常排液和腰腹部疼痛、尿频等,患者常伴CA125、CA199和HE4等血清肿瘤标志物升高。
3 组织学特征
卵巢MLA可单侧或双侧发生,肿瘤最大径4~35 cm,切面呈(囊)实性,实性区灰白间灰褐色,可伴出血、坏死。子宫MLA常在子宫内膜面形成1个隆起、息肉状或菜花样的肿块,肿瘤最大径1.5~14.0 cm,68%患者有子宫深肌层的浸润[9]。
MLA中存在多种组织学特征,常混合存在且相互融合,如管状和乳头状(图1),腺样(假内膜样)(图2),管囊状和圆形小管,腔内含有嗜酸性分泌物(图3、4),裂隙样、梁状、网状和筛状(图5),条索状伴透明、实性(图6)和梭形,肾小球样。该嗜酸性物质是MLA的典型表现(>90%病例出现,但局灶),缺乏中肾残余[14-15]。肿瘤细胞假复层扁平、立方或柱状,胞质嗜酸,胞界不清,细胞核圆形、卵圆形,染色质粗颗粒至透明泡状,细胞核均匀和深染,可见小核仁(图7、8)。核膜不规则,重叠并可见核沟。细胞一致,少量苍白的嗜酸性或罕见透明细胞质,核呈泡状或透明,可有胞质透亮、鞋钉样核改变(约20%)。类似于甲状腺乳头状核特征,常出现在腺样或乳头状结构中。细胞轻至中度异型性,部分见高度细胞异型性,桑椹样小体罕见[16]。癌旁组织中可见伴非典型结构和核特征的Wolffian管增生。子宫MLA大部分来源于子宫内膜,并向肌层浸润。卵巢MLA常伴子宫内膜异位病灶,少数情况下,可与其他类型Müllerian源性肿瘤合并发生。
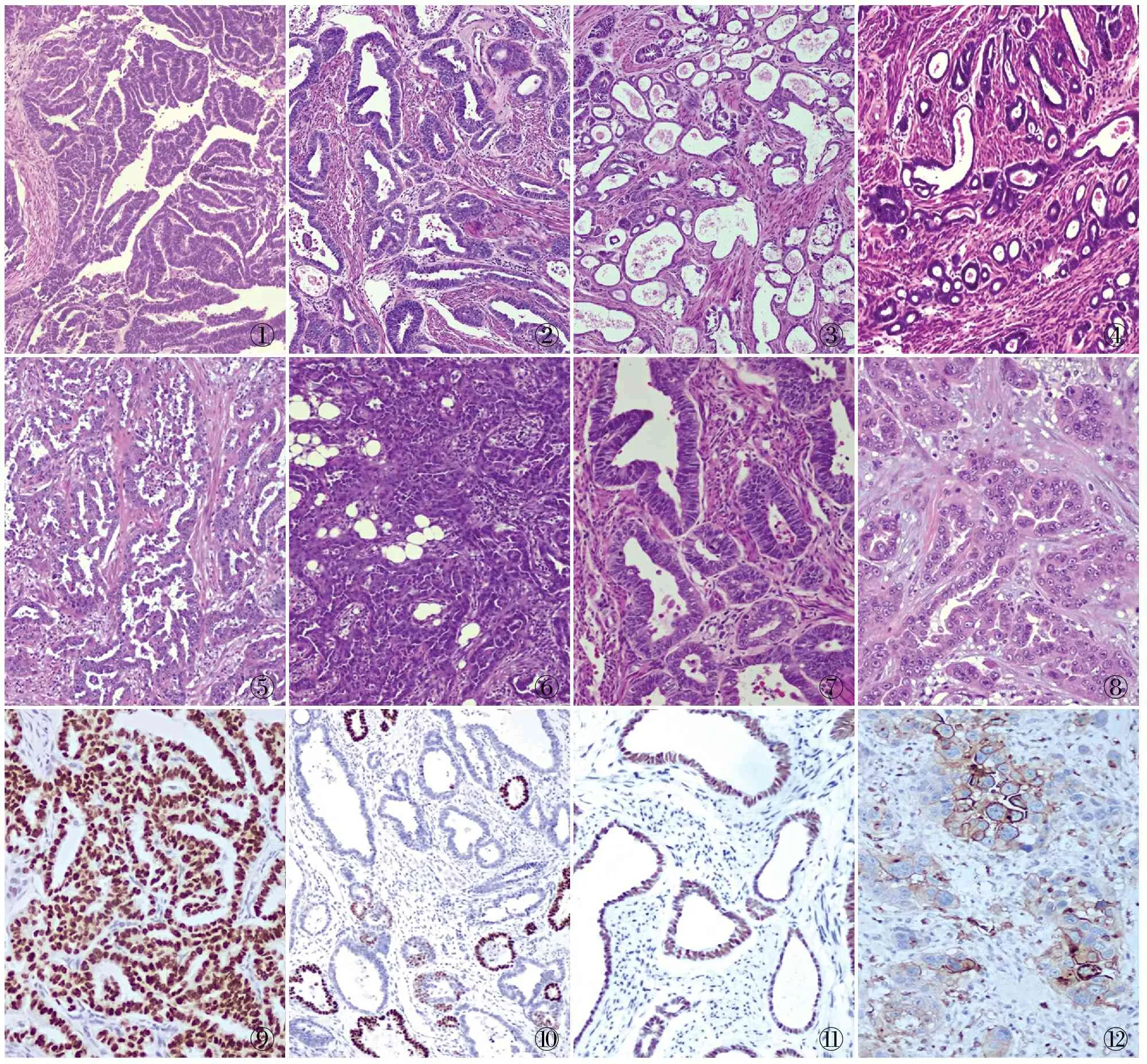
①②③④⑤⑥⑦⑧⑨⑩
4 免疫表型
MLA具有独特的免疫表型,TTF-1(图9、10)、GATA3(图11)、CD10(图12)、 PAX2和DNA错配修复蛋白(MLH1、MSH2、MSH6和PMS2)均阳性,ER、PR、WT-1、CR阴性或仅局部阳性[17-18]。然而,Angelico等[19]报道1例混合性MLA、子宫内膜样腺癌和去分化癌中,MLH1和PMS2均阴性。Pors等[20]比较GATA3、TTF-1、CD10和Calretinin诊断MLA的敏感性和特异性,发现GATA3特异性较高,但敏感性较低,仅在少数细胞中呈阳性(<10%)。实性区GATA3与管状区和乳头状区相比,其阳性减少。TTF-1和GATA3有时存在反向表达模式,即TTF-1阳性病例GATA3可阴性,反之亦然;或者TTF-1阳性染色区域GATA3阴性,反之亦然[20]。此外,CD10在大多数MLA中可呈阳性,多数在腔缘中呈阳性[21];ER在子宫MLA中通常阴性,在少数MLA中ER局灶阳性,弱-中等强度。大多数MLA中PR为阴性,但也有少数显示PR为局灶阳性或斑片状阳性。有文献报道,多数MLA中p16呈非弥漫阳性,p53呈野生型等[22]。
5 分子遗传学特征
二代测序(next-generation sequencing, NGS)分析显示,绝大多数MLA均存在KRAS突变、1p缺失和1q增加,其中KRAS基因12号密码子突变(G12D、G12V和G12D)约占90%,其他如ARID1A、NRAS或PIK3CA的突变发生频率较低。最近研究表明,KRAS突变是子宫和卵巢MLA的独特分子特征,提示携带KRAS突变参与MLA的发生[14,23]。文献报道,大部分MLA无TP53突变、POLE核酸外切酶域热点突变和MMR阴性[9-10]。此外,MLA与MA均具有中等水平的基因组不稳定性,即整条染色体或染色体长臂/短臂拷贝数改变。MLA中拷贝数改变的染色体区段主要包括:1q、1p、3q、4p、4q、5p、6q、Chr7-Chr12、13q、17p、18p、19p、20q、21q和22q 等,其中1q、Chr10和Chr12是最常发生DNA片段扩增的区段,而1p是频繁发生DNA片段丢失的区段[5,9-10]。染色体1q、Chr10和Chr12的高频突变与发生子宫内膜样癌的预后不良相关,同时也与中肾癌和中肾样癌的转移相关[9,24]。Chang等[25]报道1例起源于子宫内膜异位症的卵巢MLA,有KRAS、TP53、PPP2R1A和SPEN突变。
6 鉴别诊断
6.1 MAMLA多发于子宫内膜和卵巢,而MA多发于子宫颈,肿瘤周围常伴中肾残余或非典型Wolffian管增生。活检标本中两者的鉴别较为困难,可采用分子生物学检测相关分子改变,MLA常有KRAS、ARID1A、NRAS或PIK3CA突变,而MA常无这些基因改变。
6.2 子宫内膜样腺癌当MLA出现腺样结构或性索样/小梁状结构时可与子宫内膜样腺癌混淆,但子宫内膜样腺癌形态较单一,腺腔内无嗜酸性分泌物,细胞核杆状,复层,肿瘤内可见桑椹样化生,周围可见子宫内膜不典型增生。免疫组化标记ER、PR、CD10、TTF-1和GATA3有助于两者鉴别,子宫内膜样腺癌表达ER、PR,通常不表达CD10、TTF-1和GATA3;MLA则相反。最近有研究发现,18%的子宫内膜样腺癌可表达至少一种中肾/中肾样分化标志物(CD10、TTF-1和GATA3)[26]。因此,MLA诊断需根据组织学改变、免疫表型和分子检测等综合分析。
6.3 浆液性癌MLA中的裂隙状、筛网状或乳头状结构以及胞质嗜酸性,可与浆液性癌类似。浆液性癌常有TP53基因突变,p16呈弥漫性斑块表达和WT-1弥漫性核表达,不表达TTF-1、GATA3和CD10。
6.4 透明细胞癌透明细胞癌和MLA均有多种结构模式,但在MLA中胞质透亮较少见。免疫表型:透明细胞癌表达Napsin A和HNF-1β,MLA表达GATA3和TTF-1。另外,1个或更多MMR蛋白表达缺失支持透明细胞癌的诊断。
6.5 癌肉瘤MLA中含有梭形细胞成分时易误诊为癌肉瘤,而癌肉瘤中的细胞有明显异型性,免疫组化显示肉瘤成分可为p53突变型异常表达。MLA中的梭形细胞通常形态温和,p53呈野生型。
6.6 恶性甲状腺肿或转移性甲状腺乳头状癌卵巢MLA细胞核具有甲状腺乳头状癌的核特征和TTF-1表达,易误诊为恶性甲状腺肿或转移性甲状腺乳头状癌。免疫组化标记表达TG和肿瘤周围有无畸胎瘤有助于鉴别,恶性甲状腺肿常伴畸胎瘤和表达TG。
6.7 中肾管的女性附件肿瘤(female adnexal tumor of Wolffian origin, FATWO)和STK11附件肿瘤FATWO有多种组织学结构,常见裂隙状结构,免疫组化标记表达ER,而PAX8、TTF-1和GATA3常不表达。虽然STK11附件肿瘤也有多种组织学结构,但是位于卵巢外(输卵管旁),免疫组化表达性索标记inhibin、Calretinin和WT-1,而PAX8、GATA3和TTF-1常不表达。
7 治疗与预后
子宫MLA主要采用手术切除治疗,大多数患者采用全子宫+双侧输卵管-卵巢切除术和盆腔淋巴结清扫,部分患者也进行主动脉旁淋巴结清扫[15,27-28]。目前,卵巢MLA的手术方式报道较少,多采用网膜切除的肿瘤细胞减灭术。子宫MLA患者行辅助性放疗,约1/5的子宫MLA患者和卵巢MLA进行术后卡铂和紫杉醇治疗[15,29]。由于MLA激素受体不表达或仅有限表达,MLA患者对激素治疗可能无效。KRAS基因突变是MLA最常见的分子异常,靶向KRAS基因改变的抑制剂,如Sotarasib批准于KRAS p.G12C突变的结直肠癌和肺癌的治疗,对MLA可能也有一定的疗效,需进行临床试验。
MLA是高度侵袭性的恶性肿瘤,子宫MLA与子宫内膜样腺癌甚至FIGO G3相比,其患者无进展生存低[22]。子宫MLA患者预后差,60%~80%的患者有复发或死亡。最常见的远处转移部位是肺,其次是肝脏。
文献报道,卵巢MLA患者无瘤生存期为24.5个月,无进展生存率为68%,总生存率为71%[30-31]。Deolet等[12]报道5例不同FIGO分期的卵巢MLA患者,有3例在平均随访22.4个月后无瘤生存,1例于11个月后复发,1例(FIGO ⅣB期)在多药化疗后8个月表现为部分缓解,提示卵巢MLA比子宫MLA患者预后好。
综上所述,MLA是具有独特组织学、表达Wolffian管标志物(GATA3、TTF-1、CD10)和常有KRAS基因突变、生物学行为侵袭性的新类型肿瘤。MLA好发于子宫和卵巢,与子宫和卵巢其他肿瘤的形态学相似,需进行鉴别。治疗以手术切除为主,易发生肺转移,患者预后较差。

