发酵乳杆菌GBJ 荚膜多糖结构、抗氧化及免疫活性研究
孙靖辰,高永娇,潘禹溪,邰梦蝶,赵婧,王坤,王彦杰,鹿保鑫
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.黑龙江八一农垦大学生命科学与技术学院)
乳酸菌胞外多糖(Exopolysaccharide,EPS)是乳酸菌在生长代谢过程中分泌到细胞壁外,常渗于培养基的一类糖类化合物,有的依附于微生物细胞壁形成荚膜,称为荚膜多糖(Capsular polysaccharides,CPS);有的进入培养基形成粘液,称为粘液多糖(Slime-polysaccharides,SPS)[1-2],它们都是微生物适应环境的产物。
荚膜对于细菌的生存具有重要的意义,因为细菌不仅可以利用荚膜抵御外界不良环境,还能保护自身不受白细胞吞噬[3],同时还可有选择性地黏附到特定细胞表面,从而表现出专一的攻击能力。多糖作为荚膜的重要组成成分,在生理活性上起着至关重要的作用。目前已知鼠李糖乳杆菌GG(ATCC 53103)是一株著名的益生菌菌株,已被证明能产生荚膜多糖[4]。Yang 等[5]从传统酸菜中成功分离出L.rhamnosus JAAS8,研究发现SPS 由相对摩尔比为4∶1∶1 的半乳糖、葡萄糖和N-乙酰葡萄糖胺组成,CPS 由相对摩尔比为5∶1 的半乳糖和N-乙酰葡萄糖胺组成。然而,目前关于细菌CPS 的研究多集中于伤寒杆菌和肺炎球菌等致病菌,对于乳酸菌CPS 的研究较少,且大多以初级结构为主,对生理活性的研究更是少有报道,这十分不利于未来的开发和应用。多糖作为一类重要的活性物质,在抗氧化方面已显示了诱人的前景。有研究表明乳酸菌CPS 具有清除ROS 的抗氧化作用,作用机理是多糖可以通过捕捉脂质过氧化链式反应中产生的ROS,从而阻断或减缓脂质过氧化的进行,达到抗氧化的目的,而ROS 也可对体内细胞造成损害,迫使部分CPS 产生免疫原性,从而刺激机体产生免疫反应[6]。
近年来,由于巨噬细胞在免疫系统中起着至关重要的作用,越来越多的研究学者致力于对具有巨噬细胞免疫调节活性的EPS 进行了研究和开发。因为它们是最早识别感染因子的细胞,对细胞介导的体液环境至关重要[7]。Deng 等[8]测定了EPS 对RAW264.7 细胞NO 和相关细胞因子产生的影响,结果表明EPS 对NO 分泌起到促进作用,进而可以显著增强机体的抗免疫活性,这说明多糖可以作为一种安全有效的免疫调节物质,在保健和医药领域中具有广泛的应用前景。对乳酸菌CPS 的结构和生物活性开展一定的研究,将有利于促进其未来的开发和应用。
基于此,对L.fermentum GBJ 的CPS 进行了提取,并对其初级结构以及体外抗氧化和免疫调节活性进行研究。希望为开发新型、安全、有效的乳酸菌益生产品提供参考。
1 材料和方法
1.1 菌株与培养基
Lactobacillus fermentum GBJ(Genbank 登录号:ON999190):分离自贵州毕节家庭自制酸菜。HP 液体培养基:20 g 葡萄糖、5 g 柠檬酸三胺、20 g 大豆蛋白胨、6 g 酵母浸粉、0.05 g MnSO4、0.4 g MgSO4、0.07 g FeSO4、1 mL 吐温-80 加热溶解后定容于1 L 的去离子水中,121 ℃高压灭菌15 min 备用。
1.2 主要试剂仪器
主要试剂:小鼠巨噬细胞RAW264.7(中国科学院上海细胞库);DMEM 培养基(Biosharp 公司);胎牛血清(美国Clark-Bioscience 公司);细胞因子(IL-1β、IL-6、IL-10 和TNF-α)试剂盒(上海朗顿生物技术有限公司);其他所有试剂均为国产分析纯。
主要仪器:LDZF-30KB 灭菌锅(上海申安医疗器械厂);LRH-150 生化培养箱(上海一恒科学仪器有限公司);GL-21M 高速冷冻离心机(上海湘仪生物技术有限公司);ICS5000 离子色谱(美国Thermo 公司)。
1.3 L.fermentum GBJ CPS 的提取
参照Uemura 等[9]研究方法对CPS 进行提取。将甘油保藏的菌种二次活化后,以3%(v·v-1)的接种量转接于HP 液体培养基中,33 ℃条件下培养24 h。发酵液于10 000 rpm,4 ℃条件下离心10 min,收集菌体,用相对于发酵液一半体积10 mM 的磷酸盐缓冲液(pH=6.7,4 ℃)清洗菌体,用原发酵液1/2 倍体积的10 mm 磷酸盐缓冲液(pH=6.7,含20 μg·mL-1溶菌酶)将菌体混匀,并在37 ℃,140 rpm 条件下恒温震荡处理48 h。结束后在11 000 rpm,4 ℃条件下离心15 min,弃去沉淀。将上清液减压浓缩后加入3 倍体积的无水乙醇,4 ℃静置过夜。然后离心收集沉淀,去离子水溶解,经透析、冻干及Sevage 法除蛋白[10]得到CPS 样品。
1.4 CPS 常规组成成分分析
CPS 样品的中性糖、蛋白、硫酸基以及糖醛酸含量,分别采用硫酸苯酚法、考马斯亮蓝法、氯化钡-明胶比浊法以及间羟基联苯比浊法进行测定[3]。
1.5 单糖组成分析
称取适量多糖样品,采用2 M 三氟乙酸溶液121 ℃处理2 h,然后通入氮气吹干,重复使用甲醇清洗2~3次,最后加入无菌水溶解待测。采用Thermo ICS5000 离子色谱系统对单糖组成进行分析,色谱柱为DionexTMCarboPacTMPA20(150×3.0 mm,10 μm);流动相A(H2O),流动相B(0.1 M NaOH),流动相C(0.1 M NaOH,0.2 M NaAc);洗脱梯度:0 min A 相/B相/C 相(95∶5∶0,V·V-1),26 min A 相/B 相/C 相(85∶5∶10,V·V-1),42 min A 相/B 相/C 相(85∶5∶10,V·V-1),42.1 min A 相/B 相/C 相(60:0:40,V·V-1),52 min A 相/B 相/C相(60∶40∶0,V·V-1),52.1 min A 相/B 相/C 相(95∶5∶0,V·V-1),60 min A 相/B 相/C 相(95∶5∶0,V·V-1);进样量为5 μL;流速0.5 mL·min-1;柱温为30 ℃。采用单糖标准品对样品的单糖组成进行定性和定量分析。
1.6 红外光谱分析
称取1.3 中CPS 样品1 mg,以1∶100 比例与KBr粉末充分混合,经研钵充分研磨后在红外压片机上制成透明薄片,进行压片处理,采用红外光谱仪在400~4 000 cm-1范围内进行谱图扫描。
1.7 L.fermentum GBJ CPS 体外抗氧化活性分析
按照Liu 等[11]和Xiao 等[12]研究方法,测定CPS 的DPPH、羟基、ABTS+自由基清除活性。以抗坏血酸(Vc)作为阳性对照。
1.8 RAW 264.7 细胞免疫分析
1.8.1 RAW 264.7 细胞的培养
小鼠巨噬细胞系RAW264.7 于含10%胎牛血清和1%双抗(青/链霉素)的DMEM 完全培养基中生长,细胞培养瓶置于37 ℃、5% CO2培养箱中培养。当细胞铺满培养瓶底部80%时进行传代,将培养至对数生长期的细胞用于后续实验。
1.8.2 细胞活力的检测
采用MTT 法检测细胞活性[13]。取对数生长期的RAW264.7 细胞,并调整最终浓度约2×105细胞·mL-1的密度,接种于96 孔板中,每孔100 μL,于37 ℃、5%CO2条件下培养24 h,使细胞贴壁。然后取出培养板,吸去旧培养基,设置不接种细胞的空白组,对照组加入100 μL DMEM 完全培养液,样品组依次加入31.25、62.5、125、250、500 μg·mL-1样品溶液各100 μL,每组设置4 个重复。孵育24 h 后,加入100 μL MTT(1 mg·mL-1)工作液,继续培养4 h,弃去MTT 工作液,加入100 μL DMSO 轻微震荡以溶解结晶,室温条件下放置10 min,用酶标仪在570 nm 波长处测定吸光度。细胞活力计算公式如下:
1.8.3 中性红法检测细胞吞噬能力
根据You 等[7]研究方法,采用中性红法测定细胞吞噬活性。将RAW264.7 细胞以2×105细胞·mL-1的密度接种于96 孔板中过夜培养,吸去上清液,设置空白组、阳性对照组和样品组,其中空白组加入100 μL PBS 缓冲液,对照组加入100 μL DMEM 完全培养液,阳性对照组加入100 μL 1 μg·mL-1的LPS,并基于1.8.2 的试验结果设置无细胞毒性的4个浓度梯度(31.25、62.5、125、250 μg·mL-1,100 μL)的样品组。培养24 h 后,弃去培养液,每孔加入100 μL体积分数为0.1%中性红溶液染色,静置30 min 后弃除,PBS 洗涤3 次,每孔加入100 μL 醇酸裂解液(乙醇和冰乙酸等体积混合),室温静置2 h,测定540 nm波长处的吸光度,中性红吞噬率计算公式如下:
1.8.4 细胞因子分泌水平测定
细胞按2×105细胞·mL-1的密度接种于96 孔板中过夜培养,然后依照组别加样预孵12 h,取100 μL培养基上清液,根据试剂盒说明检测培养液中细胞白介素(interleukin,IL)-1β、IL-6、IL-10 和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的含量。
1.9 数据分析
采用SPSS 20.0 对数据进行统计分析。采用Duncan’s ANONA 进行多重比较,不同处理之间P<0.05 表明差异性显著。
2 结果与分析
2.1 常规组成成分分析
经测定,通过提取获得的L.fermentum GBJ CPS的产量为124.37 mg·L-1。基本组成成分分析表明,CPS 的中性糖含量为92.54%,蛋白含量为3.06%,表明多糖中可能存在糖蛋白结构[14]。CPS 中硫酸基含量为1.04%,但未检测到糖醛酸。
2.2 单糖组成分析
标准单糖的离子色谱分析结果如图1(A)所示,所有的单糖均被较好的分离,保留时间从小到大依次为岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸、甘露糖醛酸、古罗糖醛酸。CPS 的单糖组成色谱分析图如图1(B)所示,可知CPS 主要由半乳糖和葡萄糖两种单糖组成,其摩尔比为3.64∶1.00。Li 等[15]发现L.helveti-cus MB2-1 的CPS 主要由摩尔比为1.33∶2.75∶1.00 的半乳糖、葡萄糖和甘露糖组成,而Yang 等[5]对L.rhamnosus JAAS8 的CPS 进行测定发现,CPS 由相对摩尔比为5∶1 的半乳糖和N-乙酰葡萄糖胺的组成。这表明不同乳酸菌菌株产生的CPS 单糖组成有所差异,这可能是由于菌株特异性导致的[16]。

图1 标准单糖A 及CPS 单糖组成B 的离子色谱图Fig.1 Ion chromatogram of monosaccharide standard A and CPS monosaccharide composition B
2.3 红外光谱分析
CPS 在400~4 000 cm-1范围内的红外光谱如图2 所示,CPS 具有多糖的典型特征吸收峰。CPS 在3 295.23 cm-1处存在宽而强的吸收峰,这是由O-H键伸缩震动导致[17];2 893.07 cm-1处的吸收峰可能是由多糖中C-H 和C-O 基团的伸缩震动导致[17],也可能与样品中存在蛋白有关;1 639.62 cm-1和1 562.75 cm-1处存在的微弱吸收峰可能是C=O 和N-H 伸缩振动造成,这是由于样品中含有的少量蛋白所致[18];1 370.68 cm-1处的吸收峰可能是由来自于多糖或蛋白中的-CH3基团伸缩振动造成[19];在1 255.15 cm-1处出现的吸收峰归因于S=O 的震动,表明多糖中存在硫酸基,这些均与基本组成成分的分析结果一致[14];而在895.66 cm-1的吸收峰则表明样品中可能含有β-糖苷键。
2.4 体外抗氧化活性分析
CPS 清除DPPH、羟基及ABTS+自由基活性大小如图3(A-C)所示,可以看出CPS 及Vc 在0.25~4.0 mg·mL-1浓度范围内对各自由基的清除率呈现剂量效应关系。在浓度为0.25 mg·mL-1时,CPS 对DPPH、羟基及ABTS+自由基的清除率分别为57.62%、39.79%和47.82%;当浓度为4 mg·mL-1时,CPS 对各自由基的清除率分别可达80.61%、86.24%和97.41%,其中ABTS+自由基清除率最高,接近于同浓度Vc 的ABTS+自由基清除率(98.33%)。以上结果表明,发酵乳杆菌GBJ 的CPS 具有较高的自由基清除活性,能够有效地避免自由基对机体的氧化损伤。L.fermentum GBJ CPS 的DPPH 自由基活性略低于L.fermentum S1 的CPS,但高于L.plantarum YW32 的EPS,可能与其中性糖含量的高低有关[3,20]。良好的DPPH 自由基清除活性也说明L.fermentum GBJ 的CPS 可能是良好的氢或电子供体[21]。而较高的羟自由基清除活性,可能与其存在一定的硫酸基有关。此外,多糖的ABTS+自由基清除能力较高可能是其自由基由活性状态转化为稳定状态,并通过向自由基提供电子来终止自由基链式反应[22],蛋白质含量也是影响CPS 的ABTS+自由基清除活性的重要因素[23]。
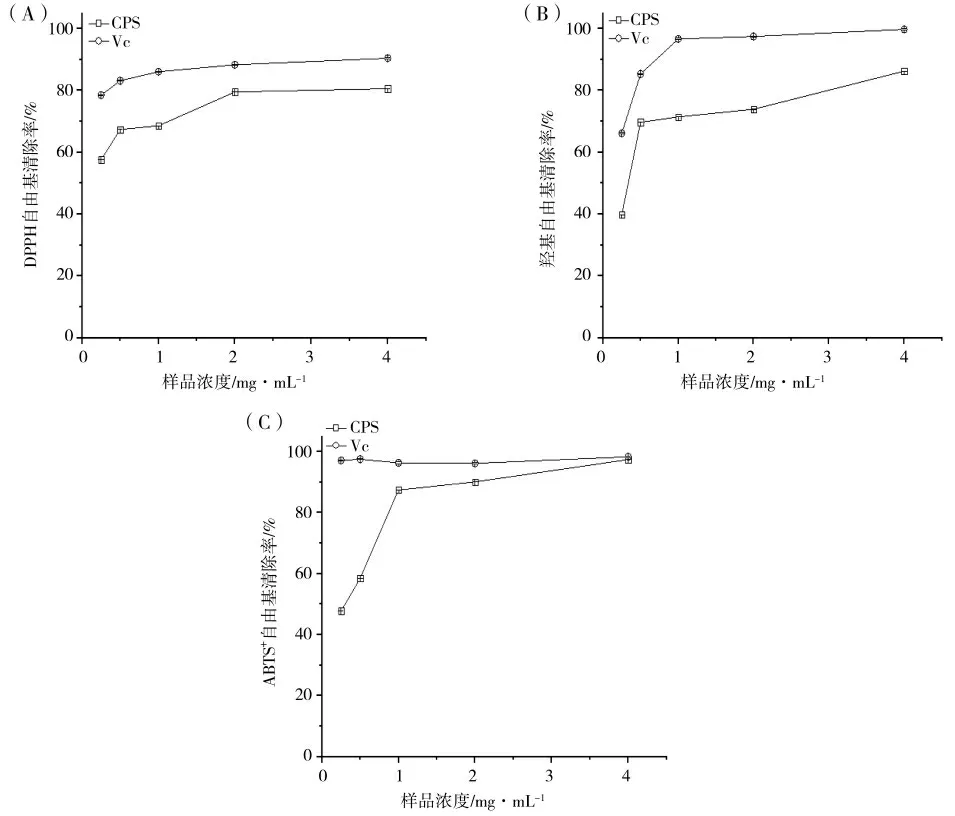
图3 CPS 清除DPPH A、羟基B 和ABTS+自由基的活性CFig.3 DPPH A,hydroxyl B and ABTS+free radical scavenging activities C of CPS
2.5 免疫调节活性
2.5.1 CPS 对细胞活力的影响
如图4(A)所示,与对照组相比,低浓度(31.25和62.5 μg·mL-1)的CPS 对RAW264.7 细胞活力无明显影响(P>0.05),125 和250 μg·mL-1的CPS 对细胞活力可产生显著的促进作用(P<0.05),并在250 μg·mL-1时细胞的存活率达到最大值124.25%,而随着浓度的进一步提升,这种促进作用发生明显下降(P<0.05),500 μg·mL-1CPS 处理RAW264.7 细胞的细胞活力与对照组相比已无明显差异(P>0.05),这可能是因为过高浓度CPS 开始对巨噬细胞产生一定的毒性作用,从而导致细胞活力促进作用下降,甚至产生抑制作用[24]。综合考虑细胞增殖效果及节约样品,研究选择31.25、62.5、125 和250 μg·mL-1这4 个浓度梯度评价CPS 对RAW264.7 细胞的免疫调节作用。
2.5.2 CPS 对细胞吞噬作用的影响
如图4(B)所示,与空白组相比,LPS 显著增强了RAW264.7 细胞对中性红的吞噬性能(P<0.05),经刺激后的吞噬率可达对照组的206.90%。CPS 对RAW264.7 细胞中性红吞噬性能的影响,随浓度的上升呈现先上升后下降的趋势,但均明显高于对照组(P<0.05),并在125 μg·mL-1时达到最高值,为对照组的168.97%。这一结果与You 等[7]和Tian 等[13]的研究结果相似,前者发现戊糖乳杆菌LZ-R-17 EPS 能显著改善巨噬细胞的吞噬能力,后者从蝉拟青霉TJJ1213 的菌丝体中获得的两个胞内多糖组分也具有激活RAW264.7 细胞吞噬活性的能力。上述结果表明,CPS 可以通过增强RAW264.7 细胞吞噬活性,达到提高机体免疫力的作用。
2.5.3 CPS 对细胞分泌细胞因子的影响
如图4(C-F)所示,与对照组相比,LPS 组RAW264.7 IL-1β、IL-6、IL-10 和TNF-α 分泌水平显著上升(P<0.05)。对于样品组,62.5 μg·mL-1的CPS可使小鼠巨噬细胞RAW264.7IL-1β 的分泌量提高近2 倍,125 和250 μg·mL-1的CPS 可分别显著提高RAW264.7 细胞IL-6 和IL-10 分泌水平(P<0.05),而CPS 对RAW264.7 细胞的TNF-α 分泌水平则无明显作用(P>0.05)。这些结果表明,适当浓度的CPS 可增强巨噬细胞IL-1β、IL-6 和IL-10 三种细胞因子的分泌水平,表明CPS 具有一定的免疫增强潜力。You等[7]研究表明,50~200 μg·mL-1范围内的戊糖乳杆菌LZ-R-17 EPS 可显著提高RAW264.7 细胞TNF-α、IL-1β 和IL-6 的含量,而在50~400 μg·mL-1范围内能显著提高IL-10 的含量。Tian 等[13]通过检测三种典型的细胞因子来揭示蝉拟青霉TJJ1213 胞内多糖IPS2对巨噬细胞的免疫调节活性,发现200 μg·mL-1的IPS2 可显著提高RAW264.7 细胞IL-6 及IL-1β 水平,同时IPS2 还可以通过剂量依赖的方式增强TNF-α 的分泌。不同来源多糖对巨噬细胞细胞因子分泌水平影响不同,这种差异可能与其单糖组成及分子量等因素有关[7]。
3 讨论
多糖是由重复的单糖通过糖苷键连接形成的聚合物,由于单糖组成和连接方式不同,导致CPS 结构解析存在巨大的挑战,而试验对CPS 基本结构的研究,为其今后在功能性食品的应用奠定了基础,同时对结构的深度解析也会成为未来研究的一个重点。近年来,科研人员根据CPS 的抗原性异同在研制多糖疫苗方面有了新的思考,但主要是针对细菌CPS进行研究,虽然目前对乳酸菌胞外多糖的结构及生理活性的研究已经取得了一定的成果,但对其具体提高机体抗肿瘤和免疫能力方面的研究还存在明显的不足[25]。刘雯雯等[26]在研究植物乳杆菌-12 的抗氧化试验中发现,DPPH 清除率与EPS 浓度呈依赖关系,当浓度为0.5 mg·mL-1时,DPPH 清除率能达到49.13%,而李伟欣等[27]研究了一种双歧杆菌代谢产生的EPS 在低剂量下能诱导小鼠脾淋巴细胞增殖,可以看出目前的研究多集中在EPS 对其抗氧化、免疫活性以及其他生理活性的研究中,对CPS 的研究较为浅显,这也客观地反映了今后研究的发展方向。
4 结论
研究对L.fermentum GBJ 的CPS 结构和生物活性进行了初步研究。发现CPS 不仅具有较强的DPPH、ABTS+以及羟基自由基的清除活性,还能通过提高RAW264.7 细胞的吞噬能力和免疫因子释放,进而发挥免疫调节作用。因此,L.fermentum GBJ CPS可以作为一种新型的功能性辅料应用于食品或药品领域。

