槲皮素通过抑制MIP-1α/CCR1/CCR5信号通路减轻大鼠带状疱疹后神经痛的机制
田佳玉 冯丹 胡焓 张书力 童胜雄 李少军
摘要:目的 探討槲皮素(Que)对大鼠带状疱疹后神经痛(PHN)及趋化因子配体3(CCL3,即MIP-1α)/C-C趋化因子受体(CCR)1/CCR5信号通路的影响。方法 将60只大鼠分为对照组(Con组)、PHN组、L-Que组(30 mg/kg)、M-Que组(60 mg/kg)、H-Que组(120 mg/kg)以及H-Que+MIP-1α组(120 mg/kg Que+0.4 mg/kg重组MIP-1α)。检测各组大鼠机械痛阈值(PWT)、热痛阈值(TWL);试剂盒检测外周组织液腺苷、腺嘌呤核糖核苷酸(AMP)、腺苷二磷酸(ADP)以及脊髓背角样本肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)水平;通过HE染色观察脊髓背角病理切片;免疫荧光染色检测脊髓背角小胶质细胞活化情况;Western blot检测MIP-1α/CCR1/CCR5信号通路蛋白表达。结果 PHN组脊髓背角组织出现破裂现象,神经束排列混乱,炎性细胞浸润、水肿,神经元轻微萎缩现象。与Con组相比,PHN组PWT值、腺苷、AMP、ADP水平降低(P<0.05),TWL值、TNF-α、IL-1β水平、Iba1阳性小胶质细胞数量以及MIP-1α、CCR1、CCR5蛋白水平均升高(P<0.05);Que治疗后,大鼠神经束排列杂乱现象有所改善,炎性细胞浸润减少,神经元萎缩现象减轻;与PHN组相比,L-Que组、M-Que组、H-Que组的PWT值、腺苷、AMP、ADP水平升高(P<0.05),TWL值、TNF-α、IL-1β水平、Iba1阳性小胶质细胞数量以及MIP-1α、CCR1、CCR5蛋白水平均降低(P<0.05),且Que作用效果呈剂量依赖性;与H-Que组相比,H-Que+MIP-1α组的PWT值、腺苷、AMP、ADP水平降低(P<0.05),TWL值、TNF-α、IL-1β水平、Iba1阳性小胶质细胞数量以及MIP-1α、CCR1、CCR5蛋白水平均升高(P<0.05)。结论 Que可能通过抑制MIP-1α/CCR1/CCR5信号通路减轻大鼠炎症反应,进而减轻PHN。
关键词:槲皮素;神经痛,带状疱疹后;趋化因子CCL3;受体,CCR1;受体,CCR5
中图分类号:R752.12文献标志码:ADOI:10.11958/20221587
Mechanism of quercetin alleviating postherpetic neuralgia in rats by inhibiting
MIP-1α/CCR1/CCR5 signaling pathway
TIAN Jiayu, FENG Dan△, HU Han, ZHANG Shuli, TONG Shengxiong, LI Shaojun
Department of Pain, Wuhan First Hospital, Wuhan 430000, China
△Corresponding Author E-mail: ht3bxv@163.com
Abstract: Objective To investigate the impact of quercetin (Que) on postherpetic neuralgia (PHN) and chemokine ligand 3 (CCL3, namely MIP-1α)/C-C chemokine receptor 1 (CCR1)/C-C chemokine receptor 5 (CCR5) signaling pathway in rats. Methods Sixty rats were divided into the control group (Con), the PHN group (model group), the L-Que (30 mg/kg) group, the M-Que (60 mg/kg) group, the H-Que (120 mg/kg) group and the H-Que+pathway activator MIP-1α (120 mg/kg Que+0.4 mg/kg recombinant MIP-1α) group. The mechanical paw withdrawal threshold (PWT) and thermal pain threshold (TWL) of rats were detected in each group. The kit was used to detect adenosine, Adenine ribonucleotide (AMP), adenosine diphosphate (ADP) and tumor necrosis factor in spinal dorsal horn samples- α (TNF-α), and interleukin-1 β (IL-1 β) levels in spinal dorsal horn samples. HE staining was applied to observe the pathological sections of spinal dorsal horn. Immunofluorescence staining was used to detect the activation of microglia in spinal dorsal horn. Western blot assay was applied to detect MIP-1α/CCR1/CCR5 signaling pathway protein expression. Results In the PHN group, the dorsal horn of the spinal cord was ruptured, the arrangement of nerve bundles was disordered, and inflammatory cell infiltration, edema, and slight atrophy of neurons appeared. Compared with the Con group, the PWT value, adenosine, AMP and ADP levels were obviously decreased in the PHN group (P<0.05), and TWL value, TNF-α, IL-1β levels, the number of Iba1-positive microglia, MIP-1α, CCR1 and CCR5 protein levels were obviously increased (P<0.05). After treatment with Que, the disordered arrangement of nerve bundles was improved, the infiltration of inflammatory cells was reduced, and the phenomenon of neuronal atrophy disappeared. Compared with the PHN group, the PWT value, adenosine, AMP and ADP levels were obviously increased in the L-Que group, the M-Que group and the H-Que group (P<0.05). TWL value, TNF-α and IL-1β levels, the number of Iba1-positive microglia, and MIP-1α, CCR1 and CCR5 protein levels were obviously decreased (P<0.05). The effect of Que was dose dependent. Compared with the H-Que group, PWT value, adenosine, AMP and ADP levels were obviously decreased in the H-Que+MIP-1α group (P<0.05), and TWL value, TNF-α, IL-1β levels, the number of Iba1 positive microglia, MIP-1α, CCR1 and CCR5 protein levels were obviously increased (P<0.05). Conclusion Que may reduce the inflammatory response in rats by inhibiting the MIP-1α/CCR1/CCR5 signaling pathway, thereby reducing PHN.
Key words: Quercetin; neuralgia, postherpetic; chemokine CCL3; receptors, CCR1;receptors, CCR5
带状疱疹后神经痛(postherpetic neuralgia,PHN)是一种神经性疼痛,通常发生在带状疱疹发病后的1~3个月,疼痛剧烈且难以治愈[1]。PHN严重影响患者的生活质量,增加患者焦虑、抑郁的风险;然而,关于PHN的机制目前尚不清楚[2]。临床使用阿片类、抗癫痫和抗抑郁药物治疗PHN及其并发症,但治疗效果并不理想,且可能会导致呼吸抑制、恶心呕吐,甚至成瘾等并发症[3-4]。因此,寻找高效且不良反应少的药物是临床急需解决的难题。槲皮素(Quercetin,Que)是一种天然类黄酮,通常用作膳食成分和补充剂,具有广泛的生物活性,包括抗氧化应激、抗炎、免疫调节、镇痛和舒张血管等[5-6]。基于以上药理活性,人们开始探寻Que对疾病的治疗效果。研究表明,Que可以减轻慢性缩窄性损伤(chronic constriction injury,CCI)大鼠的神經性疼痛[7],但其作用机制尚不明确。趋化因子配体3(CC-chemokine ligand 3,CCL3,即MIP-1α)是炎症性疼痛和痛觉过敏的调节因子,可通过激活C-C趋化因子受体(CC-chemokine receptor,CCR)1和CCR5来调节神经系统的炎症[8]。Li等[9]研究发现,抑制MIP-1α/CCR1/CCR5信号通路可以减轻神经性疼痛和神经炎症。笔者推测,Que可能通过抑制MIP-1α/CCR1/CCR5信号通路减轻PHN,本研究通过构建PHN大鼠模型对此进行探讨。
1 材料与方法
1.1 实验动物 60只雄性SPF级SD大鼠,体质量200~220 g,7周龄,购自杭州启真实验动物科技有限公司,动物生产许可证号:SCXK(浙)2022-0005。所有大鼠均在动物饲养房中饲养,温度(25±2)℃,湿度(50±5)%,自由饮水、进食,本实验全程遵循3R原则。
1.2 主要试剂与仪器 Que(上海金穗生物科技有限公司);树胶脂毒素(resiniferatoxin,RTX,上海延慕实业有限公司);肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、腺苷、腺嘌呤核糖核苷酸(AMP)以及腺苷二磷酸(ADP)检测试剂盒购自上海酶研生物科技有限公司;MIP-1α、CCR1、CCR5抗鼠抗体购自R&D Systems;重组大鼠MIP-1α蛋白以及Iba-1、GAPDH兔抗鼠抗体购自Abcam公司;HPR标记的山羊抗兔IgG二抗购自Cell Signaling Technology公司,用于免疫荧光染色和Western blot检测。凝胶成像系统购自杭州申花科技有限公司;包埋机购自上海信裕生物科技有限公司。冷/热盘痛觉测试仪购自上海玉研科学仪器有限公司。
1.3 研究方法
1.3.1 PHN模型构建及分组 造模前,检测每只大鼠的机械和热敏感性。通过随机数字表法抽取10只大鼠作为对照组(Con组)。将RTX与10%乙醇、80%生理盐水、10%Tween 80混合均匀配制成100 mg/L的RTX混合液,随后按照200 μg/kg腹腔注射造模;造模3 d后再次检测大鼠的机械和热敏感性,若与造模前相比,热痛阈值(TWL)显著升高,机械痛阈值(PWT)显著降低,则造模成功[10]。Con组注射等剂量10%乙醇、10%Tween 80的混合液。
将造模成功的50只大鼠按照随机数字表法分为PHN组、L-Que组、M-Que组、H-Que组以及H-Que+MIP-1α组。L-Que组、M-Que组、H-Que组分别灌胃30、60、120 mg/kg槲皮素[7],每日1次,连续灌胃21 d。H-Que+MIP-1α组在灌胃120 mg/kg Que的基础上,于最后7 d腹腔注射0.4 mg/kg的重组MIP-1α,每日1次。
1.3.2 机械刺激敏感性实验 将大鼠置于透明的亚克力箱子中,然后将箱子放在铁网上,将大鼠置于箱子30 min,适应环境,然后选用0.2~26 g压力值的vonfrey丝并按从小到大的强度顺序由下往上垂直刺激大鼠右后脚外侧边缘皮肤,当大鼠出现回缩后足、舔足以及甩腿等收缩反应时,记录此时的刺激强度,即为PWT。
1.3.3 热刺激敏感性实验 将大鼠置于透明的亚克力箱子中,箱子下面放冷/热盘痛觉测试仪。待大鼠适应环境后,将测试仪热强度调至45 ℃,并对准大鼠右后足底,当后足出现收缩现象,记录此时的强度值,即为TWL。
1.3.4 外周神经递质腺苷、AMP及ADP的检测 灌胃药物结束后,对各组大鼠右下肢消毒,将微透析线性探针插入胫骨前缘,连接微透析系统,在1 μL/min的流速下,灌流30 min,收集外周组织液(灌流液)按照试剂盒说明书检测腺苷、AMP及ADP水平。
1.3.5 脊髓背角样本采集 完成1.3.4检测后,麻醉大鼠并处死,取L3-L5脊髓背角标本,通过随机数字表法每组抽取5只大鼠的标本固定于4%多聚甲醛用于制作病理石蜡切片,剩余5只大鼠的标本置于-80 ℃冰箱用于酶联免疫吸附试验(ELISA)和Western blot实验。
1.3.6 HE染色观察脊髓背角病理切片 将固定后的L3-L5脊髓样本脱水后用石蜡包埋,切成5 μm左右的组织切片,脱蜡后用不同体积分数的乙醇复水,经HE染色后,再用梯度乙醇脱水,中性胶密封,置于显微镜下观察脊髓背角病理变化。
1.3.7 ELISA试剂盒检测炎性因子 取出保存在-80 ℃冰箱的脊髓样本,经研磨仪匀浆后,分离获得上清液,根据ELISA试剂盒说明书检测脊髓背角中炎性因子TNF-α、IL-1β水平。
1.3.8 免疫荧光法测定脊髓背角中小胶质细胞活化情况 取脊髓石蜡切片置于含有10%山羊血清和0.3% Trition X-100的PBS溶液2 h。随后加入一抗Iba-1,用PBS冲洗后加入HPR标记的IgG二抗,用DAPI染色后封片,置于显微镜下拍照观察阳性小胶质细胞数量。
1.3.9 Western blot检测MIP-1α/CCR1/CCR5信号通路相关蛋白表达 提取各组脊髓样本的总蛋白,使用电泳分离蛋白后转膜,加入一抗MIP-1α(1∶2 000)、CCR1(1∶1 000)、CCR5(1∶1 000)、GAPDH(1∶1 000),4 ℃过夜,加入HPR标记的IgG二抗,37 ℃下孵育1 h,加入ECL显影后,以GAPDH为内参基因,用凝胶成像系统观察目的蛋白条带相对表达量。
1.4 统计学方法 采用SPSS 25.0软件进行数据分析,计量资料均符合正态分布并以均数±标准差[([x] ±s)
]表示,多组间比较使用单因素方差分析(ANOVA),组间多重比较使用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
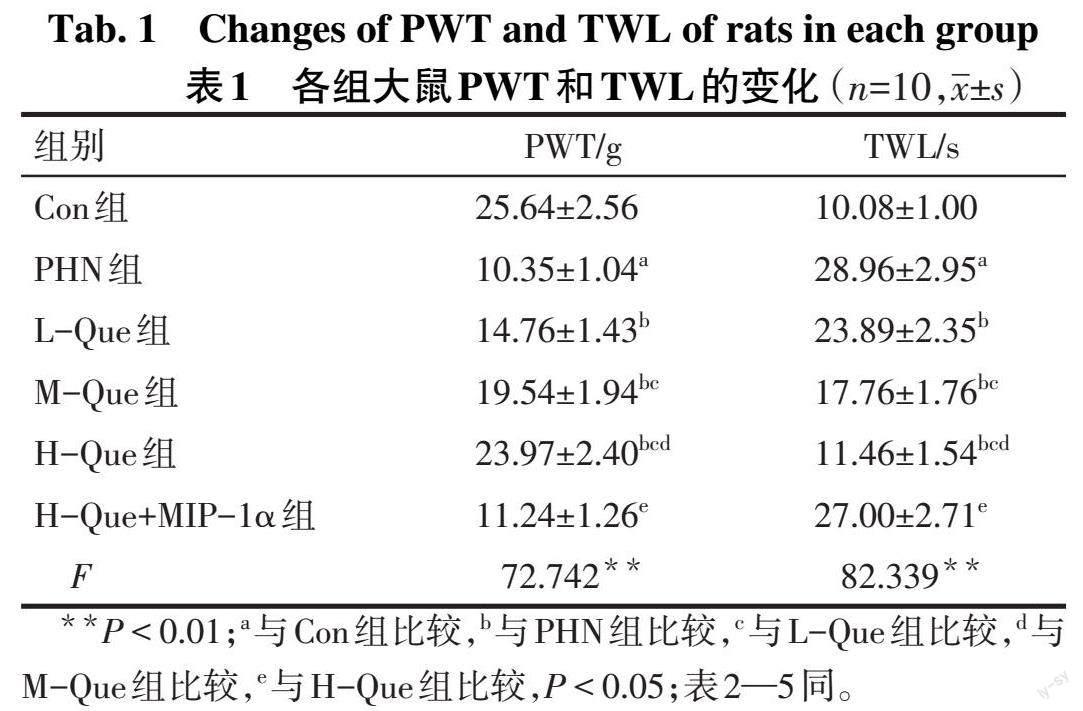
2.1 Que对各组大鼠機械刺激和热刺激敏感性的影响 与Con组相比,PHN组的PWT值减小,TWL值增加(P<0.05),与PHN组相比,L-Que组、M-Que组、H-Que组的PWT值依次增加,TWL值明显减小,且呈剂量依赖性(P<0.05);与H-Que组相比,H-Que+MIP-1α组的PWT值下降,TWL值上升(P<0.05),见表1。
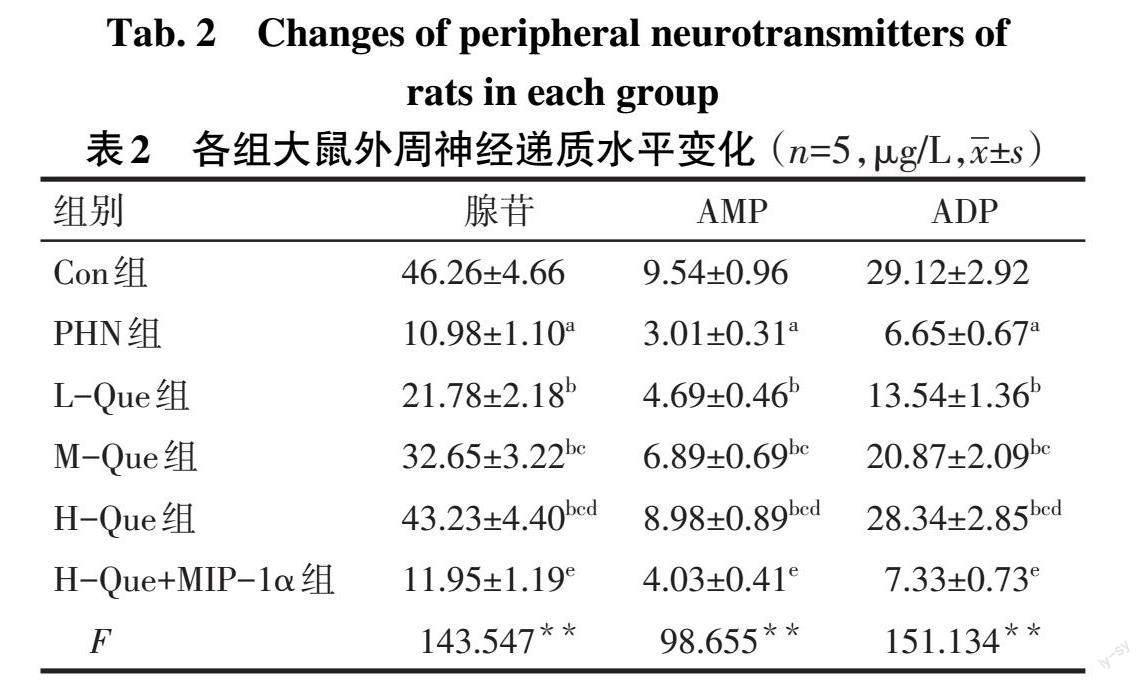
2.2 Que对各组大鼠外周神经递质的影响 与Con组相比,PHN组的腺苷、AMP及ADP水平降低(P<0.05);与PHN组相比,L-Que组、M-Que组、H-Que组的腺苷、AMP以及ADP水平依次增加(P<0.05);与H-Que组相比,H-Que+MIP-1α组的腺苷、AMP以及ADP水平下降(P<0.05),见表2。
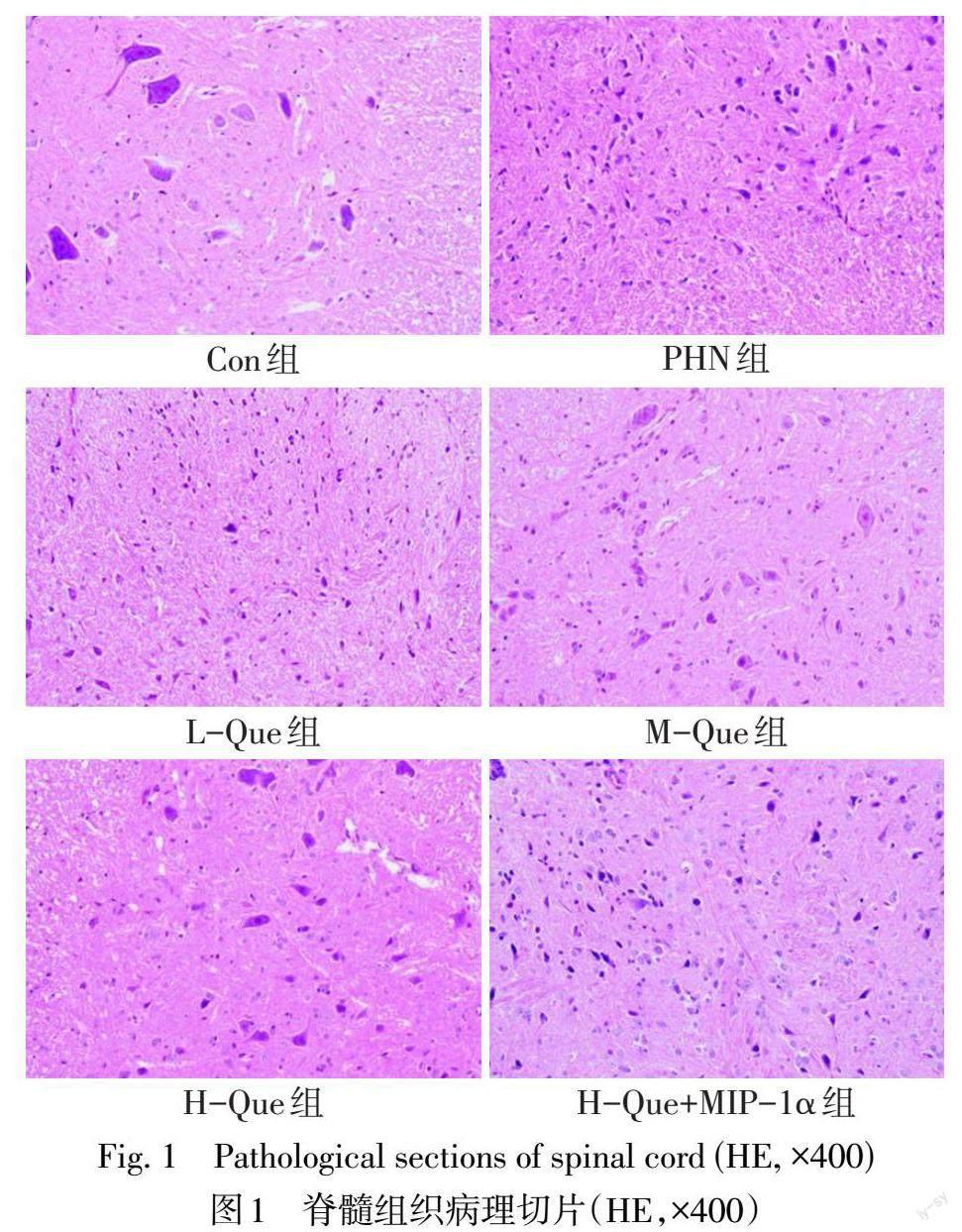
2.3 Que对各组大鼠神经病理性损伤的影响 HE染色结果显示,PHN组脊髓背角组织出现破裂现象,神经束排列混乱,炎性细胞浸润、水肿,神经元轻微萎缩等现象;Que治疗后,神经束排列逐渐规则,炎性细胞浸润有所减少,神经元萎缩现象有所减轻,且H-Que组效果最好;H-Que+MIP-1α组脊髓背角组织形态与PHN组相似,较Que组损伤加重,见图1。
2.4 Que对各组大鼠炎性因子水平和小胶质细胞活化的影响 与Con组相比,PHN组TNF-α及IL-1β水平上升(P<0.05);与PHN组相比,L-Que组、M-Que组、H-Que组TNF-α以及IL-1β水平呈依次下降趋势(P<0.05);与H-Que组相比,H-Que+MIP-1α组TNF-α和IL-1β水平上升(P<0.05),见表3。与Con组相比,PHN组Iba1阳性小胶质细胞数量明显增多(P<0.05);与PHN组相比,L-Que组、M-Que组、H-Que组Iba1阳性小胶质细胞数量明显减少,且呈剂量依赖性(P<0.05);与H-Que组相比,H-Que+MIP-1α组Iba1阳性小胶质细胞数量明显增多(P<0.05),见图2、表3。
2.5 Que对各组大鼠MIP-1α/CCR1/CCR5通路相关蛋白表达的影响 与Con组相比,PHN组MIP-1α、CCR1、CCR5蛋白水平均上调(P<0.05);与PHN组相比,L-Que组、M-Que组、H-Que组MIP-1α、CCR1、CCR5蛋白水平依次下调(P<0.05);与H-Que组相比,H-Que+MIP-1α组MIP-1α、CCR1、CCR5蛋白水平均上调(P<0.05),见图3、表4。
3 讨论
PHN的典型特征是机体出现持续性疼痛,热敏感性降低以及触觉异常[11]。外周组织液中的腺苷、AMP为“嘌呤能感受器”的重要组成部分,参与中枢以及外周神经系统痛觉信息的传导,调节神经性疼痛;当其水平降低时,提示机体痛阈降低[12]。本研究使用RTX构建大鼠PHN模型[13],结果发现,PHN组较Con组脊髓背角组织出现神经束排列混乱、炎性细胞浸润、水肿,神经元轻微萎缩等病理现象,且PWT值、腺苷、AMP、ADP水平明显减小,TWL值均明显升高,大鼠机械刺激敏感性增加,热刺激敏感性降低,与相关研究[10]一致,表明PHN模型构建成功。Que的镇痛作用已被大量研究证实,如Que可以减轻糖尿病神经性疼痛及慢性缩窄性损伤的神经性疼痛[14-16]。但关于Que对PHN治疗作用的机制尚不清楚。本研究发现,Que治疗后,神经束排列逐渐规则,炎性细胞浸润有所减少,神经元形态趋于正常,且PWT值、腺苷、AMP、ADP水平明显升高,TWL值明显降低,且呈剂量依赖性,提示Que可以改善机械和热刺激敏感性,减轻PHN。
脊髓炎症参与神经性疼痛的发生发展过程,其中神经胶质细胞激活是神经性疼痛的重要原因之一[17-19]。小胶质细胞数量增加以及细胞体增大是神经胶质细胞激活的主要特征[20-21]。活化的神经胶质细胞还会促进促炎细胞因子IL-1β和TNF-α的释放,诱发神经炎症,进而加重神经性疼痛[22]。本研究显示,PHN组较Con组TNF-α、IL-1β水平、Iba1阳性小胶质细胞数量均明显升高,而Que治疗后,TNF-α、IL-1β水平、Iba1阳性小胶质细胞数量均明显降低,提示Que可抑制PHN大鼠脊髓背角神经胶质细胞的活化及促炎因子的释放,进而缓解神经性疼痛。
MIP-1α是一种具有促炎特性的趋化蛋白。有研究报道,MIP-1α对介导炎症反应至关重要[23]。Wu等[8]研究表明,MIP-1α可以通过激活CCR1/CCR5信号通路诱导炎症反应。最近有研究发现,抑制MIP-1α/CCR1/CCR5信号通路可以缓解神经性疼痛和神经炎症[9]。本研究结果与其一致,PHN组MIP-1α、CCR1、CCR5蛋白水平明显升高,而Que治疗可明显降低MIP-1α、CCR1、CCR5蛋白水平,推测Que可能通过抑制MIP-1α/CCR1/CCR5信号通路减轻PHN。为了验证此猜想,本研究同时给予大鼠Que和重组MIP-1α,结果发现,H-Que+MIP-1α组较H-Que组的PWT值、腺苷、AMP、ADP水平明显降低,TWL值、TNF-α、IL-1β水平、Iba1阳性小胶质细胞数量以及MIP-1α、CCR1、CCR5蛋白水明显升高,提示重组MIP-1α消除了Que对PHN大鼠的保护作用。
综上所述,Que可能通过抑制MIP-1α/CCR1/CCR5信号通路,减轻PHN大鼠炎症反应,进而缓解PHN症状。Que是否还能作用于其他通路,需要进一步探究。
参考文献
[1] MAKHARITA M Y. Prevention of post-herpetic neuralgia from dream to reality:a ten-step model[J]. Pain Physician,2017,20(2):E209-E220.
[2] MEACHAM K,SHEPHERD A,MOPHAPATRA D P,et al. Neuropathic pain:central vs. peripheral mechanisms[J]. Curr Pain Headache Rep,2017,21(6):28-38. doi:10.1007/s11916-017-0629-5.
[3] KENNEDY P,GERSHON A A. Clinical features of varicella-zoster virus infection[J]. Viruses,2018,10(11):609. doi:10.3390/v10110609.
[4] TAN X,MA L,YUAN J,et al. Intravenous infusion of lidocaine enhances the efficacy of conventional treatment of postherpetic neuralgia[J]. J Pain Res,2019,12:2537-2545. doi:10.2147/JPR.S213128.
[5] CHEN J,LI G,SUN C,et al. Chemistry,pharmacokinetics,pharmacological activities,and toxicity of Quercitrin[J]. Phytother Res,2022,36(4):1545-1575. doi:10.1002/ptr.7397.
[6] CARULLO G,CAPPELLO A R,FRATTARUOLO L,et al. Quercetin and derivatives:useful tools in inflammation and pain management[J]. Future Med Chem,2017,9(1):79-93. doi:10.4155/fmc-2016-0186.
[7] YE G,LIN C,ZHANG Y,et al. Quercetin alleviates neuropathic pain in the rat CCI model by mediating AMPK/MAPK pathway[J]. J Pain Res,2021,14:1289-1301. doi:10.2147/JPR.S298727.
[8] WU X,JI K,WANG H,et al. MIP-1α induces inflammatory responses by upregulating chemokine receptor 1/chemokine receptor 5 and activating c-Jun N-terminal kinase and mitogen-activated protein kinase signaling pathways in acute pancreatitis[J]. J Cell Biochem,2019,120(3):2994-3000. doi:10.1002/jcb.27049.
[9] LI M,JIANG H,GU K,et al. Lidocaine alleviates neuropathic pain and neuroinflammation by inhibiting HMGB1 expression to mediate MIP-1α/CCR1 pathway[J]. J Neuroimmune Pharmacol,2021,16(2):318-333. doi: 10.1007/s11481-020-09913-y.
[10] 常成,宋燕. 甘草酸銨对带状疱疹后遗神经痛大鼠GLP-1R/IL-10/β-内啡肽通路及脊髓背角小胶质细胞活化的影响[J]. 免疫学杂志,2022,38(1):81-87. CHANG C,SONG Y. Effect of ammonium glycyrrhizinate on GLP-1R/IL-10/β-endorphin pathway and microglia activation in spinal dorsal dorn of rats posherpetic neuralgla[J]. Immunal J,2022,38(1):81-87. doi:10.13431/j.cnki.immunol.j.20220012.
[11] JI C,XU Y,HAN F,et al. Quercetin alleviates thermal and cold hyperalgesia in a rat neuropathic pain model by inhibiting Toll-like receptor signaling[J]. Biomed Pharmacother,2017,94:652-658. doi:10.1016/j.biopha.2017.07.145.
[12] FERRARI L F,ARALDI D,LEVINE J D. Regulation of expression of hyperalgesic priming by estrogen receptor α in the rat[J]. J Pain,2017,18(5):574-582. doi:10.1016/j.jpain.2016.12.017.
[13] WEI X,WANG L,HUA J,et al. Inhibiting BDNF/TrkB.T1 receptor improves resiniferatoxin-induced postherpetic neuralgia through decreasing ASIC3 signaling in dorsal root ganglia[J]. J Neuroinflammation,2021,18(1):96. doi:10.1186/s12974-021-02148-5.
[14] YANG R,LI L,YUAN H,et al. Quercetin relieved diabetic neuropathic pain by inhibiting upregulated P2X4 receptor in dorsal root ganglia[J]. J Cell Physiol,2019,234(3):2756-2764. doi:10.1002/jcp.27091.
[15] WANG R,QIU Z,WANG G,et al. Quercetin attenuates diabetic neuropathic pain by inhibiting mTOR/p70S6K pathway-mediated changes of synaptic morphology and synaptic protein levels in spinal dorsal horn of db/db mice[J]. Eur J Pharmacol,2020,882:173266. doi:10.1016/j.ejphar.2020.173266.
[16] ESPINOSA-JU?REZ J V,JARAMILLO-MORALES O A,D?CIGA-CAMPOS M,et al. Sigma-1 receptor antagonist (BD-1063) potentiates the antinociceptive effect of quercetin in neuropathic pain induced by chronic constriction injury[J]. Drug Dev Res,2021,82(2):267-277. doi:10.1002/ddr.21750.
[17] CHEN Z,DOYLE T M,LUONGO L,et al. Sphingosine-1-phosphate receptor 1 activation in astrocytes contributes to neuropathic pain[J]. Proc Natl Acad Sci U S A,2019,116(21):10557-10562. doi:10.1073/pnas.1820466116.
[18] ECHEVERRY S,SHI X Q,YANG M,et al. Spinal microglia are required for long-term maintenance of neuropathic pain[J]. Pain,2017,158(9):1792-1801. doi:10.1097/j.pain.0000000000000982.
[19] WANG M,PAN W,XU Y,et al. Microglia-mediated neuroinflammation:a potential target for the treatment of cardiovascular diseases[J]. J Inflamm Res,2022,15:3083-3094. doi:10.2147/JIR.S350109.
[20] DAVIS B M,SALINAS-NAVARRO M,CORDEIRO M F,et al. Characterizing microglia activation:a spatial statistics approach to maximize information extraction[J]. Sci Rep,2017,7(1):1576. doi: 10.1038/s41598-017-01747-8.
[21] WANG J,TU J,CAO B,et al. Astrocytic l-lactate signaling facilitates amygdala-anterior cingulate cortex synchrony and decision making in rats[J]. Cell Rep,2017,21(9):2407-2418. doi:10.1016/j.celrep.2017.11.012.
[22] YANG Q Q,ZHOU J W. Neuroinflammation in the central nervous system: symphony of glial cells[J]. Glia,2019,67(6):1017-1035. doi: 10.1002/glia.23571.
[23] PELISCH N,ROSAS ALMANZA J,STEHLIK K E,et al. CCL3 contributes to secondary damage after spinal cord injury[J]. J Neuroinflammation,2020,17(1):362. doi:10.1186/s12974-020-02037-3.
(2023-09-27收稿 2023-12-06修回)
(本文編辑 李国琪)

