拟南芥TRX-h5基因的克隆和表达分析
穆秀杰, 张林林, 韩 毅
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
干旱、重金属、紫外线等不利因素会影响植物自身的生长、发育。为了适应环境,植物演化出一套完整的氧化还原调节系统来维持体内内环境氧化还原的平衡。植物受到外界刺激时,会在体内产生大量的活性氧(reactive oxide species,ROS)分子,如过氧化氢、羟基自由基以及超氧阴离子等[1]。高水平的ROS对植物有毒害作用,ROS的清除分为酶促系统和非酶促系统2种,得以维持细胞内氧化还原水平的稳态[2-4]。酶促系统包括超氧化物歧化酶、过氧化氢酶等;维生素C、还原型谷胱甘肽、类黄酮等[5]构成非酶促系统。近期研究表明,ROS还可以作为信号分子[6],参与病原体防御、调节气孔关闭及生长发育等过程。ROS产生后,其自身作为信号分子激发磷酸化级联反应、钙信号及激素介导的信号通路,以此做出防御。因此,生物体内的ROS在一个合适的水平才得以维持细胞内生理生化反应的正常进行。
拟南芥硫氧还蛋白(TRX-h)是一个由19个基因编码的小分子蛋白,基因定位于细胞质、叶绿体、线粒体等,内质网和细胞核中也存在TRX-h蛋白[7],但功能尚不清楚。TRX-h基因家族成员的表达水平及表达模式各不相同,表明各自具有特异的功能[8]。拟南芥TRX-h1至TRX-h5 mRNA 在地上器官(如幼叶、成熟叶、长角果、花芽、花)中丰度高,而茎中丰度低些。TRX-h2、TRX-h4和TRX-h5在根中表达量很低,TRX-h1和TRX-h3 mRNA在根中根本检测不到。通常情况下,TRX-h蛋白以还原形式存在,并且具有清除ROS的功能[9-10]。有研究显示,棉花硫氧还蛋白参与花期调控[11],在黄萎病菌入侵后,棉花体内硫氧还蛋白丰度提高,这表明硫氧还蛋白参与了这一防御过程。此外,在烟草中过表达γ-谷氨酰半胱氨酸合成酶,体内TRX-h基因的转录水平显著增强,进而增强了对丁香假胞菌的耐受性[12]。
本研究从野生型拟南芥(Arabidopsisthaliana)Columbia(Col-0)中克隆了TRX-h5基因,并对其进行生物信息学分析,为探索该基因的蛋白功能提供了理论依据。同时将TRX-h5基因的第39位和第42位半胱氨酸位点突变(TRX-h5M),探究该位点对TRX-h5蛋白活性的影响,为研究TRXs蛋白参与调控的ROS信号通路提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验材料
野生型拟南芥植株Col-0、EYFP-TRX-h5-C39S-C42S(TRX-h5M)重组载体、表达载体pET28a(+)、大肠杆菌DH5α克隆菌株、大肠杆菌BL21表达菌株均由本实验室保存。
1.1.2 实验试剂与仪器
反转录酶、dNTP聚合物、高保真酶、限制性内切酶(XhoⅠ、NdeⅠ、BamHⅠ、HindⅢ)、T4DNA连接酶、咪唑(C3H4N2)、His标签镍柱、质粒提取试剂盒、切胶纯化试剂盒、琼脂粉、酵母提取物、胰蛋白胨、氯化钠、卡纳霉素(工作质量浓度为50 μg/mL)。
本实验所用主要仪器有聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像仪分析系统、电泳仪、高温高压灭菌锅、恒温培养箱、超净工作台、摇床、超声波细胞破碎仪、真空泵、超低温离心机、恒温培养震荡器,紫外分光光度计、冷柜等。
1.2 方法
1.2.1 生物信息学分析
用ExPASy-ProtParam工具(https://web.expasy.org/protparam/)在线软件对TRX-h5基因编码的氨基酸进行基本理化性质的分析;采用ProtScale在线工具(https://web.expasy.org/protscale/)对TRX-h5蛋白进行亲/疏水性分析;采用PSORT Prediction(http://psort1.hgc.jp/form.html)在线软件分析TRX-h5蛋白的亚细胞定位;采用 NetPhos3.1Server(http://www.cbs.dtu.dk/services/NetPhos/)在线软件对TRX-h5蛋白进行磷酸化位点分析;利用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库BLUST工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析TRX-h5蛋白的保守功能结构域;采用 NPS@: SOPMA secondary structure prediction 和SWISS-MODEL预测TRX-h5蛋白的二级结构和三级结构。
1.2.2 引物设计与合成
首先从tair网站获取TRX-h5基因的编码序列(coding sequence,CDS),再使用Primer5.0设计引物。上游引物(NdeⅠ-FP):5’-GGAATTCCATATGATGGCCGGTGAAGGAGAAG-3’(下划线部分为NdeⅠ酶切位点);下游引物XhoⅠ-RP:5’-CCGCTCGAGTCAAGCAGAAGCTACA AGACCACC-3’(下划线部分为XhoⅠ酶切位点)。
以EYFP-TRX-h5M重组载体为模板的上游引物(BamHⅠ-FP)为:AAAAGGATCCATG GCCGGTGAAGGAGAAG;下游引物(HindⅢ-RP)为:AAAAAAGCTTTCAAGCAGAAGCTA CAAGACCAC。
1.2.3 总RNA的提取和反转录
采用Trizol法提取RNA,利用反转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)获得cDNA,反应体系为:2 μL的 5×PrimeScriptRT Mix,2 μg的 Total RNA,RNase Free ddH2O补齐至10 μL。反应条件为:25 ℃,10 min;42 ℃,30 min;85 ℃,5 min;4 ℃,3 min。
1.2.4TRX-h5基因的扩增和纯化
以拟南芥cDNA为模板,扩增TRX-h5基因的CDS序列;以EYFP-TRX-h5M重组载体为模板扩增TRX-h5第39位和第42位点突变(C突变为S)的序列。PCR(5 μL)反应体系为:5.0 μL的10×buffer,4.0 μL 的dNTP,2.0 μL的FP,2.0 μL的RP,0.6 μL的高保真酶,2.0 μL的Template DNA,34.4 μL的ddH2O。PCR反应条件为:94 ℃预变性5 min;然后进行30个PCR循环(94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min);72 ℃延伸10 min。PCR程序结束后,琼脂糖凝胶电泳验证条带大小是否正确,通过切胶纯化的方式回收目的基因。
1.2.5 重组载体的构建和转化
将TRX-h5的胶回收产物和PET28a(+)质粒使用XhoⅠ/NdeⅠ双酶切;TRX-h5M胶回收和PET28a(+)使用BamHⅠ/HindⅢ双酶切。酶切后胶回收目的基因及线性化载体。连接反应16 ℃过夜。连接体系为:5×buffer和基因片段各2 μL,T4 DNA连接酶和ddH2O各1 μL,pET28a(+)线性化载体4 μL。
将连接后的产物转化大肠杆菌 DH5α感受态细胞,用卡纳霉素琼脂平板筛选阳性克隆过夜培养。挑选阳性克隆进行PCR和双酶切鉴定,鉴定为阳性的重组质粒,送至生工生物工程股份有限公司进行测序,测序正确后,将重组载体命名为pET28a(+)TRX-h5、pET28a(+)TRX-h5M,将重组载体转化BL21感受态细胞。
1.2.6 目的蛋白的诱导表达及纯化
将转化大肠杆菌 BL21的阳性单菌落先小摇后大摇,在220 r/min、37 ℃的条件下摇至A600为0.6,加入诱导剂IPTG(终浓度0.2 mmol/L),22 ℃的条件下诱导16~24 h。
诱导后的菌液4 ℃,6 000 r/min离心20 min去上清。沉淀用solution1(0.3 mol/L NaCl,20 mmol/L Tris-HCl,pH值7.6)按照每升诱导液加入30 mL的比例重悬,破细胞30 min,再用高速离心机4 ℃,12 000 r/min离心30 min取上清置冰上备用。
分别用solution1、solution2(20 mmol/LTris-HCl,0.3 mol/L NaCl,50 mmol/L咪唑,pH值7.6)洗脱杂蛋白,然后用solution3(20 mmol/L Tris-HCl,0.3 mol/L NaCl,0.3 mol/L咪唑,pH值7.6)洗脱目的蛋白。并利用透析袋除去咪唑,将蛋白保存在-80 ℃备用。
1.2.7 目的蛋白质量浓度和酶活的检测
以牛血清蛋白为标准蛋白制作标准曲线,将目的蛋白稀释合适的倍数后使用紫外分光光度计在595 nm波长下测吸光度值,计算蛋白质量浓度。TRX-h酶活测定反应体系包含100 mmol/L磷酸钾缓冲液(pH 值7.0)、2 mmol/L EDTA和130 μmol/L牛胰岛素(含或不含2 μmol/LTRX-h5)。通过添加0.33 mmol/L DTT启动酶促反应。在650 nm处监测TRX-h5引起的浊度。
2 结果与分析
2.1 TRX-h5基因的基本理化性质分析
TRX-h5基因编码一条含118个氨基酸的肽链,分子式为C594H933N149O169S8,相对分子质量为13 122.32,理论等电点为5.19,脂溶性指数为89.24。该蛋白的不稳定参数为26.74,属于稳定性蛋白(小于40为稳定蛋白)。在氨基酸残基的组成上,丙氨酸(Ala)和缬氨酸(Val)数目最多,各占11.9%。
使用NCBI Concserved Domain软件对TRX-h5蛋白进行保守结构域分析,结果如图1a所示。由图1a可知,该蛋白属于TRX家族。采用ExPASy-ProtScale对亲疏水性进行分析,结果如图1b所示。由图1b可知,TRX-h5蛋白为亲水性蛋白。对TRX-h5蛋白进行磷酸化位点预测分析,结果如图1c所示。由图1c可知,该蛋白含有3个磷酸化位点,分别是2个丝氨酸(Ser)、1个苏氨酸(Thr)。
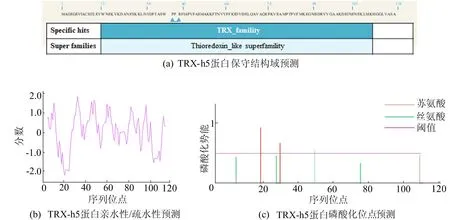
图1 TRX-h5蛋白一级结构理化性质分析
2.2 二级结构和三级结构预测
TRX-h5蛋白的二级结构运用SOPMA在线软件进行分析,如图2a所示。
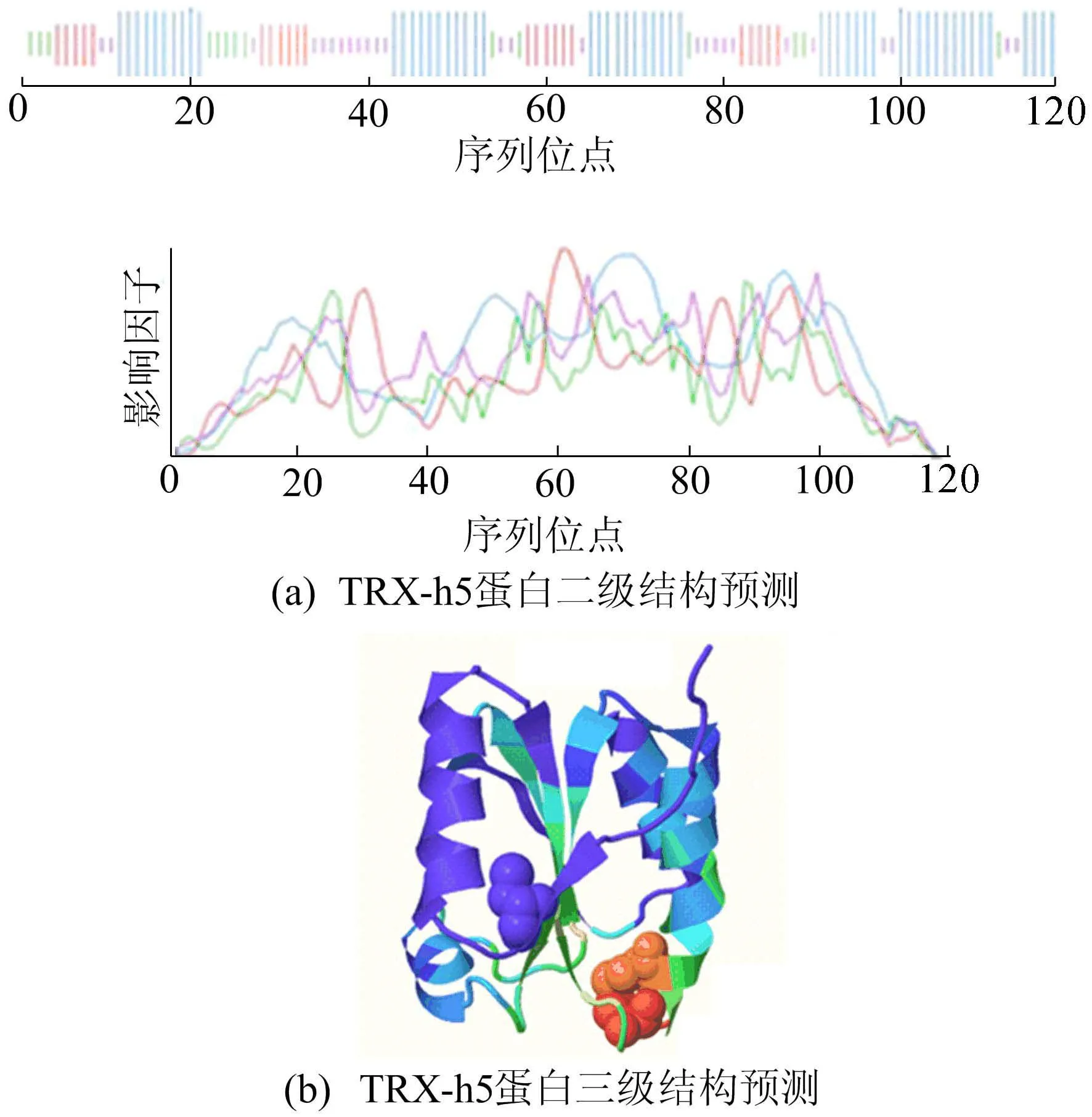
图2 TRX-h5蛋白结构分析
从图2a可以看出,该蛋白的二级结构包括α-螺旋(45.76%)、无规则卷曲(22.88%)、伸展链(19.49%)和β折叠(11.86%),α-螺旋和无规则卷曲为该蛋白二级结构的主要元件。
运用 SWISS-MODEL建模软件对TRX-h5蛋白三级结构预测分析,模型是以同源建模的方式模拟,是在二级结构基础上盘绕、折叠产生的特定空间结构,如图2b所示。
2.3 TRX-h5的PCR扩增
以拟南芥野生型CDS为模板,以TRX-h5-F和TRX-h5为引物进行扩增,核酸琼脂糖电泳检测结果如图3所示,扩增产物有一条特异性条带,与拟南芥TRX-h5基因的大小相符(TRX-h5大小为357 bp)。
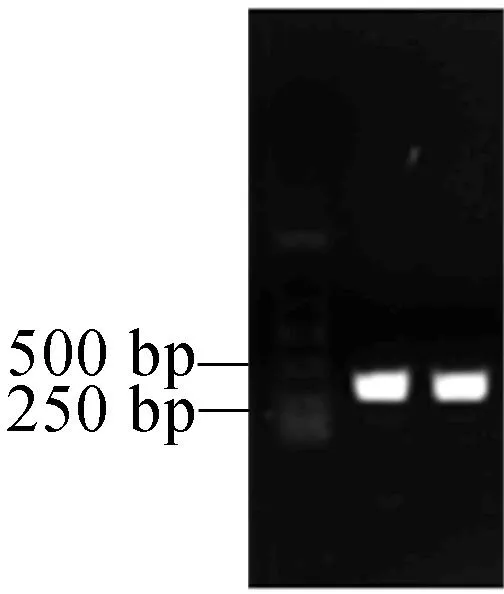
图3 PCR扩增TRX-h5基因片段琼脂糖电泳图
2.4 PET28a(+)-TRX-h5载体的构建
提取阳性菌落质粒进行测序,结果显示质粒中连接的目的基因与TRX-h5基因片段完全相符,未发生任何突变,将送去测序的菌落进行扩摇,提取质粒并转入表达菌株BL21,挑取单克隆进行菌落鉴定。
本文利用Primer 5软件在PET28a(+)载体上设计引物pET28a(+)-F(TAGTTATTGCTCAGCGGTGG)和pET28a(+)-R(TCATGAGCGCTTGTTTCGGC),利用PCR扩增,确认TRX-h5基因片段与载体是否成功连接。条带在250~500 bp中间的位置,与实际大小357 bp相符,选取含目的基因的单克隆作为诱导菌种,如图4所示。
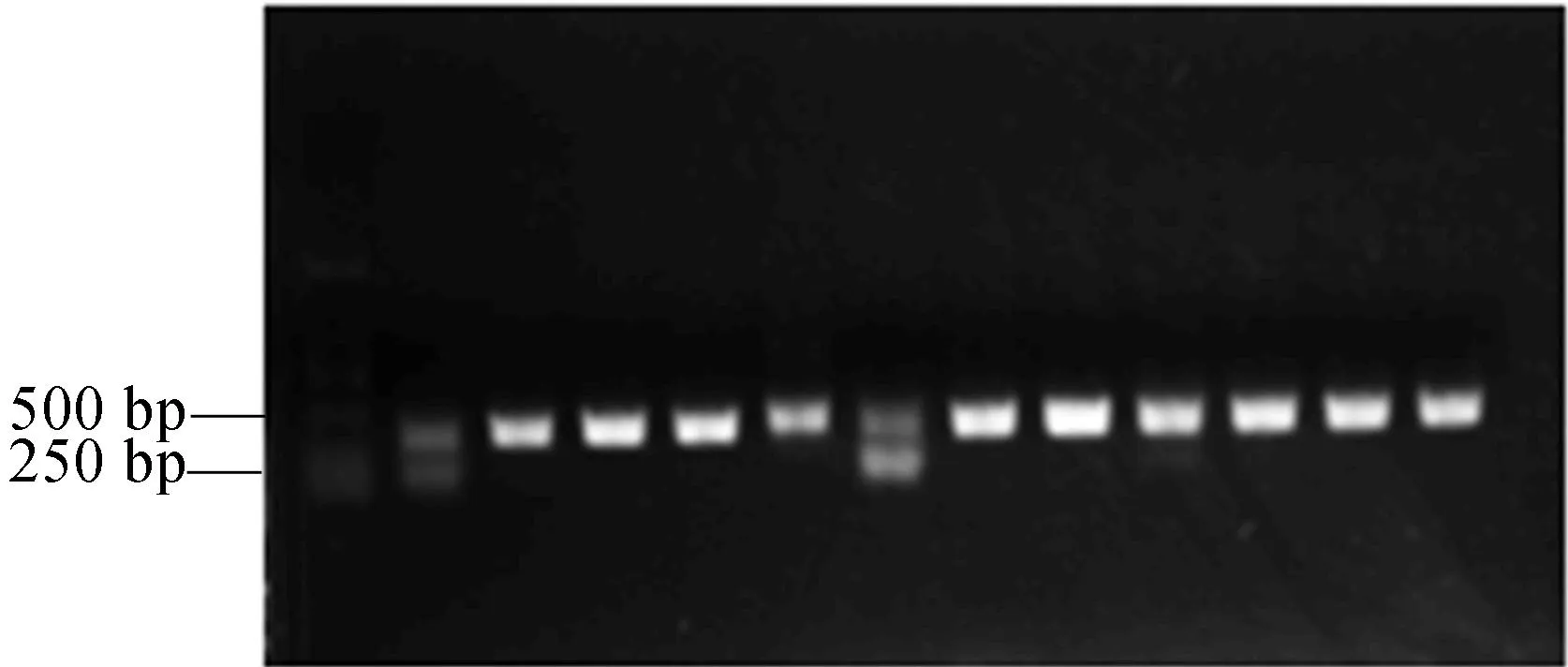
图4 菌落pET28a(+)-TRX-h5/BL21 PCR电泳图
2.5 TRX-h5蛋白的诱导及纯化
在22 ℃条件下,终浓度为0.2 mmol/L的IPTG诱导12~16 h,SDS-PAGE电泳检测诱导的蛋白表达情况。诱导表达后的BL21菌体通过超声波细胞破碎仪得到表达后的蛋白,经镍柱后,带有His标签的TRX-h5蛋白和TRX-h5M蛋白得以纯化,如图5所示。
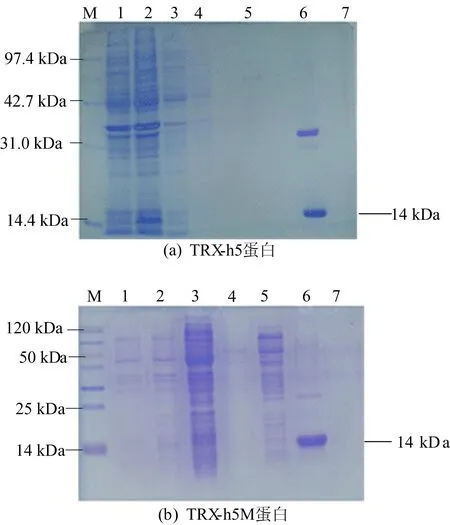
图5 蛋白SDS-PAGE电泳图
图5中:M代表Marker;泳道1代表诱导前蛋白表达情况;泳道2代表诱导后蛋白表达情况;泳道3代表样品洗脱液;泳道4和泳道5代表杂蛋白的洗脱;泳道6和泳道7代表目的蛋白的洗脱。
由图5可知,在接近14 kDa(TRX-h5分子量为13.1 kDa,6个组氨酸分子量为0.9 kDa)处出现单一的条带,符合TRX-h5蛋白分子量大小。
2.6 TRX-h5蛋白的质量浓度及酶活检测结果
以牛血清蛋白为标准蛋白制作标准曲线,如图6所示。
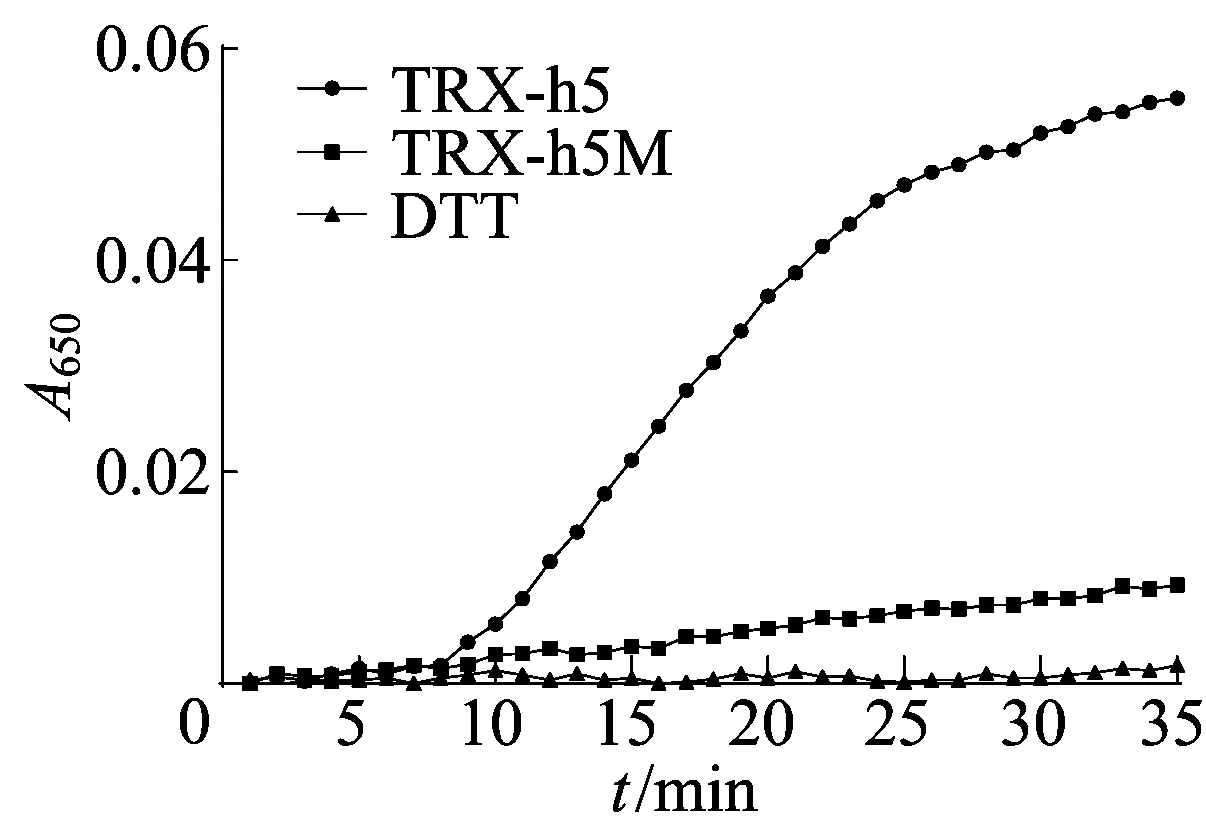
图6 TRX-h5、TRX-h5M蛋白的酶活测定
根据此标准曲线算出表达的TRX-h5蛋白质量浓度为0.4 μg/μL;TRX-h5M蛋白质量浓度为0.5 μg/μL。TRX-h5蛋白的2个半胱氨酸位点突变后,酶活力显著降低。
3 讨 论
在生长发育过程中,胁迫因子会使植物体内氧化还原状态失去平衡,造成氧化胁迫。植物会演化出多种调节途径和调节方式来对体内氧化还原状态进行调节,以避免氧化性伤害的产生,其中主要的调节方式包括:活性氧的酶促清除和非酶促清除;与谷胱甘肽相关的氧化还原调节等方式。
拟南芥硫氧还蛋白是由118个氨基酸组成的小分子蛋白。对TRX-h5蛋白进行磷酸化位点预测分析,结果表明该蛋白含有3个磷酸化位点,分别是2个丝氨酸(Ser)、1个苏氨酸(Thr)。TRX-h5是否参与了拟南芥氧化平衡的调节,这些磷酸化位点是否为TRX-h5蛋白的修饰位点,需要进一步探究。TRX-h5蛋白属于稳定性蛋白,其二级结构元件包括α-螺旋(45.76%)、无规则卷曲(22.88%)、伸展链(19.49%)和β折叠(11.86%),α-螺旋和无规则卷曲为该蛋白二级结构的主要元件。
运用 SWISS-MODEL建模软件对TRX-h5蛋白三级结构预测分析,该蛋白有3个半胱氨酸位点,其中第39位和第42位半胱氨酸裸露在蛋白质表面,将这2个半胱氨酸位点突变后,运用原核表达系统体外表达TRX-h5M蛋白和TRX-h5,并测定2个蛋白的酶活力,分析发现TRX-h5的第39位和第42位半胱氨酸位点决定了该蛋白的催化活性。这意味着第39位和第42位这2个位点的半胱氨酸可能是调节拟南芥TRX-h5蛋白活力的关键位点。
植物在受到氧化胁迫后,信号分子引发防御信号,硫氧还蛋白作为参与调节氧化还原平衡的关键蛋白,其第39位和第42位半胱氨酸可能是信号分子的作用位点,从而促发下游防御信号。这种调节方式需要进一步证明。
本文对TRX-h5蛋白进行结构上的预测,对研究其功能提供了理论依据。同时建立了体外表达TRX-h5的方法,探究了其第39位和第42位半胱氨酸对TRX-h5酶活力的影响。为TRX-h5的功能调节机制及植物氧化还原系统的研究提供了新思路。

