真实情境实现宏-微-符三重表征的实践探索
崔红 叶桂足 邹标

摘 要:文章以身边的水环境为真实素材,通过身边的水样测定、水样变化的探究、辨“水”新技能、数据再分析等真實情境,建构分析模型,以“电解质的电离”为例培养建立学生的宏观-微观-符号三重表征的化学观念,使学生建立静态宏观到动态微观的认识桥梁。
关键词: 溶液;电导率;电解质的电离
《普通高中化学课程标准(2017年版2020年修订)》强调了获取化学知识的方法和过程的重要性。要求培养未来生活中能有效地解决复杂问题和适应不同情境的人[ 1 ]。学生化学学科核心素养只能在化学问题解决和学习中形成和发展。通过真实而复杂的情境抽离问题、开展体验、引发思考和探究活动。逐步形成化学特征的思维方式,最终获得问题的解决方案和结果。本文以鲁科版(2019)必修一“电解质的电离”一节为例,探析真实情境下,建立模型实现对溶液体系宏观-微观-符号的三重表征,使化学学科核心素养落地生根。
1 问题的提出、
1.1 情境的内涵与价值
化学学科的广泛应用决定了化学问题具有真实的情境。真实而有意义的真实情境,能够激发学生的学习兴趣,为学生提供学习和发展的内驱力[ 1 ]。
化学问题的解决具有过程性,以系列活动引导学生建构新的认知,实施体验性学习,通过探究活动、观察评析、思维碰撞、寻找证据、建立模型,让学生领悟和感受学习的过程。真实情境化学问题的解决能有效培养学生的批判性思维和创新思维。
1.2 教学中亟待解决的问题及成因
化学反应发生的重要场所即在溶液体系中,了解物质在溶液中的行为是后续学习多种微粒相互作用的基础。后续学生学习问题的反馈体现了本部分教学没有落实的问题。比如:学生在处理溶液中的化学反应过程中,仍分不清哪些以化学式形式表示,哪些以离子符号形式表示;再如,当学生进入选择性必修阶段学习时,对书写酸碱性不同电解质溶液的电解方程式常常出现H+和OH-同时出现在同一个电极反应式中,而且不理解为何氯气要用排饱和食盐水法收集。种种问题体现的是学生对电离过程认识的薄弱,随着学习的深入,溶液的认识视角由宏观静态到微观动态,而学生认识的发展停滞在了宏观的认识。以往的教学常常脱离目标导向,未放开视野,围绕在基础概念的教学:电解质、非电解质、导电的问题上,并没有为后续的学习奠定多元的视角,导致学生逻辑混乱,不能形成有序的系统化的分析思维,找不到解决问题的关键。初中阶段学生对溶液的宏观认识即为分析溶液中的溶剂和溶质,而高中阶段要实现学生对溶液的微观认识,即分析溶液中的微粒。电解质的电离这节课是实现学生由宏观认识到微观认识的重要载体,电离过程的认识应作为学生发展的重要内容,电离内容的落实决定了学生在后续溶液中微粒行为的学习的质量。
2 真实情境下,建立模型实现宏-微-符三重表征的教学设计
2.1 教学设计理念及流程
“电解质的电离”选自鲁科版(2019年)必修第一册第2章第2节“电解质的电离 离子反应”,是本节内容的第1课时。作为“元素与物质世界”一章的新授课内容,“电解质”及“电离”概念是后续学习元素化学、化学反应原理以及理解溶液中离子行为及其变化的重要基础。但同时,由于对基于历史原因形成的概念名称的望文生义以及教学中对“导电性”这一宏观特征的关注,使得学生头脑中产生了较多关于电解质及电离的迷思概念。2017年版课标强调“结合理论模型发展中的重要事实和科学家的推理论证过程,引导学生认识化学理论的建立过程和思想方法”。本节教学内容中,电离、电解质、强弱电解质的概念从身边的水环境入手,剔除学生头脑中的迷思概念,在真实情境下促进学生的概念转变与理解;同时,通过实验培养学生的发现问题、解决问题的科学探究能力,也蕴含着培育学生化学学科核心素养的重要价值。但部分教师在教学设计中常常采用与教材编排顺序一致的教学内容,对教学内容蕴含的素养价值挖掘不够,导致学生印象不深,未能充分发挥本节内容独特的核心素养培养价值。本研究结合真实情境,多元活动的教学设计,能够体现出对学生学科核心素养发展的独特价值。本节教学设计流程如图1所示。
2.2 教学与评价目标
2.2.1 教学目标
(1)知识目标
{1}掌握电离、电解质和非电解质的概念;
{2}能辨别电解质、非电解质、导电以及强弱电解质。
(2)能力目标
{1}会用符号表征强弱电解质的电离过程;
{2}通过微观示意图的绘制表达电解质电离过程。
(3)素养目标
{1}从宏观测量数据的感知中,理解微观粒子的存在形式;
{2}通过电解质宏观现象变化,结合微观的演示过程,实现宏观-微观-符号的三重联系。
2.2.2 评价目标
(1)利用电解质微观变化演示过程,诊断并发展学生宏观辨识与微观探析的能力素养。
(2)通过对电解质与非电解质的区分及酸、碱、盐本质的归纳,诊断并发展学生的概念理解水平及模型认知水平。
(3)通过微观过程演示转化为符号表达,诊断学生的微观过程与符号表示的关联能力。
2.3 教学环节设计
【任务1】 建立宏微联系。
【情境导入】 水是生命之源,自来水是我们饮用水的主要来源,我们身边的水质如何呢?
【问题驱动】 如何测量身边的水质?
【学生活动】 结合生活,思考如何测量水质。
【活动表现】 大部分回答在水中加入洗涤剂辨别软、硬水;部分回答净水公司有专门测水质的检测仪器。
【情境导入】 电导率检测笔是水质检测常用的便携仪器。介绍电导率检测笔工作原理、量程(1-9999)us/cm、使用方法和注意事项。
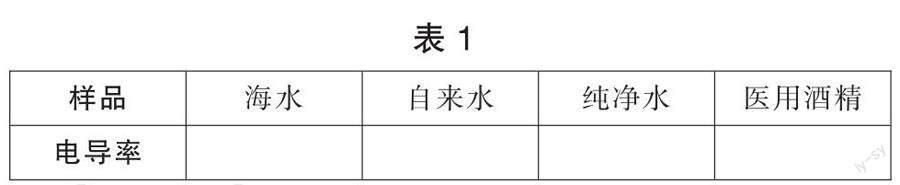
【学生活动】 使用电导率测试笔测海水、自来水、纯净水、医用酒精的电导率值,并将数据记录在表格1中。
【问题驱动】 为什么海水的读数很大?医用酒精最小?
【活动表现】 几乎全部可以回答海水中物质成分复杂,医用酒精中成分简单。学生的视角还停留在宏观角度即物质角度。
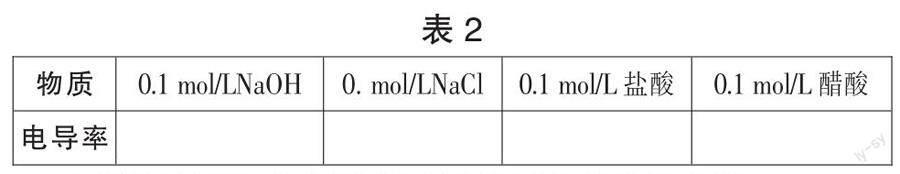
【情境导入】 同学们能不能用提供的药品模拟海水呢?提供药品:固体氯化钠、0.1 mol/L氯化钠、0.1 mol/L氢氧化钠、0.1 mol/L盐酸,0.1 mol/L醋酸、医用酒精。
【问题驱动】 模拟海水要从什么角度思考呢?
【学生活动】 从元素和溶液的电导率两个角度,需要测量提供溶液的电导率。
【活动表现】 测量提供溶液的电导率,如表2。
【问题驱动】 如何选择合适的药品并设计方案?
【学生活动】 小组合作选择药品并设计方案,汇报。
【活动表现】 第一组同学给出方案1:学生设计用0.1 mol/L氢氧化钠和0.1 mol/L氢氧化钠;第二组同学给出方案2:0.1 mol/L氯化钠;第三组同学给出方案3:0.1 mol/L氯化钠和固体氯化钠;第四组同学给出方案4:0.1 mol/L氢氧化钠和0.1 mol/L氢氧化钠和固体氯化钠。
【任务2】 建立宏微过程。
【问题驱动】 显然方案3最便捷可行,氯化钠溶于水发生了什么变化呢?在水中以什么形式存在?
【情境导入】 播放氯化钠在水溶液中变化的微观结构示意图。
【问题驱动】 常见的酸、碱、盐和有机物在水中以什么形式存在呢。
【学生活动】 思考常见的酸、碱、盐和有机物在水中的存在形式。
【活动表现】 大部分学生都能知道HCl、NaOH、NaCl和乙醇在水中的存在形式。
【情境导入】 播放“氯化钠熔化过程的导电情况”的视频。
【学生活动】 观看视频,观察实验现象,思考NaCl固体能否导电。
【活动表现】能通过上述探究总结氯化钠在不同条件下的存在形式。
【问题驱动】 熔融的NaCl为什么能导电?导电需具备什么条件?
【情境导入】 播放氯化钠熔化过程的微观结构示意图。
【提升总结】 电离条件为在水溶液中或熔融状态;电解质为在水溶液或熔融状态下导电的化合物;非电解质为在水溶液和熔融状态下都不导电的化合物。酸、碱、盐为常见的电解质,大部分有机物为非电解质。
【任务3】 实现符号表征。
【情境导入】 观察用微观粒子示意图体现NaCl电离的过程,使用化学语言表达该过程。
【学生活动】 利用微观粒子示意图体现HCl的电离过程,并用化学语言表达电离过程。提示:氯化氢由分子构成。
【活动表现】 学生问题表现:(1)氯化氢分子画成氢离子和氯离子组成;(2)不注意微粒数量;(3)氯化氢分子用一个圆圈表示。
【问题驱动】 书写电离方程式需要注意什么?
【学生活动】 建立电离的数量关系(原子守恒、电荷守恒),左侧为化学式,右侧为离子符号。由宏观物质到微观粒子。
【任务4】 模型的应用。
【学生活动】 分组完成以下3组物质的电离方程式:(1)HCl、NaOH、KCl;(2)H2SO4、KOH、Al2(SO4)3;(3)NaHSO4。进行各小组间互评。
【问题驱动】 酸碱盐电离有什么特点?
【情境导入】 设计实验判断化合物X、化合物Y是否为电解质。
【学生活动】 小组讨论设计实验方案,并投影展示,小组互相评价。
【情境导入】 使用更精密的电导率仪器,检测蒸馏水的电导率。结果为0.052 mS/cm。
【问题驱动】 为什么蒸馏水的电导率不为零?
【提升总结】 建立弱电解质概念和电离方程式的书写方式,并给出常见的弱电解质:弱酸、弱碱和水。
【問题驱动】 0.1 mol/L HCl溶液和0.1 mol/L CH3COOH溶液的电导率数值相同么?这两种化合物都是一元酸,为什么测出来的数值差别如此之大?
【情境导入】 播放测量0.1 mol/L HCl溶液和0.1 mol/L CH3COOH溶液pH的视频。给出资料:溶液中氢离子浓度可通过pH计测得,pH=-lgc(H+),氢离子浓度越大,pH值越小。
【提升总结】 建立强电解质概念。
【问题驱动】 常见的强电解质有哪些?
【提升总结】 学生列举常见的强电解质;强酸、强碱和大部分盐。
【学生活动】 用微观结构示意图表示等浓度盐酸和氢氟酸的电离程度。提示:氢氟酸为一元弱酸。
【活动表现】 能够通过多个分子表现出氯化氢完全电离和氟化氢部分电离,部分保持不变的过程。
【情境导入】 介绍电导率值在生活饮用水中的参考价值,溶液中离子浓度越大,烧水时产生水垢越多,但水中的矿物质对人体也有一定的益处,所以固体总溶度只是水质参考的一个条件,并非决定性因素。
【活动表现】 对身边的水质判断有初步认识,建立多角度评价标准。
【提升总结】 溶液体系与生命活动,生产生活息息相关。期待同学们对溶液体系微观粒子的行为不断地探索。科学地保护水环境,合理使用水资源。
2.4 板书设计(图2)
2.5 评价量表
評价量表是教学评价的一种方式,笔者设计了如表3所示的评价量表,从课前、课中和课后三个时间维度,本着学生自评、学生互评和教师总评三个角色维度对学生的学习活动进行真实性评价,可操作性强。评价不应该只出现在教学结束之后,局限于纸笔评价,应围绕教学目标而服务,并非一个孤立环节,评价是教学中重要的组成部分,衡量教与学之间的转换效率,教育者的付出和学习者的产出才能衡量一节课的效率和价值[ 2 ]。评价设置可以促进教与学的有机衔接,让教学真正落到实处,而非纸上谈兵,反过来,教学评价也可以促进教学反思,优化教学过程与效率。不同活动呈现不同的评价方式,但评价的互动性不可欠缺,不仅要进行学生的自评和反思,还要进行组内合作的互评,体现组员的贡献,也要有课堂内外的师生互动展现思维的冲突和认知的建立。总之好的评价具有综合性,也应该有课堂重点的凸显。本课时凸显学生的动手操作和纸笔测试(电离方程式及微观示意图的表示)。
3 教学反思
本节区级公开课教学结束后,笔者结合课堂实效与课后的建议做出以下反思。
3.1 教学情境真实化,课程资源本土化[ 3 ]
情境设置合理,利用大单元教学 ,情境取材真实化、本土化。身边的水样如海水、自来水、纯净水和医用酒精都是学生随处可见的教学资源。三安光电集团是厦门本土素材,生产过程中硫酸废水的情境的运用体现了课程资源本土化,身边自来水中离子探究和检验更是使学生体验学以致用。在三种水环境的情境下展开了3课时,本文为第1课时,通过化合物溶液的电导率变化引发学生对化合物在不同环境下的存在形式展开思维风暴。
3.2 模型的建立和运用与证据推理相结合
利用简单的实验仪器,通过电导率笔的实验数据让学生直观感受电解质的电离,不断强化学生的宏观和微观的视角,以及证据推理的认知。通过宏观电导率笔的数值证明溶液体系中微观粒子的存在形式。反复运用此模型,最终建立宏观微观的关联和认识。
3.3 宏观-微观-符号的三重表征相结合
借助微观结构示意图评价学生对电离的认识,进而形成宏观-微观-符号三重表征。通过电离方程式的书写建立酸、碱、盐可以电离的观念,并可以通过电导率数值作为证据证明其电离,同时反复实现模型的运用。学生通过画微观结构示意图进一步感受电解质的电离程度差异,解决了学生对电解质电离条件的模糊认识。利用多元活动的设计,使学生自主参与,自主探究,实现教师引导,学生主导,培养了学生宏微结合、证据推理、实验探究的核心素养,同时提升了学生总结归纳的能力。
参考文献:
[1] 中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020:3.
[2] 崔允漷,夏雪梅.“教-学-评一致性”:意义与含义[J].中小学管理,2013(1):4-6.
[3] 陈治国.中学化学课程资源的有效开发与利用[J].教育与教学研究,2009(12):117-122.
2021年厦门市教育科研规划领导小组办公室课题:基于核心素养的高中化学课堂教学评价研究(21013)研究成果

