胎盘生长因子联合脐动脉S/D值对子痫前期的预测价值*
戴红因 白砚耘 脱鸣富 付蕊宁 陈 蕾 石 岩 多文博
甘肃医学院附属医院,甘肃省平凉市 744000
妊娠期高血压疾病(Hypertensive disorders of pregnancy,HDP)是妊娠期常见的并发症,据报道[1]全球发病率2%~5%,国内报道发生率5%~12%,并在经济欠发达地区高发,导致胎盘早剥、胎死宫内、子痫等严重并发症,严重威胁着母胎安全。妊娠期高血压疾病分为四种类型[2](1)妊娠期高血压,(2)子痫前期—子痫,(3)慢性高血压并发子痫前期, (4)妊娠合并慢性高血压。子痫前期(Preeclampsia,PE)是指妊娠20周后出现收缩压≥140mmHg(1mmHg=0.133kPa)和(或)舒张压≥90mmHg,伴有尿蛋白≥0.3g/24h,或随机尿蛋白(+),或虽无尿蛋白,但合并心、肺、肝、肾等重要器官受累,或血液、神经或消化系统的异常改变,胎盘—胎儿受到累及等。该病的病因及发生机制复杂[2],存在多因素、多机制、多通路的综合征性质。因HDP暂无有效的预测手段,不能做到早识别及早发现,发现时已成为重症,或已造成孕妇严重的靶器官损害,需要转诊至上级医院救治,并需多学科联合救治。积极寻找早期筛查或预测PE的方法,使潜在的妊娠期高血压患者能够早诊断、早干预、早治疗,改善母胎结局,是目前重要的临床任务。
目前国内外对PE的早期筛查的研究主要集中在多参数联合筛查[3-5],其中PLGF成为研究的焦点,通过以PLGF为主导的联合筛查被广泛研究,但目前的研究中,关于PLGF联合胎儿脐动脉血流舒张期/收缩期比值(S/D)对PE的预测价值则较少被提及,本文就PLGF联合脐动脉S/D对PE的预测价值做一探讨。
1 资料和方法
1.1 一般资料 选取2020年4月—2021年4月就诊于我院产科分娩的产妇。纳入标准:严格按照《妊娠期高血压疾病诊治指南(2020)》的诊断标准[2],将诊断为PE患者52例纳入研究组,将正常分娩且孕期无合并症的孕妇122例纳入对照组,研究对象均为单胎妊娠。排除标准:(1)数据资料不全者;(2)排除慢性高血压合并妊娠、妊娠合并糖尿病、妊娠合并甲减、双胎妊娠、脐带绕颈、胎儿畸形或发育不良等有其他合并症的患者。研究组中重度PE 6例,其中4例为早发型PE(20周<发生孕周<34周)。所有纳入的孕妇最终新生儿出生后Apgar评分>7分,羊水清亮,无重度新生儿窒息等严重并发症发生。两组间BMI、孕次、产次(初产妇、经产妇)、居住地(城镇、乡村)均无统计学差异(P>0.05),两组间年龄比较有统计学差异(P=0.020),见表1。对照组平均终止妊娠孕周为39+3周,研究组为39周。
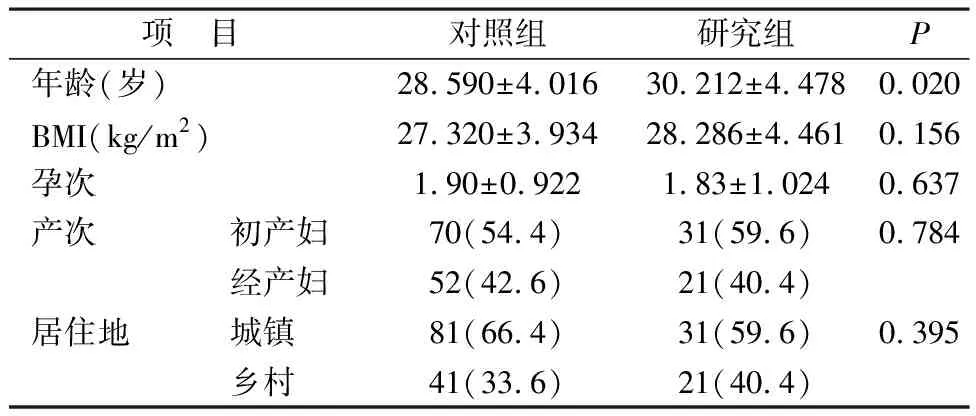
表1 两组孕妇一般资料比较
1.2 检测方法
1.2.1 血清PLGF检测方法:(1)检测仪器:德国LepziT-MeterⅠ荧光免疫分析仪和测试板;(2)检测对象:对来我院产检并建档孕妇,如在孕12周检测胎儿NT无明显异常,自孕12周开始检测血清PLGF;(3)检测方法:清晨,空腹状态下抽取外周静脉血3mL至加有EDTA抗凝剂的试管中,定量吸管取200μL全血加至测试板加样孔,将测试板插入分析仪,待分析仪判读结果;(4)结果判读:在对应孕周,如测定PLGF值低于阈值,需采取相应处理措施,测试板最低测定值为12pg/mL,不同阶段其阈值分别为:孕12~15周,PLGF<32pg/mL,孕16~20周,PLGF<60pg/mL,孕>20周,PLGF<100pg/mL。
1.2.2 脐动脉S/D测定方法:(1)使用仪器:深圳mindray公司生产的Resona 8彩色多普勒超声诊断仪。(2)检测方法:嘱孕妇半卧位,暴露腹部,探头频率3.5Hz,测量脐动脉收缩末期最大血流速度(S)与舒张末期最大血流速度(D)比值(S/D),共3次,取平均值为最终结果。(3)结果判读[6]:孕33周前脐血流S/D>3,排除胎儿畸形、脐带异常、胎儿宫内发育迟缓、胎盘功能不良等病理情况后观察;孕33周以后,脐动脉血流阻抗分三级:1级:S/D值<3.0,脐动脉血流阻抗正常;2级:S/D值≥3.0,但<4.0,不会引起急性胎儿窘迫,但应及时治疗,防止病情恶化;3级:S/D值≥4.0,将导致围产儿预后不良。如果诊断为脐血流异常,应每天数胎动以观察胎儿状况。如果胎儿一般状况良好,建议采取左侧卧位,如果没有好转,需要吸氧治疗或终止妊娠。
1.3 观察指标 (1)比较两组间基础参数有何差异:年龄、孕次、产次、居住地;(2)比较两组在不同孕期的PLGF、脐动脉S/D值差异;(3)观察不同检测方法在不同孕期对子痫前期的预测价值,计算PLGF、脐血流S/D单独或联合检测的灵敏度、特异度、曲线下面积(AUC)、95%可信区间(95%CI)、约登指数,并绘制ROC曲线。
2 结果
2.1 两组孕妇不同孕期PLGF水平比较 对照组的PLGF平均值在不同孕期均高于研究组,差异有统计学意义(P<0.05),见表2。

表2 两组孕妇不同孕期PLGF水平比较
2.2 两组孕妇不同孕期S/D水平比较 在孕中期,两组S/D值比较,差异无统计学意义(P>0.05);孕晚期,研究组S/D值高于对照组,差异有统计学意义(P<0.05);孕20~42周的S/D值比较,有明显统计学差异(P=0.001),见表3。

表3 两组孕妇不同孕期S/D水平比较
2.3 不同孕期不同方法预测PE的价值分析 计算不同孕期的PLGF、S/D值以及PLGF+S/D预测PE的灵敏度、特异度、95%CI、约登指数,并绘制不同检测方法的ROC曲线(见图1~3),计算其AUC,结果表明,在不同孕期,PLGF单独预测PE的效能优于S/D,PLGF+S/D值预测PE效能在孕中期低于PLGF,高于S/D,在孕晚期二者联合预测效能优于PLGF、S/D(AUC=0.804),见表4。
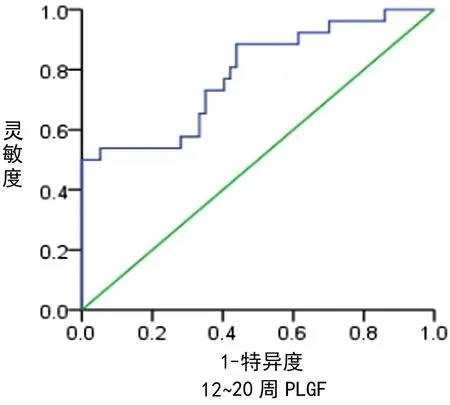
图1 孕早期PLGF预测妊高征ROC曲线
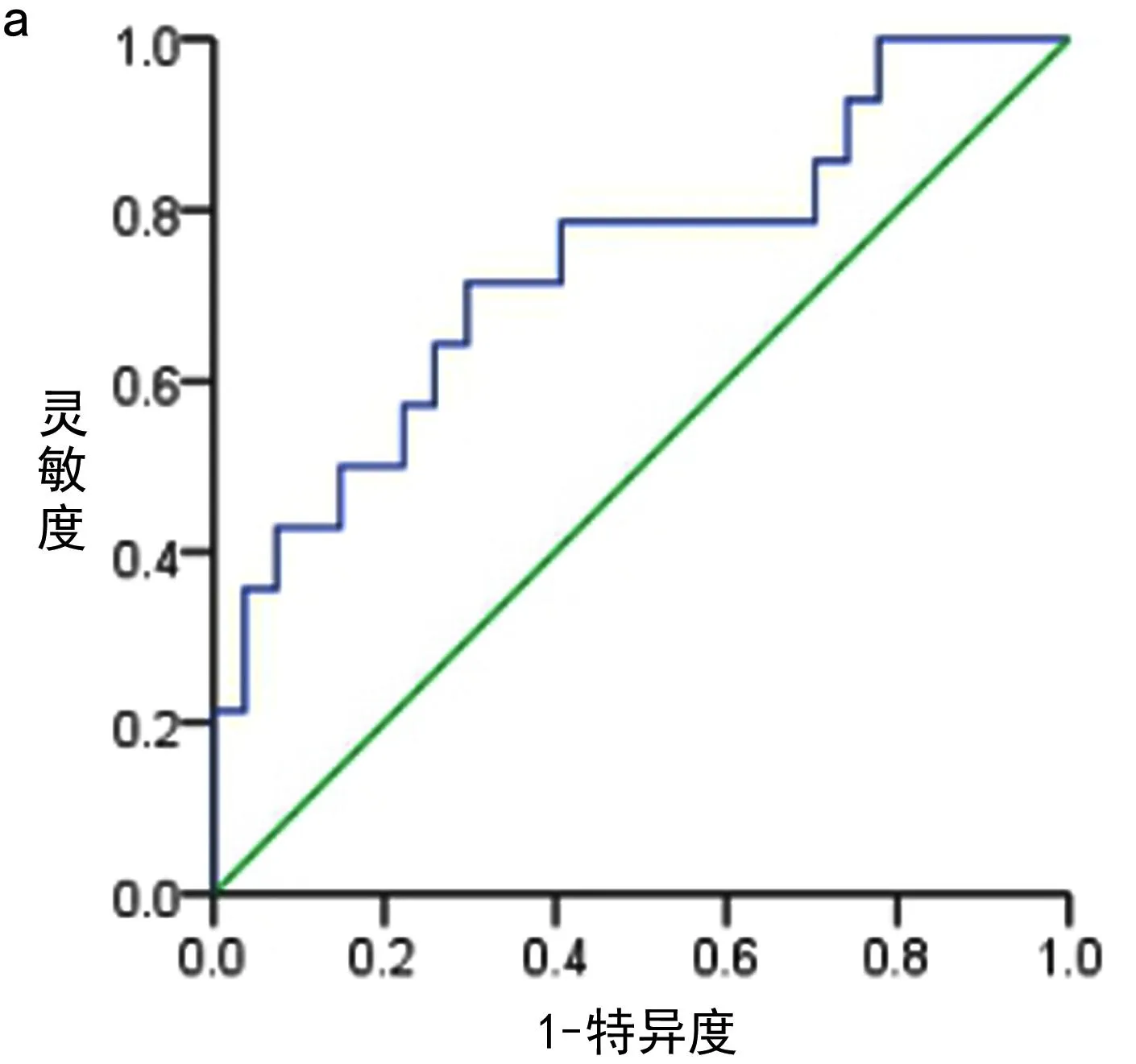
图2 孕中期PLGF、S/D 单独或联合检测预测妊高征ROC曲线
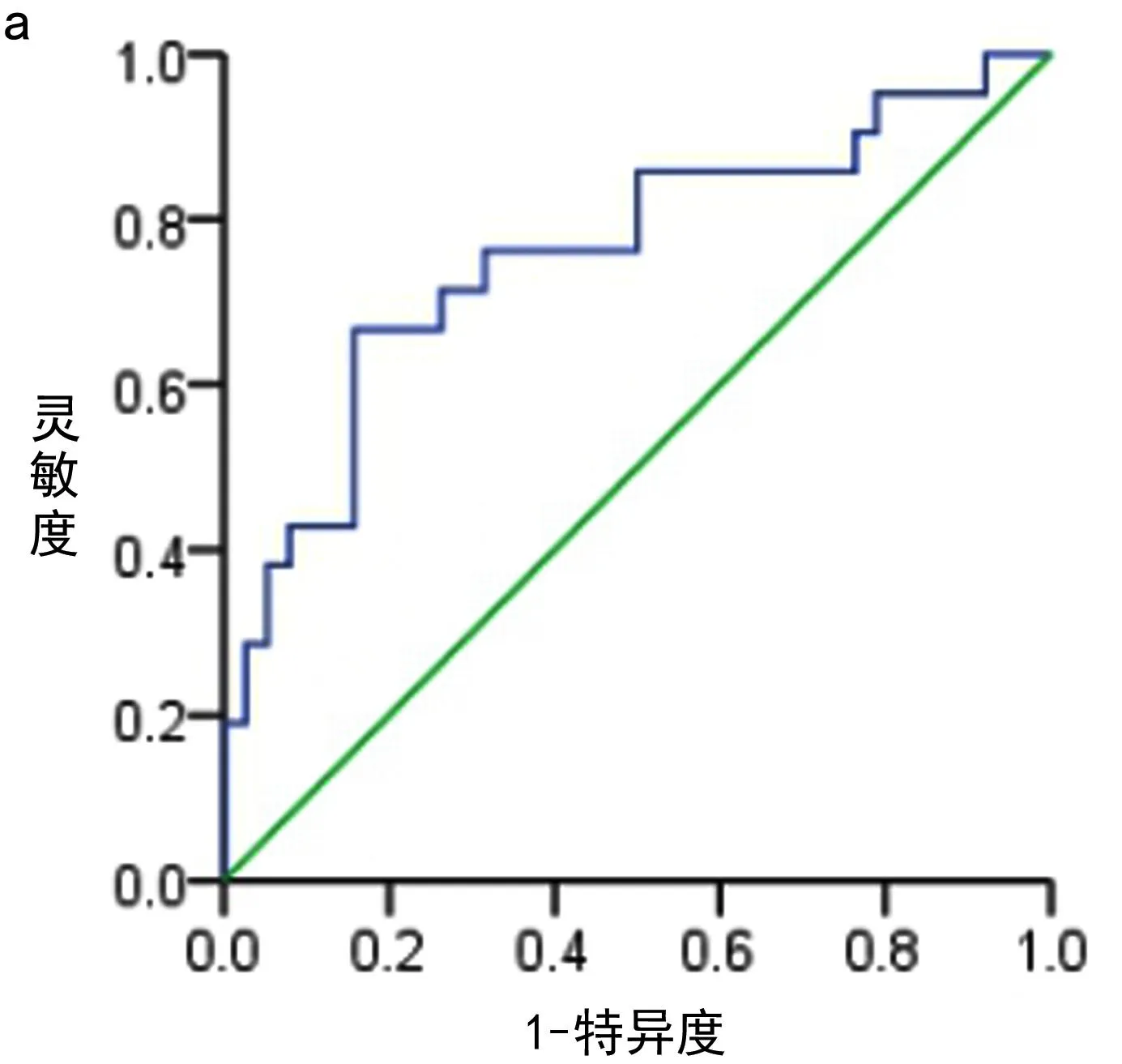
图3 孕晚期PLGF、S/D 单独或联合检测预测妊高征ROC曲线
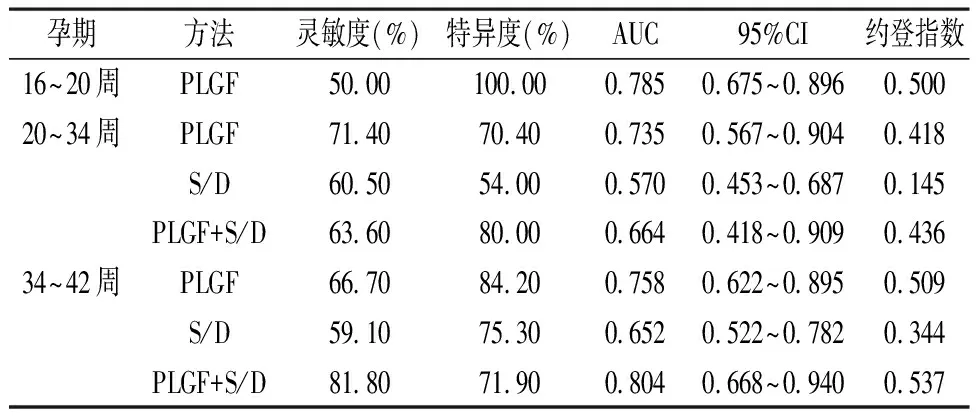
表4 不同孕期PLGF、S/D 单独或联合检测对妊高征预测指标比较
3 讨论
目前PE发病机制的研究以“两阶段”学说为主[7],第一阶段主要病理变化为缺氧导致的子宫螺旋动脉重塑受阻,第二阶段认为胎盘释放多种活性因子导致母体发生炎症反应及血管内皮受损,导致血压的升高。依据病理机制,胎盘的病变是PE发生的根本原因,胎儿、胎盘娩出后疾病得到缓解,支持了这一论证,有研究指出[8],在胎盘早剥、异位妊娠、流产等病理妊娠患者血清PLGF明显下降甚至检测不到。希望通过更多的临床研究能将对PE病理生理学的理解转化为PE的预测因子,并应用于临床,改善母胎结局。
国家卫生计生委在2013年发布的《医疗机构临床检验项目(2013年版)》中提出将胎盘生长因子的检测应用于PE的预测。Duhig KE等的研究报道指出[9],PLGF的检测明显缩短了临床确诊PE的时间,减少孕产妇和围产期不良结局,建议对高危孕妇检测在孕期检测PLGF。本研究结果显示,PLGF单独作为PE的预测指标,研究组在不同孕期的PLGF值均明显低于对照组,差异有统计学意义,刘娇兰等的研究结果亦显示[10],PLGF在孕早期预测PE的效能优于血小板参数、子宫动脉血流单独或联合预测。本研究中孕周的界定依据PE定义中发病孕周的界限,孕早期界定范围12~20周,孕中期20~34周,孕晚期34~42周,结果分析显示,对照组与研究组的PLGF水平总体在孕中期达到高峰,孕晚期再次下降。相关研究表明[11],对照组与研究组的PLGF浓度在妊娠期总体变化趋势一致,PLGF在孕8~12周开始升高,在孕29~32周达高峰,之后下降,但先兆子痫患者的PLGF水平在13~16周时开始明显低于对照组(P=0.01),并通过PE患者发病前血清PLGF水平的研究显示,在PE发病前9~11周,PLGF浓度开始下降,在高血压或蛋白尿发作前5周内显著下降。其变化趋势的机制考虑与胎盘在孕期的变化有关[8],胎盘在孕8周开始形成,此后随着孕周的增加,胎盘血管分支形成,胎盘体积增加,分泌多种酶、激素、神经递质和细胞因子,维持正常妊娠,在孕晚期,胎盘逐渐出现钙化,储备能力下降,分泌功能减弱。
在正常妊娠中,脐动脉S/D值随着孕周的增加而逐渐下降,在妊娠22周前,脐动脉血流变化甚微,随着孕周增加,胎盘循环阻力下降,胎盘绒毛血管增多,脐动脉S/D值显著下降[12]。一项系统性回顾和双变量Meta分析结果显示[13],多普勒超声在妊娠中期比妊娠早期可以对PE及胎儿宫内窘迫提供更好的预测价值。Thomas MR等的研究为本研究提供了解剖学的支持[14],指出PE患者与正常妊娠患者的脐带相比,PE患者的脐带水肿明显,基底膜厚度增加,脐动脉、脐静脉管腔面积明显减小,华通胶显著增加。基于此,本研究脐动脉S/D研究从孕20周后开始。本研究对照组与研究组的孕中期及孕晚期的脐动脉S/D分别进行检验发现,在孕中期,两组间的S/D值比较差异无统计学意义(P=0.21),在孕晚期,研究组S/D值明显高于对照组,差异有统计学意义(P=0.047),比较两组20~42周的S/D值,差异具有统计学意义(P=0.01),说明PE患者的S/D总体水平高于正常分娩患者。
通过对孕中期及孕晚期两组孕妇PLGF联合S/D检测结果分析,在孕中期,PLGF+S/D的预测价值(AUC=0.664)高于S/D值(AUC=0.570),但低于PLGF单独检测的预测价值(AUC=0.735),而在孕晚期,PLGF+S/D的预测价值(AUC=0.804)优于PLGF(AUC=0.758)或S/D单独(AUC=0.652)的预测价值。本研究结果与刘晓宁等的研究结果提出生物学标志物联合超声在孕早中期检测的预测价值高于单独检测有所出入[15]。
分析产生这种结果的可能原因在于本研究纳入的PE患者共52名,终止妊娠的平均孕周39周,其中诊断为重度PE的患者共6名,占11.5%,包括早发型(发生孕周≤34周)的患者4例,6例重度PE患者新生儿出生后Apjar评分>7分,羊水清亮,未发生严重不良妊娠结局,故研究组中纳入患者中88.5%为轻型PE患者,平均发生孕周较晚,妊娠结局良好,导致本研究结果中S/D值在孕中期(AUC=0.570)及孕晚期(AUC=0.652)对PE的预测效能均较低,且PLGF+S/D预测PE在孕晚期较孕中期更有意义,也证实了这一点,发病晚,症状轻,胎盘功能及脐血流改变发生与疾病发生孕周一致。
该研究中对照组与研究组基础资料比较显示,两组年龄有显著性差异(P=0.020),可能与随着年龄增加,妊娠期心血管系统对血容量增加顺应性下降,子宫血管内皮细胞多发进行性损伤,胰岛素敏感性降低等有关[16]。年龄的差异可能也导致了研究结果的偏移。
基于本研究结果,在今后研究中可将轻度PE患者及重度PE患者进行分层分析,分别探讨预测指标在轻度与重度患者之间的差异,提出更精准的预测方法,指导临床预防及诊治。年龄作为高危妊娠的独立危险因素,在妊娠管理中应得到重视。
综上所述,PLGF可以作为PE预测指标,S/D预测PE的效能较弱,PLGF联合S/D预测子痫前期的价值在孕晚期优于孕中期,可能与疾病发生的孕周及其严重程度有关,需进一步对早发型PE与晚发型PE的患者进行分层对照分析。PLGF属血管内皮生长因子家族,下降会使妊娠期血压升高,而抗肿瘤药物靶向血管内皮生长因子-A(VEGF-A)的单克隆抗体的主要副作用为血压升高[17],有学者亦提出妊娠胎盘的生长与肿瘤的生长有同源性,有望通过对胎盘与肿瘤的生长过程进行对照研究,探索二者的异同,为肿瘤患者的临床诊疗提供新思路。

