血清基质金属蛋白酶-9、可溶性尿激酶型纤溶酶原激活物受体及纤溶酶原激活物抑制因子-1联合检测预测老年慢性心力衰竭患者预后的价值
杨 博, 王艳丽, 崔晓敬
(1. 河北省廊坊市中医医院 心血管病科, 河北 廊坊, 065000;2. 河北省廊坊市人民医院 急诊重症医学科, 河北 廊坊, 065000)
慢性心力衰竭(CHF)简称心衰,是多种因素(如炎症、心肌梗死、心肌病等)共同作用下引发的一种心肌损伤,也是心血管疾病进展的终末期表现,患者多已发生心肌结构改变、心肌功能受损,从而出现心室泵血及充盈能力不足等一系列相关症状(如呼吸困难、乏力等)[1-2]。近期研究[3]发现,血清基质金属蛋白酶-9(MMP-9)参与细胞凋亡及心室重塑过程,其高表达可能预示着血管或心室重塑,可预测心血管疾病的预后情况。可溶性尿激酶型纤溶酶原激活物受体(suPAR)与多种疾病(如糖尿病肾病、冠心病、颈动脉斑块等)的发生发展密切相关,被认为是脑卒中及冠心病的危险因素之一[4]。纤溶酶原激活物抑制因子-1(PAI-1)是丝氨酸蛋白酶抑制剂家族成员,与动脉粥样硬化、肺气肿、心血管疾病等紧密相关[5]。本研究对不同预后CHF患者及健康体检者的血清MMP-9、suPAR、PAI-1水平进行了分析,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取廊坊市中医医院2020年1月—2021年12月收治的108例老年CHF患者作为研究组,男61例,女47例,年龄60~77岁,平均(64.52±6.31)岁; 体质量指数(BMI)为20.7~26.3 kg/m2, 平均(21.84±2.30) kg/m2; 纽约心脏病协会(NYHA)心功能分级Ⅱ级29例,Ⅲ级43例, Ⅳ级36例。另选取同期进行健康体检的50名老年人作为对照组,体检结果显示无炎症性疾病,无心脑血管疾病史,男28例,女22例,年龄51~78岁,平均(63.48±5.92)岁, BMI为20.1~26.6 kg/m2, 平均(22.03±1.97) kg/m2。研究组与对照组在性别构成、年龄及BMI方面比较,差异均无统计学意义(P>0.05)。本研究通过了医院伦理委员会的审核批准。
纳入标准: ① 年龄60~80岁者; ② 符合《中国心力衰竭诊断和治疗指南2018》[6]中的CHF诊断标准者,并经超声心动图检查确诊; ③ 临床资料完整者; ④ NYHA分级Ⅱ~Ⅳ级者; ⑤ 对本研究知晓并签署了知情同意书。排除标准: ① 存在严重肝肾功能损害者; ② 存在急性心肌梗死、急性心肌炎或先天性心脏病者; ③ 合并恶性肿瘤、血液系统疾病、免疫系统疾病者; ④ 精神疾病患者; ⑤ 随访不足1年者。
1.2 方法
1.2.1 血清学检测: 采集所有研究对象的空腹静脉血5 mL, 采用高速离心机处理10 min(转速3 000转/min), 保留血清待检。采用酶联免疫吸附法测定血清MMP-9、suPAR、PAI-1水平(试剂盒由深圳酶联生物科技有限公司提供),严格按照试剂盒说明书进行操作。
1.2.2 随访: CHF患者接受相应治疗后顺利出院,出院后进行电话及门诊随访,记录主要不良心血管事件(MACE)、心衰再次入院、心源性死亡、恶性心衰、全因死亡发生情况,发生上述任意情况则判定为预后不良,否则为预后良好。
1.3 统计学方法
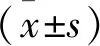
2 结 果
2.1 研究组与对照组血清MMP-9、suPAR、PAI-1水平比较
与对照组相比,研究组血清MMP-9、suPAR、PAI-1水平更高,差异有统计学意义(P<0.05)。见表1。

表1 2组血清MMP-9、suPAR、PAI-1水平比较
2.2 不同NYHA分级患者的血清MMP-9、suPAR、PAI-1水平比较
NYHA分级Ⅱ级、Ⅲ级、Ⅳ级CHF患者的血清MMP-9、suPAR、PAI-1水平呈逐渐升高趋势,差异均有统计学意义(P<0.05), 见表2。

表2 不同NYHA分级患者的血清MMP-9、suPAR、PAI-1水平比较
2.3 不同预后患者的一般资料及血清学指标比较
随访1年的结果显示,预后良好65例,预后不良43例,预后不良率为39.81%(43/108)。预后良好与预后不良患者在性别、BMI、心率、合并糖尿病方面比较,差异均无统计学意义(P>0.05); 与预后良好患者相比,预后不良患者的年龄更大,合并高血压率更高,左室射血分数(LVEF)更低,左室舒张末期内径(LVEDD)、MMP-9、suPAR及PAI-1水平更高,差异有统计学意义(P<0.05)。见表3。

表3 不同预后患者的一般资料及血清学指标比较
2.4 老年CHF患者预后不良的危险因素
Logistic回归分析显示,年龄、MMP-9、suPAR、PAI-1均是老年CHF患者预后不良的危险因素, LVEF是老年CHF患者预后不良的保护因素(P<0.05)。见表4。
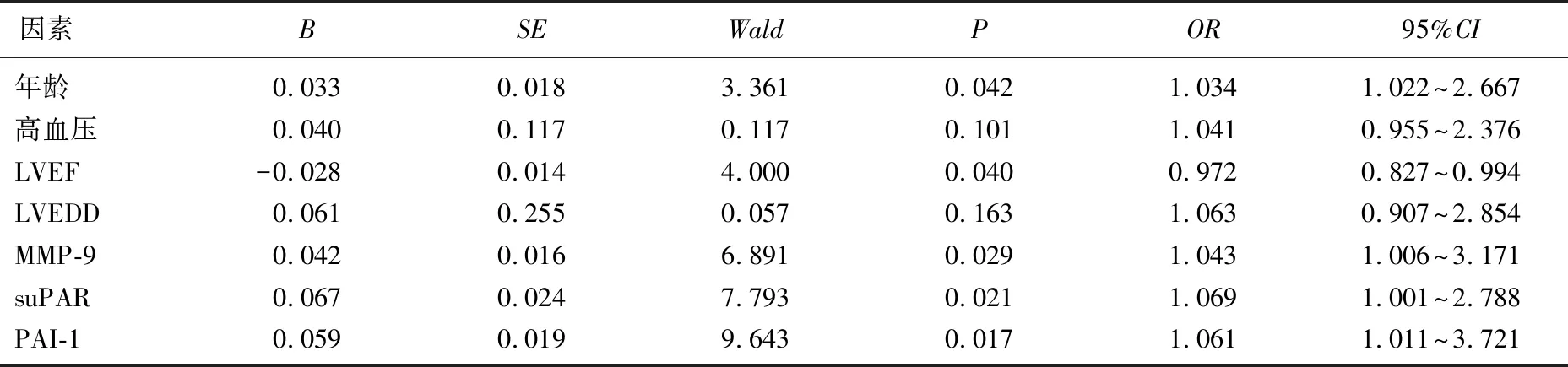
表4 老年CHF患者预后不良的危险因素
2.5 血清MMP-9、suPAR、PAI-1对预后不良的预测价值
血清MMP-9、suPAR、PAI-1通过Logistic回归分析形成联合指标,绘制血清MMP-9、suPAR、PAI-1及3项指标联合诊断预后不良的ROC曲线,结果显示,血清MMP-9、suPAR、PAI-1单独检测及3项联合检测的曲线下面积(AUC)分别为0.711、0.829、0.768和0.840, 3项联合检测的敏感度为88.21%, 特异度为79.46%。见表5。
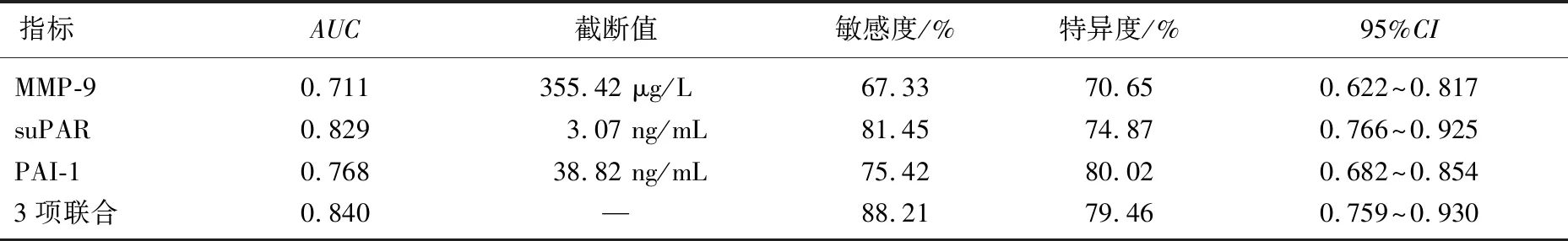
表5 血清MMP-9、suPAR、PAI-1对预后不良的预测价值
3 讨 论
CHF的发病机制复杂,而心室重构和神经内分泌系统长期激活是其基本病理病机。心室重构引起心肌功能及结构改变,进而表现为心肌僵硬、心肌收缩能力减弱。MMPs是一组能够特异性降解组织基质成分的内源性蛋白酶家族,参与了心肌组织重构过程,其中左室心肌组织为MMP的主要来源。MMPs的基因表达升高可诱导心室重构、扩张[7]。MMP-9为蛋白水解酶,能够特异性地降解细胞外基质成分,通过直接降解细胞外基质成分参与心肌重塑。
心室重构过程中,炎症反应扮演着至关重要的角色。suPAR是一种新型的炎症标志物,是尿激酶型纤溶酶原激活物受体的可溶形式,炎症刺激可使细胞表面裂解出大量的suPAR入血,从而可检测到血suPAR水平升高[8]。既往研究[9]显示, suPAR在感染性疾病、慢性疾病的诊断中均有较高的应用价值。陈玉等[10]报道指出,冠心病患者的血清suPAR呈高表达,并且suPAR与冠状动脉病变支数、病变程度均呈正相关。国外有大规模、长期跟踪随访研究[11]指出,新发CHF患者的血浆suPAR水平显著升高。本研究中,研究组老年CHF患者的血清MMP-9、suPAR水平显著高于对照组,并且MMP-9、suPAR水平均随着NYHA分级的升高而升高,证实CHF的发生、发展均与炎症反应引起的心室重构有着密切联系。一方面, CHF患者的机体多处于炎症反应状态,使得suPAR分泌增加; 另一方面, suPAR可发挥细胞黏附、细胞趋化等作用,促使炎症细胞聚集于内膜下,从而分泌各种炎症因子,正反馈作用下使得炎症效应被放大,使炎症反应加剧,进而对心肌细胞结构及功能造成损伤,引发心室重构,最终导致或加重CHF。心衰发生时, MMPs被激活,基质中的胶原成分被降解,原胶原网结构发生变化,心肌细胞间的连接变得松散,在室壁压力的持续作用下,心室就会发生几何形变,进而导致心室重构。MMP-9水平的升高又会刺激心脏新结缔组织生成,促进左室重构,从而加快心衰进展。
PAI-1可抑制丝氨酸蛋白酶活性,其与多种心血管疾病(如心衰、冠心病等)有着紧密联系。相较于正常人,冠心病患者的血PAI-1水平明显更高,并且高水平PAI-1患者的急性冠状动脉事件、斑块破裂发生风险更高[12]。临床可通过测定tPA/PAI-1复合物水平进行心衰的诊断与病情评估。本研究结果显示,研究组患者的血清PAI-1水平显著高于健康体检者,且NYHA分级越高,血清PAI-1水平越高,这与相关报道[13]结论基本一致,表明血清PAI-1水平与心功能损伤程度密切相关,提示PAI-1可能参与了老年心衰的发生及进展。研究[14]认为,心脏过度表达PAI-1可改变心肌梗死后左心室反应,冠状动脉梗死后PAI-1升高可促进心脏纤维化,导致心脏舒张机能失调,而PAI-1主要通过加速心肌纤维化和损伤左心室功能来参与慢性心衰的发生发展过程。
CHF患者的预后会受到多种因素影响,本研究结果显示,除年龄、LVEF以外, MMP-9、suPAR、PAI-1均为危险因素。本研究还建立了MMP-9、suPAR、PAI-1这3项联合的复合指标,经ROC曲线分析显示, MMP-9、suPAR、PAI-1对老年CHF患者预后不良均有一定的预测价值,这与赵茜等[15]报道相符。相较于单项指标,3项指标联合诊断预后不良的AUC更高,敏感度更高,特异度较好,其预测效能更好。这可能是因为MMP-9、suPAR、PAI-1能够从不同途径反映心功能变化, 3项指标联用能够更为全面地评估心功能受损程度,从而提高预测准确性。由此提示,临床在对老年CHF患者进行病情评估时,对于MMP-9、suPAR、PAI-1超过截断值的患者应引起高度重视,这类患者发生不良预后的风险较高,临床有必要尽早采取相应的治疗措施,以降低MACE的发生风险[16]。
综上所述,老年慢性CHF患者的血清MMP-9、suPAR、PAI-1表达与心功能分级及预后不良密切相关,测定血清MMP-9、suPAR、PAI-1水平可为临床预测患者预后不良提供重要依据。

