急性心肌梗死患者急诊经皮冠状动脉介入治疗术后发生冠状动脉微循环障碍的早期临床预测技术研究
王 莉, 吴春苑, 匡 龙, 宋佳贤, 任 骋, 徐 芳
(苏州大学附属张家港医院 心血管内科, 江苏 张家港, 215600)
冠心病急性心肌梗死(AMI)的发病率呈增高趋势[1]。研究[2]发现, AMI后行再灌注经皮冠状动脉介入治疗(PCI), 开通了梗死相关动脉,大部分患者的心肌可得到有效再灌注,但仍有部分患者无法实现有效冠状动脉微血管再灌注,这种心肌微循环的灌注持续恶化现象被称为冠状动脉微血管障碍(CMD)。在AMI患者中, CMD的发生一直被认为是不良事件的预测因子,左心室重构、心力衰竭和死亡的发生率较高[3]。急诊PCI术后评估AMI患者的微血管灌注(MVO)至关重要。TIMI分级、冠状动脉流量储备(CFR)、血流储备分数(FFR)、微循环阻力指数(IMR)、心肌超声造影(MCE)和心脏磁共振(CMR)这些评估方法较复杂、耗时,需寻求更为简单、便携、可重复性高的方法以评估冠状动脉微循环再灌注恢复情况。近年来,超声心动图的二维斑点追踪技术(2D-STE)是新出现的可用于心血管疾病评估的技术,其分析得出的左室整体纵向应变(LVGLS)及应用压力-应变环(PSL)生成左室心肌做功(LVMW)等系列数据,可以全面、定量评价左心室射血分数(LVEF)及左室壁运动以外的心肌功能。本研究探讨LVGLS、全球急性冠状动脉事件注册(GRACE)评分等指标对AMI患者急诊PCI后早期发生CMD的预测价值,以有助于临床医师早期识别CMD患者,并制订更有针对性的临床治疗策略,改善患者预后[4]。
1 资料与方法
1.1 一般资料
选取2020年6月—2022年8月张家港市第一人民医院收治的急性胸痛冠心病AMI患者 90 例(失访10例,图像质量差筛除4例),最终纳入76例,其中男64例,女12例,年龄35~82岁,平均(60.03±11.80)岁。患者均行急诊经PCI再灌注治疗,术后冠状动脉血流均恢复TIMI 3级。患者在术后48 h行经胸超声心动图及MCE检查。排除标准: ① 心肌病、心肌炎、心包炎、先天性心脏病、肺源性心脏病、心脏瓣膜病者; ② 心脏起搏器置入术者; ③ 既往有心肌梗死、心力衰竭史患者; ④ 心源性休克或临床不稳定者; ⑤ 严重感染和恶性肿瘤者; ⑥ 近6个月内接受外科手术及有消化道大出血史患者; ⑦ 超声心动图图像质量不佳者; ⑧ 对声诺维声学造影剂过敏或过敏体质者。本研究经张家港市第一人民医院医学伦理委员会批准(RL-201812-001), 检查前均与研究对象签署知情同意书。
1.2 方法
1.2.1 一般资料: 收集AMI患者入院时的一般资料,包括年龄、性别、身高、体质量、体质量指数(BMI)以及既往病史、家族史、吸烟史等资料。入院后,检测血脂、血糖、糖化血红蛋白、肾功能、肌钙蛋白T峰值、氨基末端脑钠肽前体(NT-proBNP)等指标。根据介入手术结果,记录罪犯血管情况、术中是否发生无复流、门-导丝通过时间(D-W时间),评估GRACE评分。
1.2.2 超声心动图图像采集: 对所有入组患者进行全面的经胸超声心动图检查,所有图像都存储在GE专用工作站EchoPAC上进行分析。患者在每次检查时,血流动力学状态和窦性心律均稳定。LVEF根据改良的双平面Simpson法测量。常规超声心动图多普勒参数按标准化检查测量。
1.2.3 左室MCE: 由2位经验丰富的心内科心脏超声医师进行检查,确保其对患者的具体梗死部位、手术策略和用药情况均不知情。由2位医师在患者入院24 h内完善常规超声心动图检查,术后48 h进行左室声学造影检查。检查方法参照《超声增强剂在超声心动图中的临床应用: 2018美国超声心动图指南更新》。检查前12 h停用影响冠状动脉微循环及心肌收缩力的药物,行常规二维经胸超声心动图、心电监测,使用GE Vivid Q型超声仪器检查。声学造影剂为注射用六氟化硫微泡( 商品名: 声诺维), 先以生理盐水5 mL稀释,震荡后形成微泡混悬液,经肘正中静脉缓慢注射声诺维2 mL并观察心肌显影,待左心室内充满造影剂后,按“flash”键,使用高能量脉冲破坏心肌内的造影剂微泡,观察心肌再灌注情况,记录AMI患者造影微泡的充盈状态,收集20个心动周期图像,记录此时心动周期图像。观察声诺维造影剂应用过程中患者的血压、心率、心律及心电图变化。LVEF均采用二维双平面改良Simpson法测量。运用半定量计算灌注缺损节段及其积分,声学造影剂4 s内恢复充盈为1分, 4~10 s为2分, >10 s为3分,各节段计分总和除以总节段数,得出心肌灌注评分。1分为冠状动脉微循环灌注正常,纳入非CMD组。>1分患者纳入CMD组。图像分析参照美国心脏病协会(AHA)的左室17 节段法。见图1。

A: 通过MCE技术分析左室长轴心尖四腔; B: 通过MCE技术分析左室长轴心尖两腔;C: 通过MCE技术分析左室长轴心尖三腔。
1.2.4 LVGLS检测: 通过EchoPAC软件分别描述和记录左室心尖四腔、三腔及两腔切面图像,连续分析3个心动周期,在二维分层应变(AFI)模式下手动选择二尖瓣间隔、侧壁瓣环、心尖为3个定位点,生成感兴趣区,调整图像包绕心肌内、中、外层,并输入患者稳定血流动力学状态下的肱动脉收缩压及舒张压。点击“Q-analyse”键自动分析二维应变成像图并计算出LVGLS数值,见图2 。

A: 非CMD组,箭头所指左室心肌微循环灌注正常; B: CMD 组,箭头所指左室心肌微循环灌注缺损,提示CMD存在; C: 非CMD组, LVGLS根据图A计算为-22.1%, D: CMD组, LVGLS根据图B计算为-15.6%,提示前降支出现梗死后微循环障碍。
1.3 统计学分析
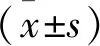
2 结 果
2.1 临床资料
本研究中共纳入76例患者,其中23例(30.26%)发生CMD(CMD组)。CMD组的TNT峰值、GRACE评分高于非CMD组,差异有统计学意义(P<0.05)。见表1。

表1 2组患者临床资料比较
2.2 超声心动图基本参数比较
2组间左房前后径(LAD)、左室舒张末期容积(LVEDV)、下腔静脉宽度(IVC)、二尖瓣舒张早期血流峰值速度/二尖瓣舒张晚期血流峰值速度(E/A)和二尖瓣舒张早期血流峰值速度/二尖瓣环平均舒张早期运动峰值速度(E/e′)比较,差异无统计学意义(P>0.05)。CMD组的LVEF低于非CMD组, CMD组肺动脉收缩压(PAPs)、LVGLS高于非CMD组,差异有统计学意义(P<0.05)。见表2。

表2 2组患者超声心动图及左室二维应变数据比较
2.3 单因素及多因素Logistic 回归分析
单因素Logistic回归分析得出, CMD发生的相关因素为TNT峰值、PAPs、GRACE评分、LVGLS和心力衰竭(P<0.01)。对上述因素进行多因素Logistic回归分析,结果显示LVGLS及GRACE评分是AMI急诊PCI术后发生CMD的影响因素(P<0.05)。见表3。

表3 发生CMD的单因素及多因素Logistic回归分析
2.4 预测CMD的ROC曲线
LVGLS是AMI急诊PCI术后发生CMD的独立预测因素, LVGLS的曲线下面积为0.858(95%CI: 0.769~0.948,P<0.001), 截断值为-16.150%, 敏感度为0.870, 特异度为0.698; GRACE评分ROC曲线下面积0.721(95%CI: 0.599~0.842,P=0.002), 截断值为148.000分,敏感度为0.739, 特异度为0.717, 见表4。LVGLS结合GRACE评分评估发生CMD的曲线下面积为0.891(95%CI: 0.815~0.967,P<0.001)。见表4、见图3。
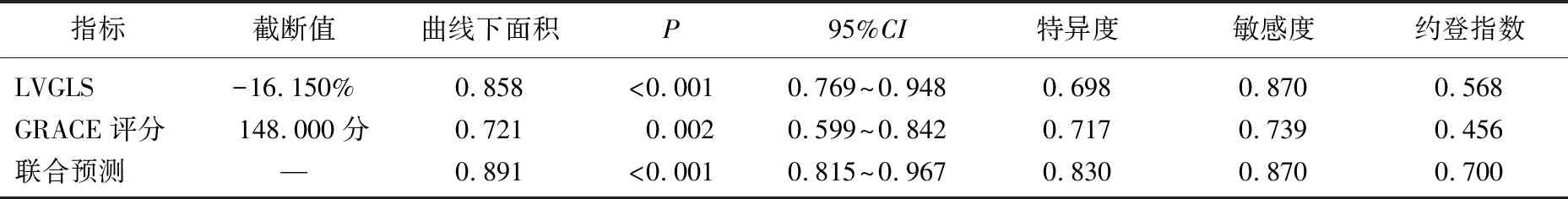
表4 预测CMD的ROC曲线的特征分析
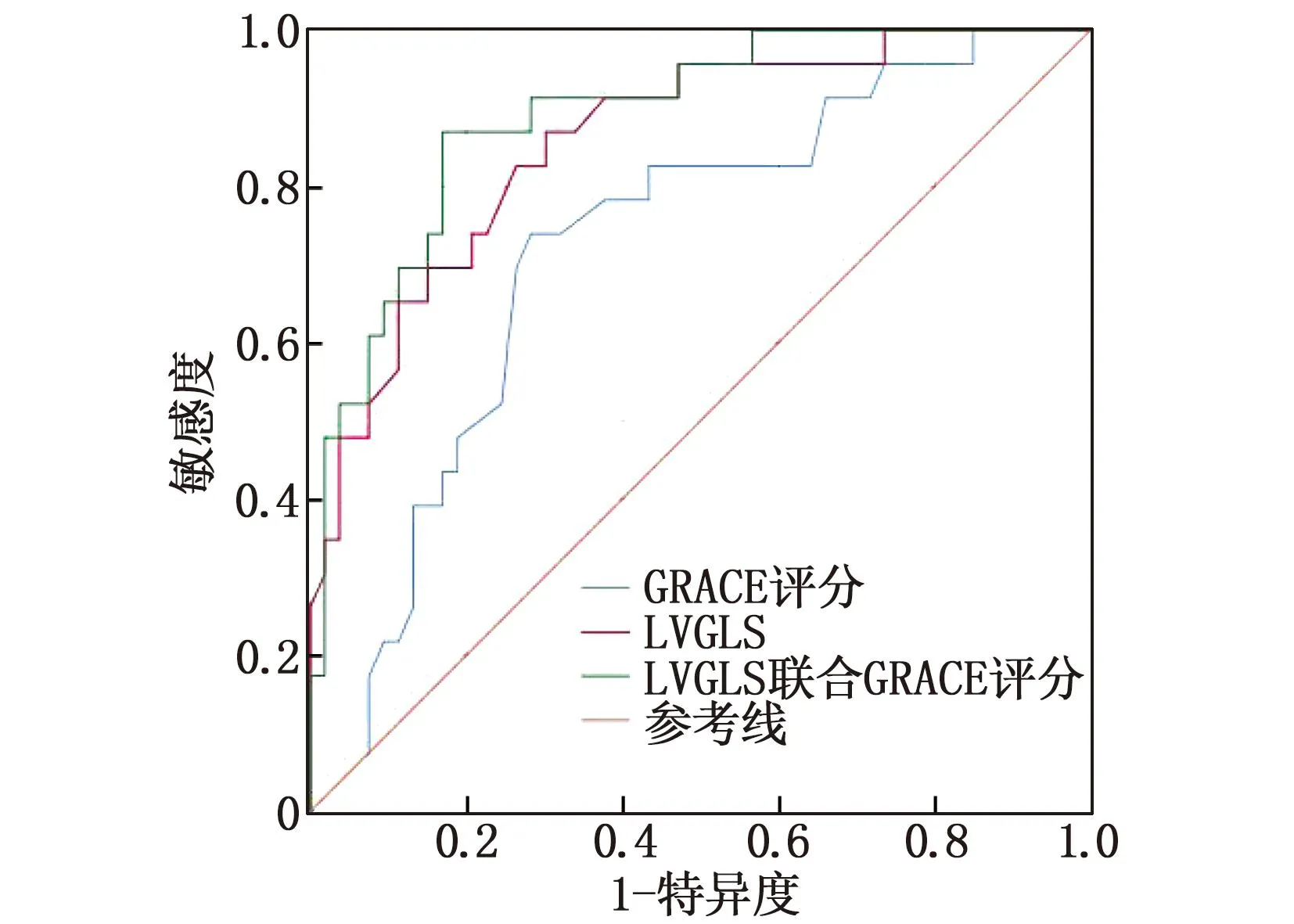
图3 LVGLS、GRACE评分单独及联合预测CMD的ROC曲线
3 讨 论
研究[5-6]表明,约50%的ST段抬高型心肌梗死(STEMI)患者在近期及远期发生心力衰竭、再入院、再梗死、心源性猝死等不良事件,分析原因为出现CMD。研究[4]表明, CMD发病机制为多种因素相互作用,包括缺血、再灌注损伤导致内皮细胞和心肌细胞死亡、心肌水肿和(或)炎症导致微血管压缩等。PCI后的再灌注与内皮损伤和(或)远端栓塞引起的MVO可造成微循环障碍,导致患者受损的心肌功能不能恢复至常态,进而发生心血管不良事件[7]。相关研究[8]对AMI首次PCI术后出现CMD的患者进行随访,结果发现, CMD与1年内心力衰竭的再住院率和病死率密切相关。基于上述原因,寻求更好的评估冠状动脉再灌注后微循环状态的方法具有重要意义。目前, CMD的诊断手段包括无创(正电子发射计算机断层显像、MCE、CMR)和侵入性(TIMI血流分级、定量血流分数、IMR、CFR)技术[4, 7-8]。 CMR成像是无创评估梗死后CMD的金标准,但AMI患者术后冠状动脉微循环的恢复情况,需要一个连续动态的观察过程,而CMR因场地要求、费用等限制,临床实际应用较少,不能作为常规开展项目。MCE利用微泡可以评估冠状动脉微循环的完整性,实时连续评估心肌存活能力,可快速评估冠状动脉微循环状态,且价格低,无电离辐射[9]。欧洲心血管成像协会(EACVI)[10]及欧洲心脏病学会心肌血运重建指南[11]推荐使用MCE评估心肌存活能力。本研究选用MCE评估AMI患者梗死血管开通后,达到TIMI 3级血流的冠状动脉微循环情况。
本研究采用单因素Logistic回归分析得出, CMD发生的相关因素为TNT峰值、PAPs、GRACE评分、LVGLS和心力衰竭(P<0.01)。CMD组的TNT峰值显著高于非CMD组, LVEF显著低于非CMD组。在上述因素中,通过多因素Logistic回归分析筛选出最相关的2个预测变量,即LVGLS、GRACE评分。本研究发现, CMD组的LVGLS显著高于非CMD组(P<0.001), 分析原因, PCI术后血流重新达到TIMI 3级,而心肌微循环不能充分有效灌注,从而引起心肌完全坏死,梗死面积增大,心室扩张、左室重构,导致心力衰竭、恶性心律失常等并发症。
LVGLS源于超声心动图的二维应变成像技术,因其安全有效、无创性、无需注射造影剂、床旁可及、可动态评估冠状动脉微循环功能的演变,且检查价格低、患者接受度高等多种优势,得到了国内外临床的认可[12-13]。研究[14]发现, LVGLS预测STEMI患者术后CMD具有较高的特异性和敏感性。LVGLS不仅与微循环损伤密切相关,也是不良左心室重构和主要不良心血管事件(MACE)的重要独立预测因子[5]。STEMI患者术后早期CMR测定的LVGLS与左室不良重塑的发生显著相关[15-17]。研究[18]证实, CMD组的LVGLS显著高于非CMD组,随访13个月后发现, CMD组心力衰竭再入院的风险增加了4倍。相关研究[19-20]验证了LVGLS对CMD的预测价值,结合罪犯冠状动脉和TNT峰值后其预测价值进一步提高,可为早期预测AMI术后CMD提供新的参考信息。
本研究结果显示, LVGLS联合GRACE评分预测AMI术后早期发生CMD风险的曲线下面积为0.891(95%CI: 0.815~0.967,P<0.001), 优于LVGLS、GRACE评分单独预测。LVGLS联合GRACE评分(尤其是当LVGLS>-16.150%、GRACE<148.000分)可以预测AMI患者PCI术后早期发生CMD的风险,有利于临床早期监测和干预AMI患者术后微循环异常。LVGLS结合GRACE评分可早期发现心肌微循环缺血情况,临床应用价值较强[21]。
综上所述, LVGLS可以为AMI患者术后早期预测CMD提供显著的依据,联合GRACE评分可更为精准地指导AMI患者术后心血管的危险分层,以改善患者预后。

