不同种类微塑料与纳米ZnO对锦鲫复合生物效应*
杨珺亦 杨程夫 王 静 王晓琳 尹 颖
(南京大学环境学院,污染控制与资源化研究国家重点实验室,江苏 南京 210023)
微塑料(MPs)污染是近年来受到广泛关注的环境问题。随着塑料生产及应用的不断增加,越来越多的塑料垃圾被释放到环境中,经过长时间物理化学生物作用,破碎成为MPs[1],广泛分布于全球水域,甚至可在人迹罕至的北冰洋检出[2-4]。MPs可通过生物摄食进入食物链、食物网[5],拥有较强黏附性,可能形成纤维影响生物消化吸收[6],可能吸附有机物、重金属、抗生素等,除物理性损伤还存在多种毒性效应,造成严重环境健康危害[7-9]。
纳米ZnO作为典型金属纳米材料,可通过呼吸、饮食等进入人体吸收,造成健康危害[10],在水中释放Zn2+富集于生物体内产生毒性,使斑马鱼胚胎孵化率降低、产生氧化应激,阻碍鱼类繁殖和正常生长发育[11-12]。通过模型计算,部分实际水环境中纳米ZnO高达760 μg/L[13]。水体中纳米材料复合会改变其表面活性、提高稳定性[14],MPs和纳米ZnO作为微小不稳定颗粒物,同时存在可能表现出不同复合模式,造成更严重毒性效应。有研究发现,聚乙烯吡咯烷酮(PVP)与纳米Ag复合会限制Ag+还原,降低纳米Ag对小球藻和栅藻毒性[15]。暴露于MPs与Cu复合体系中的斑马鱼氧化应激水平提高、细胞凋亡失调、大脑神经回路改变,复合毒性效应显著[16-17]。MPs和纳米ZnO复合可能影响Zn的生物可利用性和纳米ZnO的毒性。
目前研究主要探索MPs的粒径、浓度及颗粒形态对生物造成的影响[18-20],关于MPs种类(化学结构)差异导致的影响、MPs和纳米材料间的相互作用及联合毒性效应机制鲜见报道。本实验以3种产量较大、应用广泛、产品多样的通用球状MPs[21]为例,参考实际水环境中纳米ZnO浓度及纳米ZnO对鱼类毒性效应相关研究[22],设置1 mg/L实验质量浓度,研究聚苯乙烯(PS)、聚氯乙烯(PVC)、聚甲基丙烯酸甲酯(PMMA)MPs与纳米ZnO对锦鲫(Carassiusauratus)的复合生物效应及作用机理,探索MPs种类差异可能存在的影响,为水环境中MPs和纳米ZnO生态风险评估提供科学依据。
1 材料与方法
1.1 实验材料
实验所用纳米ZnO((30±10) nm,99.9%)、PVC MPs(500 nm)、PMMA MPs(500 nm)均外购,PS MPs(500 nm)利用分散聚合法[23]自合成。
1.2 实验生物
锦鲫购自江苏省南京市某市场。在实验室条件下驯养两周。实验用水充分曝气,溶解氧不低于6 mg/L,水温(25±1) ℃。正常光照,每两天进行喂食与换水。驯养结束随机挑选64尾健壮锦鲫进行暴露实验。
1.3 暴露实验
根据预实验,设置8个暴露组别:空白对照组(CK组)、纳米ZnO单一组(ZnO组)、PS MPs单一组(PS组)、PVC MPs单一组(PVC组)、PMMA MPs单一组(PMMA组)、PS MPs与纳米ZnO复合组(PS+ZnO组)、PVC MPs与纳米ZnO复合组(PVC+ZnO组)、PMMA MPs与纳米ZnO复合组(PMMA+ZnO组)。3种MPs与纳米ZnO暴露质量浓度均为1 mg/L。暴露容器为42 L玻璃鱼缸,实际水量30 L。每组随机放入8尾锦鲫,分别加入提前用超声清洗仪(KH-800KDE)分散均匀的暴露母液。暴露周期为14 d,每两天进行喂食与换水。每组设4个平行处理。
1.4 MPs表征
分别采集3种MPs粉末0.1 g,使用JEM-200CX型透射电子显微镜(TEM)观察MPs颗粒形貌粒径。使用ESCALAB-250Xi型X射线光电子能谱(XPS)仪分析MPs元素组成及含量。
1.5 水合粒径及Zeta电位
分别取对应超声分散均匀的暴露液,使用NANO-ZSDLS型动态光散射粒度仪测定水体中MPs及纳米ZnO颗粒水合粒径和Zeta电位。
1.6 Zn2+释放
分别取对应暴露后水样,3 500 r/min离心10 min,取上清液过0.22 μm有机微孔滤膜,分离溶液中Zn2+,使用SLT400SF型电感耦合等离子体质谱仪测定纳米ZnO释放的Zn2+浓度。
1.7 Zn在锦鲫体内的分布与积累
取对应暴露后锦鲫,依次剖出性腺、肠道、鳃、眼、脑,取适量鱼肉,45 ℃烘干,分别称重,消解,2%(体积分数)硝酸定容,过0.22 μm有机微孔滤膜。使用电感耦合等离子体质谱仪测定各组织中Zn含量。
1.8 锦鲫肝脏氧化损伤
取对应暴露后锦鲫肝脏称重,加入0.9%(质量分数)生理盐水制成10%(质量分数)肝脏匀浆,3 000 r/min离心10 min,取上清液。按照试剂盒(南京建成生物工程研究所)所述试验方法测定超氧化物歧化酶(SOD)、丙二醛(MDA)、活性氧(ROS)活性,评价锦鲫肝脏氧化损伤。
1.9 数据处理
使用SPSS 21.0进行统计分析。组间比较采用单因素方差分析,p<0.05认为存在显著性差异。图表利用Excel 2019及Origin 2022绘制。
2 结果与讨论
2.1 MPs表征
由图1可见,3种MPs颗粒均呈尺寸均一、光滑的圆球状,平均粒径约500 nm,无明显黏附变形现象,单一球状颗粒较完整,MPs种类差异在其颗粒形态上无明显体现。环境中普遍存在的MPs形态包括球状、颗粒状、纤维状等[24],不同形态的MPs表面性质、晶体结构、细胞摄入、毒性效应等不同[25]。相同暴露条件下,球状PS MPs可能由于其光滑表面和在溶液中较分散的颗粒形态,相较于纤维状和碎片状颗粒更易被生物摄食且难以消化,对生物产生毒性效应[26]。

图1 3种MPs的TEM表征
XPS表面元素扫描结果显示,3种MPs表面元素含量不同(见表1)。C在3种MPs表面均最大,超过70%;PVC MPs表面含Cl,含量介于C和O之间;PMMA MPs表面O较高,达到28.38%。由图2可见,3种MPs化学结构不同,PS MPs分子中含苯环,PMMA MPs分子中有酯基存在。不同MPs表面性质存在差异,可能对其分子极性、水合粒径、吸附能力及颗粒分散体系稳定性产生影响。PS MPs表面C-H键会断裂与O反应生成过氧自由基,过氧自由基还原为羧基,含氧基团增加,更易与金属络合[27]。PVC MPs结构中Cl可能氧化进入含氧官能团,分子极性较大,热稳定性较差,能通过静电作用吸附有机物、重金属等[28]。PMMA MPs本身含氧量较高,易形成氢键,分子极性较大[29]。

表1 3种MPs的XPS表面元素扫描结果

图2 3种MPs化学结构式
2.2 水合粒径
不同组别水体中颗粒水合粒径见图3。水体中PS MPs水合粒径最小,PMMA组MPs水合粒径最大,MPs颗粒间相互团聚[30],尺寸远大于实际粒径。PMMA+ZnO组MPs水合粒径显著减小,但仍显著大于PS+ZnO、PVC+ZnO组。与PMMA MPs共存时,颗粒团聚效应增强,纳米ZnO水合粒径显著增大,与PS、PVC MPs共存无显著影响。
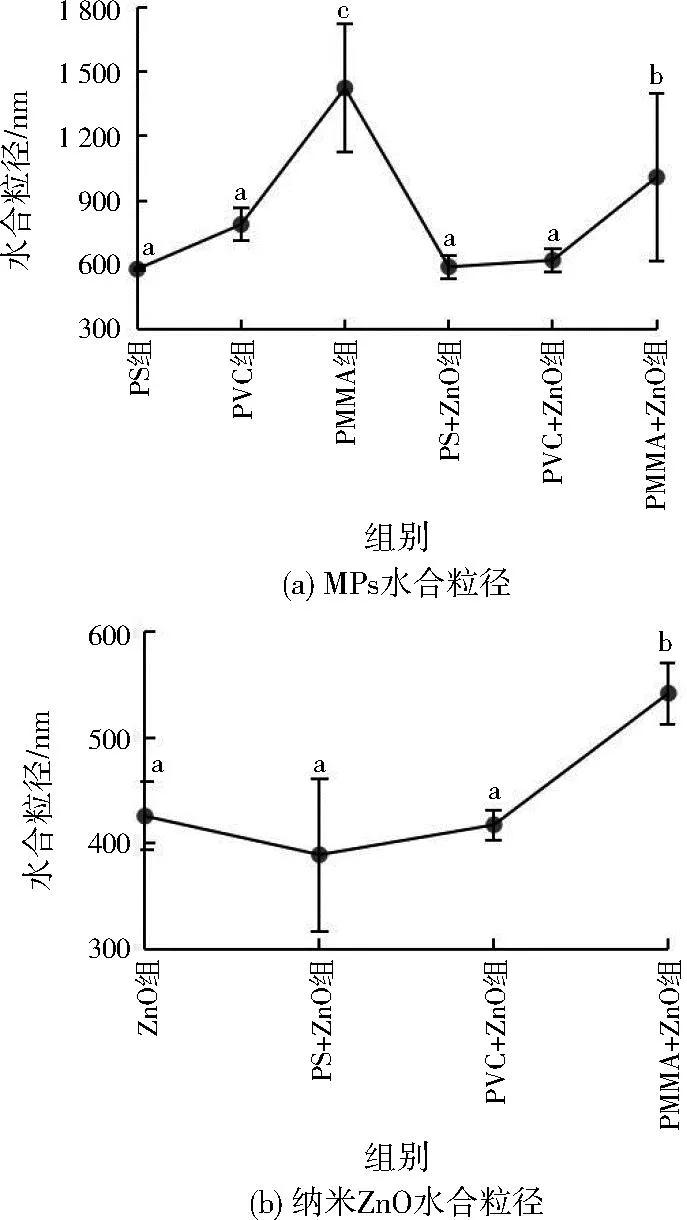
注:组间不同小写字母表示差异显著,图4至图7同。
PS MPs表面负电荷较强,颗粒间静电排斥力较大,不易聚集,水合粒径较小且易保持恒定[31],不受纳米ZnO复合影响。周欣[32]26测定发现,粒径为50 μm的PMMA MPs相较PS MPs亲水性更强、等电点更大。分子极性较强的PMMA MPs易形成氢键团聚,水合粒径较大。纳米ZnO与PMMA MPs复合后被含氧基团络合,团聚在PMMA MPs表面,纳米ZnO水合粒径增大[33]。
2.3 Zeta电位
各组溶液Zeta电位均为负值。单一MPs体系Zeta电位绝对值较ZnO组显著提高(见图4)。PVC MPs单一与复合体系Zeta电位绝对值最大,均超过30 mV,与PVC MPs分子含Cl表面带负电有关。PS、PMMA MPs与纳米ZnO复合后Zeta电位绝对值显著降低,分别由28.43、24.57 mV变为22.43、20.87 mV。与单一纳米ZnO相比,添加3种MPs均会使Zeta电位绝对值显著上升,与PVC MPs复合效应最显著。
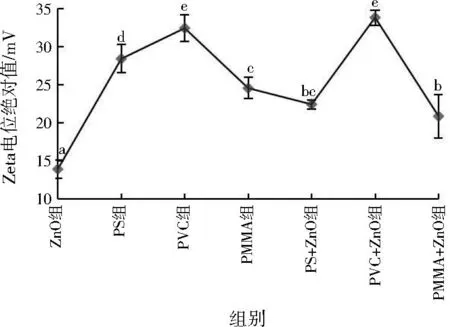
图4 不同组别Zeta电位绝对值
Zeta电位可体现物质表面带电情况,反应胶体体系稳定性,Zeta电位绝对值越大,胶体颗粒间排斥力越大,胶体体系稳定性越强[34]。各组Zeta电位均为负值,反应纳米ZnO及MPs表面均带负电。ZnO组Zeta电位绝对值最小,说明纳米ZnO颗粒间排斥力较小,最易团聚,体系不稳定。研究发现,在颗粒间静电作用下,纳米Fe3O4会附着在PS MPs表面形成明显核壳结构,颗粒间斥能增大,体系稳定性增强[35]。纳米ZnO与MPs复合同样表现为Zeta电位绝对值增大,体系稳定性增强。PMMA MPs相较其他两种MPs含氧量高、分子极性大、团聚效应显著[32]26,理论上Zeta电位绝对值大、体系稳定性强,然而实际测定PMMA MPs单一及复合组Zeta电位绝对值相对较小,与理论情况相反,具体需对溶液中PMMA MPs表面理化特性进行测定。与纳米ZnO复合后,PS、PMMA MPs的Zeta电位绝对值减小,体系稳定性下降,可能由于纳米ZnO取代了MPs表面带电物质,诱导聚集于MPs表面,改变了颗粒间斥力[36]。分子表面自身带负电基团的PVC MPs与纳米ZnO复合前后Zeta电位绝对值较大,受到复合影响较小,溶液稳定性较强。
2.4 Zn2+释放
不同组别水体中Zn2+质量浓度见图5。纳米ZnO的Zn2+释放率为39.79%,与PS、PVC、PMMA MPs复合后Zn2+释放率分别为51.84%、46.97%、47.42%,均显著升高,PS+ZnO组Zn2+释放率较PVC+ZnO、PMMA+ZnO组显著提高。3种MPs均可促进纳米ZnO释放Zn2+,PS MPs促进作用最强。
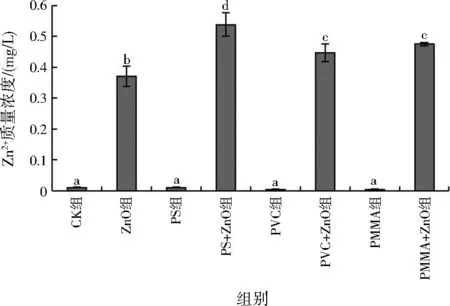
图5 不同组别水体中Zn2+质量浓度
研究发现,纳米ZnO与纳米TiO2复合,物质表面会形成配合物,表面电荷及颗粒间静电作用改变,Zn2+释放增多[37]。纳米ZnO同样会附着于MPs表面形成配合物,改变颗粒表面电荷及颗粒间静电作用,导致MPs复合促进纳米ZnO释放Zn2+。PS MPs可能由于分子中含苯环,得电子能力较强[38],更易吸附纳米ZnO形成配合物,对Zn2+释放的促进作用最强。后续可进一步研究3种MPs对Zn2+的吸附行为解释MPs促进Zn2+释放的内在机制。
2.5 Zn在锦鲫体内的分布与积累
不同组别锦鲫各组织中Zn分布情况如图6所示。脑部是Zn富集量最低的组织,与CK组相比,添加纳米ZnO后脑部Zn均无显著增加,说明纳米ZnO及其释放的Zn2+无法单独或经MPs诱导或负载进入脑部。眼部、鱼肉、性腺和肠道中,ZnO组均出现Zn含量升高现象,其中肠道组织中Zn最高。与ZnO组相比,PS+ZnO组显著增加了鱼肉和鳃部中Zn含量;PVC+ZnO组显著增加了肠道中Zn含量;MPs复合降低了Zn在性腺的积累,可能减轻纳米ZnO对鱼类子代的危害。整体来看,暴露于纳米ZnO会导致鱼体不同组织产生Zn累积,MPs复合会影响这种累积,且影响程度因MPs种类和Zn积累组织部位的不同而异。

图6 不同组别锦鲫各组织中Zn分布情况
有关纳米CuO在鲤鱼体内分布情况及毒性效应的研究发现,鲤鱼脑部存在血脑屏障阻碍金属进入[39],与本实验锦鲫脑部Zn含量较低测定结果相符,说明锦鲫脑部有类似阻碍金属进入的血脑屏障。与PS+ZnO组鱼肉和鳃部中Zn含量增加,可能与复合体系中Zn2+释放量增大有关,Zn2+经PS MPs负载进入鱼肉和鳃部富集。已有研究发现,Zn在雄性中华绒螯蟹性腺内参与多项酶催化过程及生理生化反应,转化消除率较大[40]。同时,BURGOS等[41]
证实,聚集的纳米颗粒水合粒径较大,不利于细胞吸收。纳米ZnO与MPs复合后颗粒团聚作用增强,水合粒径增大,Zn的细胞吸收率下降。纳米ZnO与MPs复合暴露时性腺中Zn的消除率大于吸收率导致Zn累积量下降。摄食作为水生生物最主要的摄入颗粒物途径[42],导致肠道中大量富集Zn。在60~310 nm的单分散纳米Fe3O4暴露体系中发现,较小的纳米颗粒更易穿透肿瘤细胞膜,但较大的纳米颗粒在细胞中积累量反而更大,可能由于粒径过小的纳米颗粒易被细胞转化消除[43]。PMMA+ZnO组纳米ZnO水合粒径最大,但锦鲫肠道中Zn富集量较小,可能由于颗粒物过大,Zn难以被PMMA MPs负载进入细胞。PVC+ZnO组体系较稳定,纳米ZnO水合粒径较大,纳米ZnO与PVC MPs复合易被细胞内化富集且较难被细胞转化消除,肠道中Zn含量增加。整体来看,由于PS MPs分子极性大、表面静电作用强、体系稳定性差,复合体系中Zn2+含量最高,锦鲫的眼部、鳃部、鱼肉中Zn富集相应增加。
2.6 锦鲫肝脏氧化损伤
锦鲫肝脏组织中氧化应激酶活性见图7。与CK组比较,纳米ZnO表现出对SOD的应激诱导作用,而PS、PVC MPs则显著降低了SOD活性;PS+ZnO组SOD活性显著上升;PMMA MPs单一和复合组SOD活性与CK组均没有显著差异,但比ZnO组显著下降。

图7 锦鲫肝脏组织中氧化应激酶活性
与MPs单独暴露相比,复合均显著增加MDA活性。与CK或ZnO组相比,复合后MDA活性没有显著差异。
与CK或ZnO组相比,PS、PMMA MPs单一与复合组ROS活性均显著上升。3种MPs单一与复合组间ROS活性均无显著差异。不同MPs种类对其单一或与纳米ZnO复合造成的生物氧化应激系统响应存在差异。整体来看,纳米ZnO对鲫鱼肝脏抗氧化系统产生效应大于MPs,与PS MPs复合对纳米ZnO造成的锦鲫肝脏氧化损伤影响更大。
暴露于8 mg/L纳米ZnO的罗非鱼肝细胞出现严重充血、坏死、凋亡症状,尤其通过喂食暴露时纳米ZnO显著改变肝脏组织结构,产生严重毒性效应[44],本实验纳米ZnO浓度较低,同样对鲫鱼肝脏产生生物效应。高之茵[45]在研究PS MPs与纳米CuO对青岛大扁藻的联合毒性机制时提出,MPs对金属离子的吸附及对纳米氧化物颗粒的异质聚集可能改变两者联合毒性。PS MPs与纳米ZnO复合后,Zeta电位绝对值下降,溶液稳定性较差,Zn2+释放增强,纳米ZnO与Zn2+同时产生毒性效应。已有研究证实,与0.1、3 μm的PS MPs复合均会增强纳米ZnO对大型蚤氧化应激效应[46]。与本实验结论相符,MPs与纳米ZnO复合对锦鲫肝脏氧化应激产生显著影响,对锦鲫氧化损伤增强。
3 结 论
500 nm的3种球状MPs化学结构与表面元素含量不同,含量最高的元素是C和O,PS MPs表面C高达93.07%,PMMA MPs表面含O 28.38%,PVC MPs表面含Cl 18.39%。PMMA MPs单一与复合体系中颗粒水合粒径最大,Zeta电位绝对值较小,体系不稳定。PVC MPs单一与复合体系中Zeta电位绝对值最大,体系稳定。纳米ZnO溶液Zeta电位绝对值最小,颗粒物更易团聚,与MPs复合后Zeta电位绝对值均显著增大,溶液稳定性增强。MPs促进纳米ZnO释放Zn2+,PS MPs复合体系中Zn2+含量最高。锦鲫脑部中Zn含量较低,眼部、鳃部、鱼肉中Zn含量较高,肠道中更易富集Zn,性腺中MPs与纳米ZnO复合后Zn含量降低。MPs单一暴露未对锦鲫肝脏产生氧化损伤,纳米ZnO暴露产生氧化损伤,与PS MPs复合总体显示损伤作用加剧。分子极性大、表面静电作用强、团聚效应显著、体系稳定性差的MPs与纳米ZnO复合易改变物质表面性质,促进纳米ZnO释放Zn2+,增强对锦鲫毒性效应。

