黄河内蒙段开河期细菌群落结构特征研究
史玉娇,李文宝,2*,郭 鑫(.内蒙古农业大学水资源利用与保护自治区重点实验室,内蒙古 呼和浩特 0008;2.黄河流域内蒙段水资源与水环境综合治理协同创新中心,内蒙古 呼和浩特 0008)
细菌作为生态系统的重要组成部分,广泛存在于水体和土壤中[1].它们参与物质和能量循环,在生物多样性演替过程中起着关键作用,且不同属种细菌相对丰度及群落生态功能特征的变化是水文循环、水质变化、生态系统演化及不同介质交互过程的重要响应指标之一[2].通常,河流中的细菌会随着水流的运动而向其他区域扩散,从而重塑河流生态系统中微生态结构,而土壤和沉积物中的细菌则通过与水体之间的交互作用或同化等生物活动来响应水文循环过程发生的改变[3].作为具有显著不同理化性质的介质,水-土中微生物类型差异明显.例如尤本胜等人主要分析了太湖水-土生境中细菌群落组成和结构的差异[4],王丹丹等[5]主要对青藏高原中东部湖泊水-土生境中细菌群落构建过程的差异进行了探究.
黄河内蒙段地处河套灌区,属农牧交错带[6-7],由于其特殊的地理位置,河流在12 月上旬封河和翌年3 月中下旬解冻开河.伴随河冰消融,河水动力条件也随之改变[8].与未解封的河流相比,解封后水体流速的加快使凹岸受到较强的冲刷作用,而凸岸则存在更多的沉淀物,进而改变河岸水、土介质的交互模式,对细菌群落结构产生影响.目前,关于黄河水体、土壤和沉积物中细菌群落的研究,已经取得了丰硕的研究成果.例如有研究者探索了黄河水体和土壤中微生物群落结构及演替规律[6-7],但是整体上从微生态的角度对黄河内蒙段开河期凹凸岸水体及土壤中微生物异同性及交互模式的研究相对薄弱,尤其是细菌群落的空间关联性及关键物种的厘定还不够清晰.
本文选取黄河内蒙段开河初期(4 月中旬),在受流速影响差异明显的凹、凸岸分别开展水、土样品的取样,利用高通量测序技术,分析了菌门及菌属水平上黄河内蒙段凹、凸岸水、土介质中细菌群落组成特征,结合空间网络结构分析,对水、土中的共有、独有及显著差异物种进行了筛选,同时厘定维持网络稳定的关键物种,旨在阐明水、土介质中细菌群落结构变化和生态过程对于维持黄河内蒙段开河期生态系统生物多样性和稳定性的意义,为以细菌群落为指示生物进行河流生态评价提供参考.
1 材料与方法
1.1 研究区概况
内蒙古黄河流域位于自治区中西部,自宁夏石嘴山入境到准格尔旗出境,河长约843.5km.由于受到中温带大陆性季风气候的控制,黄河内蒙段呈现出区域降水量小、蒸发量大的特点.根据气象资料显示,黄河内蒙段气温呈现出周期性变化规律,多年平均气温约为9℃,降水量150~450mm/a,且多集中于7~9 月份,多年平均蒸发量为2611.68mm/a,最高值出现在5~8 月.河流大约于每年11 月份开始流凌,翌年1月份冰封全部完成,而3月中下旬开始开河.由于其特殊的地理位置,它不仅是当地灌区退水的重要排泄通道,也是周边城市工业和生活用水的水源地[9-11].因此,本文选取黄河内蒙段的托克托县段为对象,该段河流上游与重工业城市包头市衔接,下游与万家寨水库相连,在区域生态环境及农业生产方面起着关键作用(图1).

图1 黄河内蒙段位置和采样点分布示意Fig.1 Yellow River Inner Mongolia section location and sampling point distribution schematic
1.2 样品采集
黄河内蒙古托克托县段地处上中游分界点,河身迂回曲折.特别是河流解封初期,水流速度的加快会使凹岸土壤被冲刷,而河流弯曲处水流速度减慢,使凸岸土壤沉淀下来.因此根据河道特征,共布设6个取样点(土壤样品为河漫滩土样),由西到东,水样依次命名为S-1、S-2、S-3、S-4、S-5 和S-6,土样依次命名为T-1、T-2、T-3 和T-4(图1),于2021年4 月中旬完成水样和土样的采集工作.收集样品方法:利用取土钻和取水器分别对土样和水样进行采集,土样直接装入冻存管并放入干冰桶中,水样采集完成后装入1L 聚乙烯瓶中,并带回实验室进行过滤.其中,水样首先通过5μm 的水滤膜进行过滤[12],再将5μm 过滤后的水样经过0.22μm 的水滤膜进行过滤来收集浮游细菌,将过滤得到滤膜立即放入干冰桶中,用于后续DNA 提取和PCR 扩增[13].
1.3 DNA 抽提和PCR 扩增
根据E.Z.N.A.® soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)说明书进行微生物群落总DNA抽提.首先使用1%的琼脂糖凝胶电泳检测DNA 的提取质量,再使用338F(5’-ACTCCTACGGGAGGCAGCAG -3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA 基因V3-V4 可变区进行PCR 扩增,扩增程序如下:95℃预变性3min,27 个循环(95℃变性30s,55℃退火30s,72℃延伸30s),然后72℃稳定延伸10min,最后在4℃进行保存.
1.4 测序及数据处理
利用 2%琼脂糖凝胶电泳进行检测,并用Quantus™ Fluorometer(Promega,USA)对回收产物进行检测定量,同时使用NEXTFLEX Rapid DNASeq Kit 进行建库,得到原始数据.进一步使用fastp 和FLASH 对原始测序序列进行质控和拼接[14-15],过滤掉reads 尾部质量值低于20 的碱基,并根据PE reads之间的overlap 关系,将成对reads 拼接成一条序列,并根据序列首尾两端的barcode 来调整序列方向,最终使用UPARSE 和RDP classifier 软件对OTU 和每条序列进行聚类以及物种分类注释[16-17],比对Silva 16S rRNA 数据库,设置比对阈值为70%.
对OTU 进行优化聚类处理后,利用mothur 计算Ace 指数、Shannoneven 指数和Shannon 指数;利用R 语言进行群落组成、PCoA 和LefSe 分析;利用Cytoscape 绘制水、土介质中细菌群落在菌属水平的网络共现性;利用Gephi 绘制水、土样细菌生态网络结构.
2 结果与分析
2.1 水、土中细菌群落α 多样性对比
为了解黄河内蒙段细菌群落在水、土中的组成,对序列进行质控和筛选后,共获得1155457 条序列,OTU 水平上水样及土样细菌群落覆盖度均达到95%以上(水样均值约为 99.77%,土样均值约为97.07%),表明本次实验可以反映细菌群落的真实情况(图2),同时在97%的相似水平下对序列进行聚类[16],计算α 多样性中反映群落丰富度的Ace 指数、均匀度的Shannoneven 指数和多样性的Shannon 指数[18-19],分析了水、土中细菌群落的结构特征.
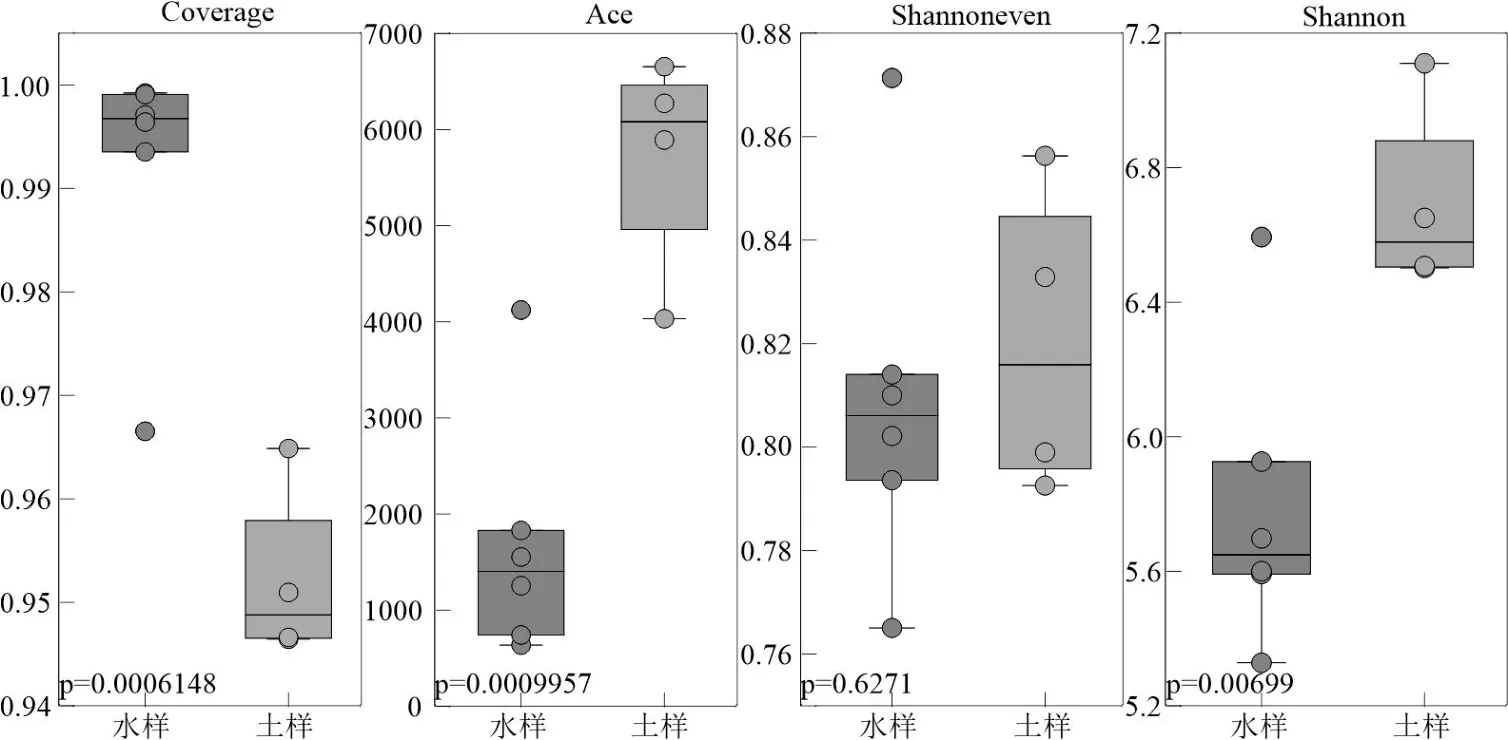
图2 水、土样中细菌群落α 多样性指数Fig.2 Bacterial community alpha diversity index in water and soil
结合α 多样性分析发现,在水样中,反应细菌群落丰富度的平均Ace 和Shannoneven 丰度指数分别为1690 和0.806,在土样中则为5699.5 和0.807,且水样中群落丰富度均显著低于土样(P<0.01);水样中Shannon 指数的均值为5.804,同样低于土样(6.728),同时二者多样性存在显著的组间差异,这表明土样细菌群落多样性较水样更加丰富(图2).进一步,不同样本类型取样点指数的空间变化幅度也并不一致,水样各取样点的 Ace 指数(641.77~4067.39)、Shannoneven 指数(0.76~0.87)及Shannon 指数(5.35~6.63)空间变化幅度要高于土样中的 Ace 指数(4300.85~6295.96)、Shannoneven 指数(0.78~0.85)及Shannon 指数(6.56~7.14).因此,黄河内蒙段水样中细菌群落空间分布差异性较土样中更高(图2).
2.2 水、土介质中细菌群落结构差异
细菌作为生态系统中的重要组成部分,驱动和响应元素的形态转换,参与地球化学循环,其细菌门类的组成及相对丰度可以作为指示环境的指标[20].为探究黄河内蒙段水-土介质中细菌群落在门及属水平上的组成情况,在分析对比细菌α 多样性的基础上,进一步探索了细菌群落相对丰度的变化(将平均相对丰度小于1%的统称为others).
在门水平上,虽然Proteobacteria(变形菌门)、Actinobacteria(放线菌门)、Bacteroidetes(拟杆菌门)、Chloroflexi(绿弯菌门)、Acidobacteriota(酸杆菌门)、Cyanobacteria(蓝细菌门)和Firmicutes(厚壁菌门)等是水中的优势细菌门类(图3(a)),但各优势细菌门类的相对丰度存在显著差异.其中变形菌门的相对丰度在水体中占有绝对优势,约为29.63%~43.51%,高于放线菌门(19.32%~27.67%)和拟杆菌门(7.47%~12.59%)在水体中的比例.特别地,凹岸取样点(S-1和S-2)中变形菌门的相对丰度明显低于凸岸取样点(S-4 和S-5),而拟杆菌门的相对丰度在凹岸要高于凸岸.在土样中,最优势细菌门为变形菌门,相对丰度约为16.26%~34.52%,在T-1 和T-3 取样点中的相对丰度远高于其他取样点;其次分别为酸杆菌门(8.91%~22.32%)和绿弯菌门(9.42%~18.92%),二者的相对丰度差异并不明显(图3(a),(b)).
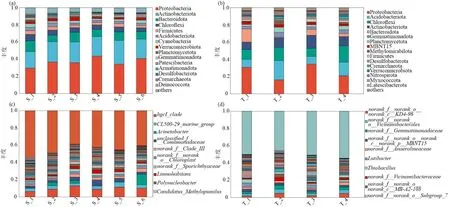
图3 水、土样中细菌群落结构组成Fig.3 Comparison in bacterial community structure between water and soil
在属水平上,水样和土样中优势菌属结构差异显著.如hgcI_clade(归属于放线菌门)在水样中的相对丰度最高(约为6.19%~12.75%),远高于CL500-29_marine_group(归属于酸杆菌门,约为 2.97%~5.05%)和 Acinetobacter(归属于变形菌门,约为0.74%~12.24%)的相对丰度(图3(c)).在土样中,优势菌属主要包括 norank_f__norank_o__norank_c__KD4-96(归属于绿弯菌门)、norank_f__norank_o__Vicinamibacterales(归属于酸杆菌门)和norank_f__Gemmatimonadaceae(归属于Gemmatimonadota(芽单胞菌门)),其相对丰度约为 1.95%~4.91%、2.35%~4.67%和2.20%~4.73%(图3d).相较于其他取样点,上述3类优势菌属的相对丰度均在T-2取样点中最高.
2.3 细菌群落共现性及差异物种分析
采用PCoA 分析对水样与土样各采样点浮游细菌群落结构进行聚类,探索了不同生境分组样本间群落组成的差异性,结果如图4(a).黄河内蒙段细菌群落共有90.69%被解释,其中PCoA1 轴的解释度为81.68%,PCoA2 轴的解释度为9.01%.不同样本中细菌群落结构分布情况呈现明显的分离模式,土样中细菌群落的分布较水体中更为分散.同时,ANOSIM统计检验结果进一步显示了水、土样中细菌群落结构之间的差异性(r=0.845,P=0.003).
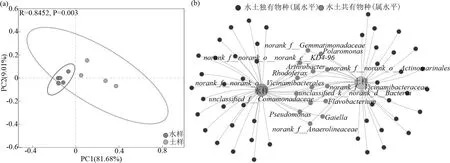
图4 水、土样中细菌群落空间分布及共现性分析Fig.4 Spatial distribution and co-occurrence analysis of bacterial communities in water and soil
为分析水-土细菌群落结构特征,对二者的优势菌属进行了网络构建,从共存关系角度上对不同介质中细菌群落结构的差异进行了探讨[21].相对丰度超过500 的细菌菌属在水-土网络结构中共得到62个,其中水样独有的菌属为25 个,土样独有的菌属为23 个,水-土样品共有的菌属为14 个(图4(b)).水、土样共有的菌属主要归属于6 大细菌门类,其中归属于变形菌门的菌属数量最丰富,主要包括Polaromonas、Rhodoferax 和Pseudomonas,归属于放线菌门的菌属数量次之,主要包括Arthrobacter 和Gaiella. 对于其他优势菌属如 norank_f__Vicinamibacteraceae 归 属 于 酸 杆 菌 门 、Flavobacterium 归属于拟杆菌门等.通过分析共有属的相对丰度信息得知,在水、土样品共有的菌属中,unclassified_f__Comamonadaceae(归属于变形菌门)是第一大优势菌属,主要存在于水样中.相反,Gaiella 和norank_f__norank_o__ Actinomarinales(归属于放线菌门)在共有菌属中相对丰度最低,且主要存在于土样中.
为寻找水样与土样中具有显著差异性的物种,利用LEfSe 分析,设置线性回归LDA 指数为4.0,估算出每个物种的相对丰度对不同类型样本差异性影响的程度.水样与土样中具有显著差异性的物种包括7 个门,9 个纲,10 个目,13 个科,13 个属.在门水平上,放线菌门、蓝细菌门、酸杆菌门、MBNT15、芽单胞菌门和绿弯菌门是水样和土样中的显著差异物种,其中放线菌门和蓝细菌门在水样中的相对丰度显著高于土样,而酸杆菌门、MBNT15、芽单胞菌门和绿弯菌门在土样中的相对丰度显著高于水样;在属水平上, CL500- 29_marine_group 、hgcI_clade 和norank_f__ Sporichthyaceae 等在水样中的相对丰度显著高于土样, 而 norank_f__norank_o__Vicinamibacterales 和 norank_f__Gemmatimonadaceae 等在土样中的相对丰度显著高于水样(图5(a)).判别结果显示水样中hgcI_clade 和CL500-29_marine_group、以及土样中 norank_f__norank_o__Vicinamibacterales 和 norank_f__norank_o__norank_c__KD4-96 的LDA 指数较高,这表明上述菌属是造成水样与土样中优势细菌门类存在显著差异的关键因素(图5(b)).
2.4 水、土介质中细菌群落生态网络结构
基于相对丰度前 100 的优势菌属,采用spearman 分析方法(相关系数绝对值≥0.5,P<0.05),构建了不同生境中浮游细菌的生态网络结构.结果显示,水样浮游细菌网络结构共由397 条边组成,图密度为0.082,模块化指数为0.610;土样浮游细菌网络结构共由594 条边组成,图密度为0.130,模块化指数为0.710.在水样中,浮游细菌菌属间的互作模式以拮抗关系为主(负相关关系占比为52.64%),而土样中浮游细菌菌属间的互作模式以协作关系为主(正相关关系占比为 60.61%)(图6(a),(b),表1).
通过对细菌网络结构进行划分,水体细菌网络结构主要被分为5 个模块,各模块的占比分别为25.25%(模块1)、24.24%(模块2)、21.21%(模块3)、15.15%(模块4)和14.14%(模块5),且不同模块的网络结构均主要由归属于放线菌门和拟杆菌门的优势菌属主导.土样细菌网络结构主要被分为8 个模块,各模块的占比分别为25.00%(模块1)、14.71%(模块2)、11.46%(模块3)、10.42%(模块4)、9.38%(模块5)、7.29%(模块6)、6.25%(模块7)和4.17%(模块8)(图 6(b)),不同模块中维持网络结构的细菌类群并不一致,模块1 是土样细菌网络结构中最大的模块,主导该模块的细菌属类主要归属于变形菌门和Planctomycetota(扁平霉菌),对于其他模块,如模块2中网络结构主要由归属于酸杆菌门的优势菌属主导,模块3 中网络结构主要由归属于绿弯菌门的优势菌属主导等(图6(c),(d)).

图6 水、土细菌群落生态网络结构Fig.6 Ecological network structure of bacterial community between water and soil
水-土生态网络结构中的细菌门类主要包括10门,在水样中变形菌门、放线菌门和拟杆菌门分布广泛,而土样中变形菌门、绿弯菌门和酸杆菌门的分布较为广泛,上述优势菌门在水、土样网络结构中的总体占比均达到所有节点的50%以上,其中变形菌门无论在水体还是土样网络结构中的占比均最高.此外,为进一步分析水、土介质网络结构中菌属对于维持网络结构稳定的重要性,利用度数值对各优势菌属在网络结构中的重要性进行了量化.结果显示,变形菌门的 Delftia 、 Escherichia-Shigella 和Candidatus_Methylopumilus, 放 线 菌 门 的Marmoricola 和Arthrobacter,酸杆菌门的Rb41,以及Crenarchaeota( 泉 古 菌 门 ) 的 Candidatus_Nitrocosmicus 度数值在水体网络结构中较高,相对地,变形菌门的Rhodoferax、Ellin6067、MND1 和Thiobacillus 、 拟杆菌门的 Flavobacterium 和Lutibacter,以及放线菌门的Arthrobacter 度数值在土样网络结构中较高(图6(a),(b)).
从各优势菌属所位于的模块位置来看,水样中Delftia 和Escherichia-Shigella 是维持模块2 网络结构稳定的关键菌属,其他关键菌属如Candidatus_Methylopumilu、Marmoricola 和Arthrobacter 等主要存在于模块3 中;土样中关键菌属的分布较为分散,其中Rhodoferax 主要位于模块6、Ellin6067、MND1和Thiobacillus 主要位于模块4、Lutibacter 主要位于模块1,以及Arthrobacter 主要位于模块7(图6).
3 讨论
黄河内蒙段是黄河最北端,受夏冬季节交替影响明显,冬季出现河面冰封现象,直至3 月底或4 月初冰体才能全部融化.解封后的河流通畅且流速相对增加[22],这将对河流细菌群落具有一定的扰动作用,导致河岸水-土中的细菌群落结构和空间网络特征发生显著变化.
3.1 开河初期水、土介质中细菌群落结构特征分析
由于属性差异,水-土介质中的优势细菌门类存在一定差异.例如,张雨晴等[23]研究发现河流中优势细菌门类主要为变形菌门、拟杆菌门和放线菌门,而土样中优势细菌门主要为绿弯菌门,这与黄河内蒙段水、土介质中优势菌门结构具有一定程度的相似性(图 3(a),(b)).具体来看,在黄河内蒙段,虽然变形菌门、放线菌门、拟杆菌门、绿弯菌门、酸杆菌门、蓝细菌门、厚壁菌门、疣微菌门、扁平霉菌、芽单胞菌门均广泛存在于水、土介质中,但在不同类型的样品中优势细菌门类的相对丰度出现明显变化.如河水中放线菌门的相对丰度明显高于土样,这可能是因为放线菌门的体积较小,不易附着于颗粒物表面且更适宜在水体中营浮游生活[24];再如土中的优势细菌门类泉古菌门、Methylomirabilota(甲基微菌门)、Myxococcota(粘球菌门)和Nitrospirota(硝化菌门)的相对丰度超过了1.00%,明显高于水样中的相对丰度,而水中优势细菌门类蓝细菌门的相对丰度在土中则显著下降(图3(a),(b)).蓝细菌门作为黄河内蒙段河水中优势细菌门类,但其相对丰度远低于湖泊水中相对丰度[25];变形菌门被认为是颗粒降解物,该细菌门类下的很多菌属具有多样化的代谢途径,能够加快污染物的降解能力,这是变形菌门成为黄河内蒙段第一大优势细菌门类,且近几年相对丰度并未发生明显变化的重要原因[26].与水相比,土中的细菌群落具有较强的竞争优势,且细菌群落丰富度、均匀度和多样性均高于河水,一种可能的解释是土中营养成分较水体更高,且土拥有更为稳定的内环境和较高的生境异质性,可以提供更丰富的生境类型和多样化生物物种,以此来支持更高的细菌群落多样性[27](图2).
河流解封初期水动力条件的改变对凹岸和凸岸细菌群落结构和多样性造成影响.例如河水中前3大优势菌属的相对丰度均呈现出凹岸低于凸岸的趋势(如凹岸中 hgcI_clade 和 CL500-29_marine_group 的相对丰度分别为7.56%和3.85%,凸岸中则升高为10.05%和4.62%),但在土样中,前三大优势菌属不仅在凹凸岸发生了更替,而且凹岸优势菌属的相对丰度显著高于凸岸(如凹岸中优势菌属Flavobacterium 和Thiobacillus 的相对丰度分别为6.65%和4.38%;凸岸中优势菌属更替为Rhodoferax和Arthrobacter,相对丰度分别为4.50%和3.18%))(图7).多样性分析结果显示,凹岸水样中细菌群落α多样性指数均高于凸岸的趋势;对于土样中,虽然细菌群落α 多样性指数的变化并不显著,但整体上由凹岸至凸岸也表现出一定的降低趋势(表2),这进一步说明了开河期水流对河岸的冲刷作用造成了细菌群落在空间尺度上的明显差异.

表2 凹岸与凸岸水、土样中细菌群落多样性的变化Table 2 Changes in bacterial community diversity in soil and water samples from concave and convex banks

图7 凹凸岸水、土介质中细菌群落结构变化Fig.7 Structural changes of bacterial communities in soil and water media of concave and convex banks
3.2 水、土介质中细菌群落生态网络结构特征
生态网络分析可以有效表征不同生物之间的直接或间接相互作用.水及土介质中细菌群落的生态网络结构特征表明土样中细菌群落网络结构比水样中的连接更紧密,这表明土样细菌生态网络是一个更高效的系统,在能量、物质和信息传输方面速度更快(图6,表2).网络模块代表着生态系统之间相互作用和生态位共享,且高模块化可能会增加生态系统的稳定性,但拓扑化分析结果显示,水样细菌生态网络结构中的模块化系数较土样更低,这表明该生境中水体细菌群落抵御外界环境干扰的稳定性较弱.平均路径长度作为衡量网络中各菌属之间信息交换速度的重要指标,其数值越小,代表该网络对应的生物群落对环境变化的响应速度越快,因此土样细菌群落生态网络结构较水样更加敏感.此外,生物之间的相互作用主要被解释为生物物种之间的协作或拮抗关系,本研究中土样生态网络结构主要以正相关关系为主,这说明土样细菌群落对环境的适应力更强,由生境类型导致的优势种对环境具有较强的适应能力,在维持群落稳定方面发挥着重要作用[27](表1).
水、土样由于外界环境和水动力条件等原因导致细菌群落间进行频繁的物质能量交换来应对环境的改变,其相互之间的联系也较为密切.具体来看,虽然黄河内蒙段的优势细菌门类(如变形菌门、拟杆菌门、扁平霉菌和放线菌门)在水、土网络结构中均占有主导地位,但各优势菌门在不同样品和不同模块的占比存在差异(图6).水样中网络结构的各模块均主要是放细菌门和拟杆菌门主导,而土样中关键模块主要为模块1、模块2 以及模块3,不同模块的生态功能可能存在差异,其中由变形菌门和扁平菌门主导的模块1 可能主要以降解有机物为主、酸杆菌门主导的模块2 可能以植物残体降解为主[21,28],而绿弯菌门主导的模块3 可能根据外界条件的变化切换营养代谢方式以此来适应不稳定的环境[29].此外,生存环境的改变对细菌生态网络结构中关键菌属的互作模式存在影响.水样中度数值较高的菌属主要分布在同一模块(模块2),且该模块在生态网络结构中的占比较高,这说明Candidatus_Methylopumilus、Marmoricola、Arthrobacter、Rb41 和Candidatus_Nitrocosmicus 等相互关系及生态功能较为相似,由它们主导的模块3 是维持整个水样生态网络结构稳定的最关键模块(图6);相反,土样中度数值较高的菌属主要分布于不同模块,其相互关系和生态功能也存在着一定差异.
4 结论
4.1 虽然黄河内蒙段水体及河漫滩土样细菌群落的空间分布存在显著差异,土样细菌群落多样性较河水更丰富,但二者的细菌群落组成存在相似性,其中优势细菌门类主要包括变形菌门、酸杆菌门和放线菌门等,优势菌属主要包括hgcI_clade、CL500-29_marine_group、norank_f__norank_o__norank_c__KD4-96 和norank_f__norank_o__Vicinamibacterales等;再者,开河初期水动力条件的改变也是影响细菌分布的关键因素,与整体河段相比,水体中细菌群落在凹凸岸的差异性仅表现在相对丰度上,而土样中凹凸岸优势细菌群落种类发生了更替.
4.2 共现网络分析表明,水-土网络结构中细菌群落的交互作用主要由归属于变形菌门(Polaromonas、Rhodoferax 和 Pseudomonas) 和 放 线 菌 门(Arthrobacter 和Gaiella)的菌属主导;相反,以hgcI_clade、CL500-29_marine_group、norank_f__ norank_o__Vicinamibacterales 和 norank_f__norank_o__norank_c__KD4-96 为代表的菌属又进一步使黄河内蒙段细菌群落存在明显的介质差异;整体上,土样较水样拥有更大的生态网络结构,且联系更紧密,抗干扰能力更强;水体细菌群落主要是通过拮抗关系来抵御外界环境变化,河漫滩土样细菌群落主要是通过协作关系来抵御外界环境变化;此外,归属于变形菌门的Candidatus_Methylopumilu、Marmoricola、Arthrobacter、Rb41 和Candidatus_ Nitrocosmicus 等是维持水体生态网络结构稳定的关键菌属,而Rhodoferax、Ellin6067、MND1 和Thiobacillus 是维持河漫滩土样生态网络结构稳定的关键菌属.

