温度与负荷对Anammox 菌自富集启动的PDA 的影响
马雨晴,王 博,李笑迪(北京工业大学,城镇污水深度处理与资源化利用技术国家工程实验室,北京市工程技术研究中心,北京 100124)
厌氧氨氧化工艺已经被证明是可持续和节约能源的工艺,具有运行能耗低,污泥产量少,温室气体排放少以及脱氮效率高等优点[1-2].伴随着厌氧氨氧化工艺在高氨氮废水处理中成功应用,研究者们开始致力于探索处理主流城市污水.由于厌氧氨氧化细菌生长缓慢,世代时间长,所以启动往往需要较长时间.厌氧氨氧化菌已被证明在不同类型的污泥中自富集,如普通活性污泥、短程硝化污泥、反硝化除磷污泥和厌氧消化污泥等,这就为厌氧氨氧化工艺的启动提供了新的策略.通过短程反硝化提供亚硝酸盐实现厌氧氨氧化细菌自富集的方法已经在实验室规模UASB 中得以证明[3].但是由于厌氧氨氧化细菌还存在对温度、基质浓度和有机物等环境敏感的特性[4],使得厌氧氨氧化工艺在污水处理厂中表现出来的脱氮性能和丰度并不理想[5-6].
厌氧氨氧化细菌最适宜的生存温度为 30~40℃[7-9].当温度超过45℃的时候,厌氧氨氧化细菌的活性受到严重抑制[10].而当温度从33℃下降到15℃时,氮去除速率明显下降[11].侧流污水处理过程通常具有较高的水温(~30 ℃), 因此更有利于厌氧氨氧化活性的维持.相比而言,主流污水温度随季节变化较大(10~25 ℃), 这会对厌氧氨氧化细菌的活性产生较大的影响.温度的降低对短程反硝化过程中亚硝酸盐的积累影响不大[12-13].当温度在18.5~28.6℃变化时,硝酸盐到亚硝酸盐的转化率可以保持在90%,这就说明通过短程反硝化可以为厌氧氨氧化更好地提供亚硝酸盐[14].基质浓度也会影响厌氧氨氧化反应,亚硝酸盐浓度过高会抑制厌氧氨氧化细菌的活性[15].因此在高氨氮废水中,通常采用梯度提高进水浓度的方式使厌氧氨氧化细菌适应生活环境.厌氧氨氧化是无需有机碳源的工艺,而主流污水中含有的易降解有机物使得异养菌进行生长代谢[9].相对于厌氧氨氧化相对缓慢的生长速率而言,异养细菌的生长速率较高,这可能使得厌氧氨氧化细菌处于劣势地位,脱氮效果变差[16-17].因此自富集出的厌氧氨氧化细菌要想在城市污水处理厂中发挥作用,就要拥有相对稳定性,能抵抗氮负荷、有机负荷变化以及温度变化的冲击.
本文通过运行厌氧氨氧化细菌自富集启动的PDA 系统,探究了温度下降及负荷冲击下长期脱氮性能的变化;然后通过16S rRNA 基因测序分析了微生物群落的变化;最后基于宏基因组测序分析研究了微生物种群中基因的表达情况.
1 材料与方法
1.1 试验污泥与进水
试验采用经过两月闲置的自富集的短程反硝化-厌氧氨氧化(PDA)污泥,为絮体-海绵填料污泥,其中海绵填料是是聚氨酯材质的,边长20mm,可以有效持留污泥.污泥接种后反应器中的混合液悬浮固体浓度(MLSS)约为1500mg/L.
用投加氯化铵(NH4Cl),硝酸钠(NaNO3)和乙酸钠的人工配水作为进水.进水包含两部分:含氨氮(NH4+-N)和有机物的原水以及硝酸盐(NO3--N)废水,每个阶段的进水浓度如表1 所示.进水氮负荷由3.2gN/(m3·d)提高到 4.0gN/(m3·d),有机负荷由64gCOD/(m3·d)提高到80gCOD/(m3·d).矿物培养基的组成包含 KH2PO4(60mg/L) 、 MgSO4·7H2O(30mg/L)、CaCl2·2H2O(14mg/L)和KHCO3(150mg/L).微量元素溶液 A(g/L)含有 6.37EDTA·2Na 和9.15FeSO4·7H2O,而微量元素溶液 B(g/L)含有19.1EDTA·2Na,0.24CoCl2·6H2O, 0.25CuSO4·5H2O,0.22NaMoO4·2H2O,0.19NiCl2·7H2O,0.014H3BO4,0.4 3ZnSO4·7H2O , 0.99MnCl2·4H2O.
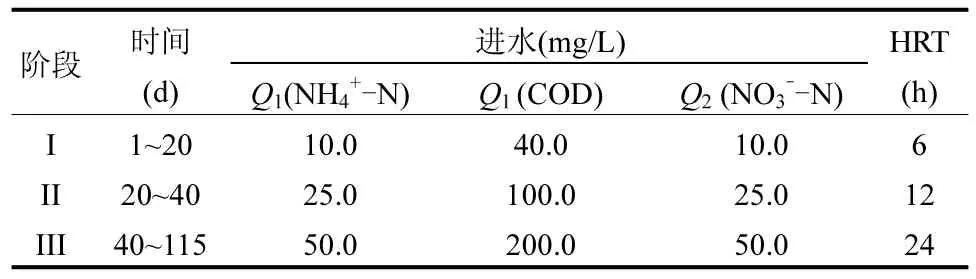
表1 系统的运行模式和特点Table 1 Operational mode and characteristics
1.2 反应器设置和运行
采用上流式厌氧污泥床(UASB)反应器,UASB的工作容积为2.5L,材质为有机玻璃.反应器配备蠕动泵和pH/DO 在线监测仪(德国 WTW340i).
UASB长期实验持续进行了约115d,分为3个阶段.第I 阶段(1~20d)为短程反硝化-厌氧氨氧化污泥的恢复阶段,第II 阶段(20~40d)和第III 阶段(40~115d)为提高进水浓度阶段,具体进水浓度和水力停留时间(HRT)见表 1.除此之外,在第 III 阶段中67~72d 中,为检测厌氧氨氧化细菌活性,停止投加有机物,以NH4+-N 和亚硝酸盐(NO2--N)为底物进行了原位活性测试,同时通过饥饿的策略来提高厌氧氨氧化的贡献,降低其他异养细菌的竞争.整个实验不控制反应器温度,在自然降温条件下进行,反应器的温度由25℃逐渐下降到19 ℃.

图1 试验装置Fig.1 Schematic diagram of experimental device
1.3 分析方法
NH4+-N、NO2−-N 和NO3−-N,混合液悬浮固体浓度(MLSS)、混合液挥发性悬浮固体浓度(MLVSS)采用标准方法检测,DO、pH 和温度通过DO 和pH 探头检测.取反应器的进水以及出水水样,所有水样经0.45µm 的中速滤纸过滤后进测定.
在第34(第II 阶段)、74(第III 阶段)和114d(第III 阶段)取出反应器中的絮体污泥以及海绵填料样品共6 个,并将填料上的生物膜用冲洗的方式进行剥离,进行4000r/min 离心冻干处理.通过DNA 试剂盒(FastDNA Spin Kit for Soil)提取冻干污泥中的DNA,采用NanoDrop ND-1000 分光光度计对提取DNA 的纯度和浓度进行测定.通过16S rRNA 基因测序技术对反应器内不同阶段的微生物群落结构及多样性进行检测.使用正向引物338F 和反向引物806R 用于扩增细菌 16S rRNA 基因的V3-V4 区.
进行宏基因组学测序,将提取的6 个DNA 样品被超声处理成400bp 的片段,通过接头连接,用于Illumina 测序和进一步的PCR 扩增.构建文库后,检测文库的插入尺寸,并使用Illumina 平台进行测序.对得到的原始序列进行优化处理,进行物种和功能上的注释以及分类.16S rRNA 基因测序和宏基因组学数据在上海美吉生物医药科技有限公司在线平台进行处理分析(Shanghai Majorbio Bio-pharm Technology Co.,Ltd).
2 结果与讨论
2.1 提高负荷对PDA 系统脱氮性能的影响
在第I 阶段,为恢复其短程反硝化以及厌氧氨氧化性能,采用较低的进水浓度,进水 NH4+-N 和NO3−-N 分别为(10.1±0.5)mg/L 和(10.2±0.1)mg/L(图2).运行前2d,NH4+-N 浓度基本没有下降,NO3−-N 下降7.0mg/L 左右,出水中并没有NO2−- N 积累.这就说明在闲置过程中,短程反硝化和厌氧氨氧化细菌活性都被破坏.但是随着反应器的运行,在第8~20d,出水中NH4+-N 从8.0mg/L 逐渐下降到2.6mg/L,NO3−-N浓度也逐渐下降到0.6mg/L.第I阶段的氮去除效率从44.3%恢复到81%,出水总氮低于5.0mg/L.这就说明短程反硝化-厌氧氨氧化污泥活性恢复,并在20d 时间恢复到闲置前水平.

图2 UASB 中的NH4+-N、NO2−-N、NO3−-N、TN 和NRE 的变化Fig.2 Variations of NH4+-N、NO2−-N、NO3−-N、TN and NRE in UASB
在第II 阶段,提高进水总氮和有机物的浓度.进水NH4+-N 和NO3−-N 分别提高到(24.9±0.5) mg/L和(25.7±0.4) mg/L,同时HRT 提高到12h.提高后可以看到在进水总氮浓度提高的冲击之下,出水中NH4+-N 和NO2−-N 的浓度都上升到8.0~9.0mg/L,短程反硝化-厌氧氨氧化反应的NRE 又从81%下降到50%.但是随着运行在HRT 延长条件下,反应器内短程反硝化和厌氧氨氧化细菌逐渐适应浓度升高的水质,脱氮效果有所上升.但是脱氮过程消耗的NO3−-N/NH4+-N 的比率异常低,出水NH4+-N 下降到0.5mg/L 时NO3−-N 还剩余10.0mg/L 左右,这可能是由于空气渗入导致硝化作用发生.
在第III 阶段,再次提高进水氨氮,硝态氮和有机物的浓度,进水总氮为100.0mg/L 左右,同时为了保证温度降低情况下的脱氮效果延长了HRT.此时PDA 系统性能并没有因为负荷提高的冲击而破坏,NRE 保持在相对稳定状态, 这可能也得益于水力停留时间延长对厌氧氨氧化细菌的持留.而且随着HRT 的延长,也使得有机物对反应器中的厌氧氨氧化细菌的负面影响降低.在综合作用下,短程反硝化和厌氧氨氧化过程抗冲击能力有所提升.
2.2 自然降温对系统脱氮性能的影响
在第I 阶段温度变化幅度较小,在(25±1)℃范围内波动,因此短程硝化-厌氧氨氧化性能在较短时间内得到恢复,出水总氮浓度最低为3.7mg/L(图2).在第II 阶段温度继续下降由24.7℃到24℃,此时出水浓度波动主要是由于负荷的冲击,温度逐渐下降过程中脱氮效果较稳定,出水NRE 在逐渐稳定在77%左右.
第III 阶段温度下降比较明显,运行10d 内温度从24℃下降到22.2℃,可能是由于温度下降的冲击,在第56~66d 出现了出水硝态氮升高的情况.这可能是由于厌氧氨氧化细菌活性受到温度影响而下降,与此同时异养细菌占据主导地位.为了加强厌氧氨氧化细菌的效果,对反应器中进行饥饿处理.在第66d 停止投加有机物,进水调整为 NH4+-N 和NO2−-N,浓度分别为(50.0±1.6) mg/L 和(50.5±2.4)mg/L.在温度逐渐由23.6℃下降到19.4℃的过程中,出水中NH4+-N、NO2−-N 和NO3−-N 分别为(8.7±1.1),(9.3±0.9)和(10.8±0.8) mg/L.其中 NH4+-N 和NO2−-N 分别下降 42.3mg/L 和 41.2mg/L,消耗NO2−-N/NH4+-N 为 0.97,低于理论值.而生成的NO3−-N/NH4+-N 的比例为0.25 则比较接近理论值.根据计算可以得第 III 阶段厌氧氨氧化的活性67.1mgN/(gVSS·d).饥饿处理完毕后,恢复进水,出水NH4+-N 和NO3−-N 相比之前有所下降.这可能是由于系统已经适应环境温度,异养细菌活性也在饥饿条件下得到抑制,进而使得厌氧氨氧化脱氮能力增加,出水的NRE 最高达到89.9%.在77~100d,温度继续下降到18.7℃,反应器的出水总氮浓度略有增加,NRE 下降到80%左右.在100d 之后NH4+-N 浓度下降到1.0mg/L以下,NO3−-N浓度在15.0mg/L左右,这有可能是厌氧氨氧化性能提高产生了更多的硝态氮.但是总体上,反应器的脱氮性能较好,出水总氮在14.1mg/L 左右,NRE 恢复到85.9%左右.这就说明了通过自富集启动的厌氧氨氧化工艺在提高进水负荷和温度变化方面有一定的抵抗能力.
2.3 微生物群落变化分析
2.3.1 污泥样品形态 本文是絮体和生物填料混合体系.通过粒度仪测得絮体污泥的平均粒径为374µm,已经形成较大的颗粒.在显微镜下对污泥进行观察,可以看到视野内分布有较大的颗粒,在污泥颗粒内部夹杂着浅红色(图3).对海绵中心部位切片后观察,可以看到一些浅红色的污泥分布在海绵的骨架上.由于厌氧氨氧化菌代谢过程中依赖于亚铁血红素c,则一般呈现为暗红色[18],这可能是厌氧氨氧化在填料内部中富集的证据.

图3 絮体污泥和生物填料的形态结构(第110d)Fig.3 Morphological structure of floc sludge and bio-carriers(the 110th day)
2.3.2 多样性和丰富度的分析 由表2 可知,根据足够高的覆盖率(>0.99),采样深度足够且真实.Chao1 和ACE 的结果表明,相比于生物填料,絮体污泥中拥有更高的丰富度.此外,从Shannon、Simpson指数可以看出,随着反应器的运行,填料中生物群落的多样性增加,而絮体污泥中的多样性减少.

表2 Shannon, Simpson, Ace 和Chao1 指数Table 2 Shannon, Simpson, Ace, and Chao1 indices
2.3.3 微生物群落分析 通过16S rRNA 分析了微生物群落的结构和动态.主要的门为Proteobacteria,Bacteroidetes, Chloroflexi, Planctomycetota(图4).Proteobacteria 与短程反硝化有关,在絮体污泥中的占比逐渐由34.3%提高到58.7%,在PDA系统中占据绝对优势[19].其中Thauera 菌属是将硝酸盐还原为亚硝酸盐的主力[20-21],在絮体污泥中的丰度最高可达15.7%,但在生物膜中的丰度仅为0.03%,这是由于相比于生物膜,Thauera 菌更倾向于生长在絮体污泥中,这与其他试验结果相同[21-22].Chloroflexi 和Bacteroidota 在形成聚集体和生物膜方面发挥了重要作用,在絮体和颗粒污泥中都占一定比例.厌氧氨氧化菌所在的Planctomycetes[23-24],相对丰度从第I阶段的7.5%和4.7%下降到第III 阶段的3.1%和3.8%,这可能是由于进水浓度或者温度下降提高对其产生了冲击. Candidatus Brocadia 作为唯一检测到的厌氧氨氧化细菌,其在第II 阶段生物膜中的相对丰度达到3.7%,这个丰度甚至超过某些接种厌氧氨氧化细菌启动的反应器中的丰度[25],并且在自富集厌氧氨氧化细菌的反应器中也处于较高水平[26-27].在III 阶段可能受到温度和有机物的影响,丰度有所下降但是其脱氮效果并没有恶化.重要硝化细菌Nitrosomonas 和Nitrospira 在UASB 中的丰度都低于1%.
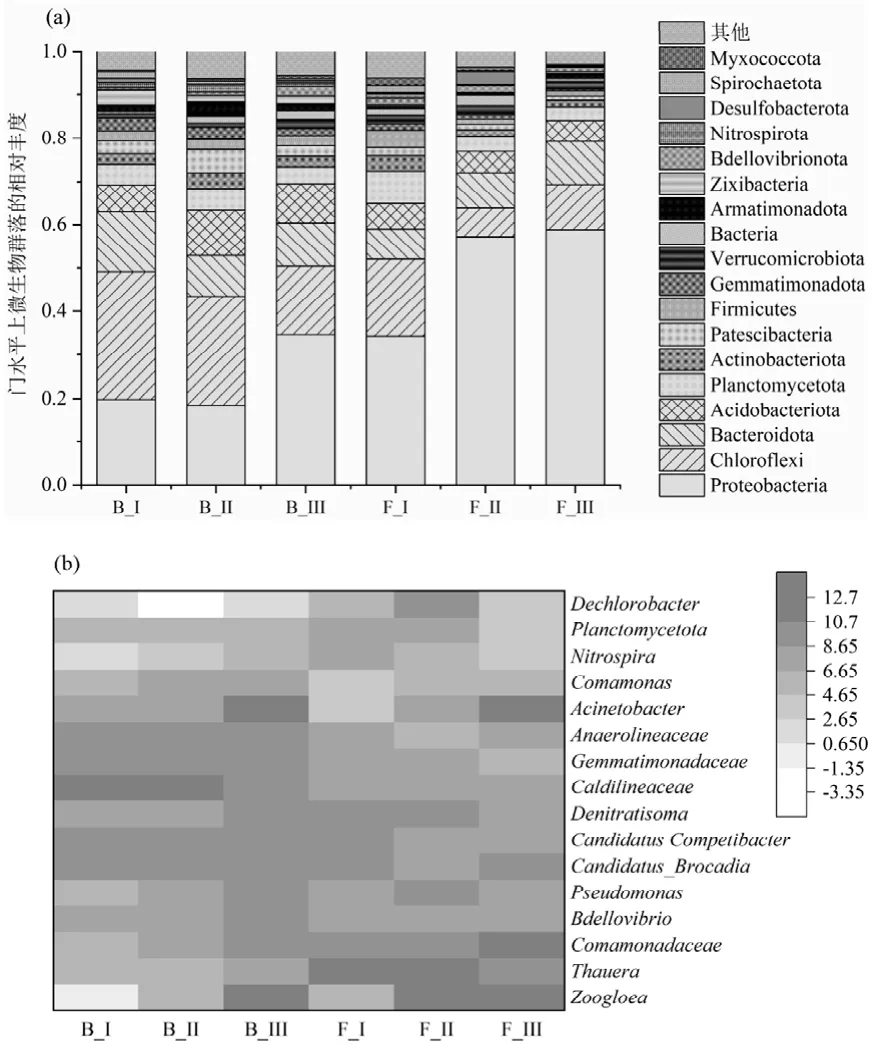
图4 门和属水平上的微生物群落分布Fig.4 Microbial community distribution at the phylum and genus levels
2.4 关键功能基因分析
图5 中,与新陈代谢相关的功能基因占比最高,达到了50.0%左右,与氮循环相关的能量代谢功能就被包含在其中.

图5 系统功能占比以及与氮循环相关基因的表达Fig.5 Proportion of system functions and expression of genes related to nitrogen cycle
在UASB中的生物膜和絮体中都观察到硝酸盐转化为亚硝酸盐的关键基因细胞质硝酸还原酶(Nar)、周质硝酸还原酶(Nap),显示了硝酸盐转化为亚硝酸盐转化为厌氧氨氧化富集的潜在途径. Nar基因根据Reads Number 计算的丰度值之和为83945,说明短程反硝化有关基因表达程度较高.亚硝酸铜还原酶(NirK)和细胞色素cd1 亚硝酸还原酶(NirS)可以将亚硝酸盐还原为一氧化氮,是发生厌氧氨氧化反应的其中一个重要过程[28].肼脱氢酶(Hdh),肼合酶(Hzs)作为厌氧氨氧化过程中的最重要的两种酶都可以被检测到,丰度分别为1118 和12050,这就说明厌氧氨氧化在其中发挥重要作用.NirS 的丰度值为32190,这表明在亚硝酸盐转化为一氧化氮的表达程度较高.与反硝化相关的一氧化氮还原酶(NorBC),一氧化二氮还原酶(NosZ)也都可以检测到,说明反硝化过程在UASB的脱氮过程中也做出了贡献.与硝化相关的基因AmoABC 都处在非常低的水平,这与微生物群落检测结果相同,这说明了氨氮主要是通过厌氧氨氧化反应去除的.
2.5 关于自富集PDA 系统稳定性的讨论
厌氧氨氧化种泥通常作为接种污泥的一部分,以加速自养脱氮系统的启动.但它会在一定程度上增加实际应用中的投资和操作的复杂性,而且大量的厌氧氨氧化种泥获取困难.相比之下,厌氧氨氧化细菌的自富集将是一种更实用、更有效的操作策略.然而,将厌氧氨氧化直接应用于主流工艺通常受到低温、低氨浓度和高有机物浓度的阻碍.因此自富集的厌氧氨氧化细菌对环境变化的抵抗能力决定了其能否在实际工程中顺利应用.
本文中采用厌氧氨氧化菌自富集启动的PDA系统在主流污水中实现了深度脱氮,总氮去除率达到89.9%,并且发现在温度以及负荷的变化时自富集启动的氨氧氨氧化工艺仍然具有较好的稳定性.这可能是因为相比于接种处理高氨氮废水富集的厌氧氨氧化细菌而言,自富集的厌氧氨氧化污泥更加适应主流污水环境.而且生物填料和絮体相结合的形式有更好的鲁棒性,可以更好的抵抗冲击和低温的影响.在整个运行过程中亚硝酸盐的产生充足的同时消耗有机物,消除有机物对厌氧氨氧化的不利影响.此外,整个操作过程中的较长污泥停留时间有效保留了厌氧氨氧化细菌,使得功能微生物Candidatus Brocadia 细菌得到富集.
Wang 等[29]通过16S rRNA 测序发现在水厂的各个单元均有厌氧氨氧化菌的存在,且能够发挥脱氮作用.Lou 等[30]也发现厌氧氨氧化菌在大规模AAO 氧化沟过程中的富集.因此全规模污水处理厂中检测到的厌氧氨氧化细菌丰度为将厌氧氨氧化直接整合到主流处理中并实现深度脱氮提供了一定可行性.但是由于厌氧氨氧化细菌自身特性,其在污水处理厂中发挥出的脱氮能力并不能确定.本研究在实验室规模的反应器中对自富集厌氧氨氧化系统的性能进行的探究取得了较理想的结果.但是对于自富集厌氧氨氧化细菌在污水处理厂中如何发挥深度脱氮的作用仍然需要继续探究.
3 结论
3.1 在温度由25℃下降到19℃的条件下,UASB 进水总氮浓度由20mg/L 提高到100mg/L,总氮去除率最高可达到89.9%以上,说明短程反硝化-厌氧氨氧化反应能够保持一定的稳定性.
3.2 Candidatus Brocadia 和Thaurea 分别为主要的厌氧氨氧化菌和短程反硝化菌.生物填料中厌氧氨氧化细菌相对丰度达到3.7%,絮体污泥中Thaurea相对丰度最高达15.7%.
3.3 与短程反硝化相关的基因Nar,Nap 和与厌氧氨氧化相关的Nir,Hzs 和Hdh 基因表达程度较高.

