苹果GRF基因家族在非生物胁迫下的表达分析
高明刚 李明 段高飞 王滕飞 冯晓健 许瑞瑞


摘 要 GRF(Growth Regulating Factor)基因家族是一类植物特有的转录因子,它在调控植物的生长发育、渗透胁迫等方面发挥重要作用,主要通过调控细胞增殖过程促进植物组织器官的生长,提高植物对环境胁迫的适应性,因此,研究GRF基因家族在逆境条件下的表达调控具有重要意义。利用生物信息学分析和实时荧光定量PCR技术研究苹果中12个 GRF 基因在干旱、盐害和温度胁迫条件下的表达情况。结果表明:苹果MdGRFs基因参与响应非生物胁迫,干旱、盐害、高温和低温条件下MdGRFs表达量多数有明显变化。分别用干旱、盐害处理苹果幼苗后有相同的4 个MdGRFs基因呈上调表达趋势;分别用干旱、低温处理后也有4 个基因有相似的诱导表达;MdGRF05和MdGRF07受到干旱、盐害和低温的诱导表达;盐胁迫处理后,12 个MdGRFs基因中有8个明显上调,4个明显下调;高温条件下,MdGRF04、MdGRF05、MdGRF07、MdGRF09和MdGRF11基因表达上调略明顯,MdGRF02、MdGRF03和MdGRF10表达均下调,其中高温12 h 后,几乎检测不到MdGRF10的表达。
关键词 苹果;GRF基因家族;非生物胁迫;表达分析
生长调节因子(Growth Regulated Factor,GRF)是一种植物特有的转录因子,不仅可以调控植物的生长发育,也可在不利环境条件下的生长发育过程中发挥重要作用[1-3]。研究表明,GRF的N端区域包含两个保守结构域:谷氨酰胺Gln、亮氨酸Leu、谷氨酰胺Gln组成的QLQ保守域和色氨酸Trp、精氨酸Arg、半胱氨酸Cys组成的WRC保守域,WRC结构域具有核定位信号和锌指结构;除此之外,有些GRF转录因子的C端区域还含有TQL、GGPL和FFD共3个保守结构域[4-6]。
2000年,水稻 OsGRF1作为第一个成员被鉴定出在赤霉素(Gibberellic acid,GA)诱导的茎伸长中发挥着重要的调控作用[2],随后,研究者发现大量GRF基因参与植物的生长发育调控[7-8]。 AtGRF1和 AtGRF2的过表达导致叶片和子叶增大[1]; AtGRF1、 AtGRF2和 AtGRF3在叶片发育过程中起到细胞增殖的正调控作用[9]; AtGRF4是叶细胞增殖、子叶胚胎发育和茎尖分生组织(SAM)发育所必需的[10]; AtGRF1调节种子的重量和大小[11]; AtGRF7作为渗透胁迫响应基因的抑制因子,防止在胁迫条件下的生长抑制[6]。
甘蓝型油菜 BnGRF2可以通过提高光合效率促进种子质量和产油[12];玉米 GRF10则是通过降低细胞增殖来控制叶片大小和株高[13];水稻 GRF4是调控粒质量和产量的关键转录因子[14-15]; OsGRF6通过IAA途径调控花序构型,通过GA途径调控植株高度[16-17];此外,在各种非生物胁迫诱导下,miR396负调控 AtGRF、 OsGRF和 ZmGRF的表达[18-22]。然而,目前关于苹果MdGRFs在非生物胁迫条件下的表达调控机制还不清楚。
苹果是全球广泛种植的水果作物之一,富含人体所需的多种元素和营养成分[23]。中国是世界上最大的苹果生产国和消费国,种植面积和产量均占世界总量的40%以上,在世界苹果产业中占有重要地位[24]。近年来,非生物胁迫严重影响着苹果的生理生化反应和代谢过程,对苹果果实的产量和品质造成显著负面影响[25-26]。因此,探索苹果非生物胁迫的基因资源,对培育耐高温新品种和苹果生产具有重要的现实意义。苹果全基因组共鉴定到12个GRF基因成员[27],本研究采用实时荧光定量PCR技术,分别对12个MdGRFs基因进行表达检测,分析它们在干旱、盐害和温度胁迫条件下的表达调控特点,拟为今后进一步探究MdGRFs基因的逆境生物学功能奠定一定的试验基础。
1 材料与方法
1.1 试验材料
所用植物材料由山东农业大学园艺科学与工程学院提供,‘嘎拉苹果组培苗每隔30 d继代培养1次,25 ℃,光照16 h/暗8 h无菌培养。继代20 d后,将生长良好的‘嘎拉组培苗转移到生根培养基(1/2MS+0.1 mg/L IAA)中,组培生根生长45 d后移栽于营养土里,置于25 ℃温室中,光照16 h/暗8 h。生长2个月后,选择发育均匀的幼苗进行胁迫处理后取样。对照组置于25 ℃正常培养,用1/2霍格兰营养液浇灌;干旱胁迫和盐害分别用含有200 mmol/L甘露醇和300 mmol/L氯化钠的1/2霍格兰营养液浇灌3 h、 12 h;温度胁迫处理选择高温39 ℃和低温4 ℃进行,分别处理3 h、12 h。样品迅速用液氮冷冻,存放于-80 ℃冰箱,备用。
1.2 引物设计
在苹果基因组数据库中检索MdGRFs的基因序列,使用Beacon Designer 7软件设计引物(表1)。
1.3 主要试剂
Trizol试剂(Invitrogen, Carlsbad, CA, USA)用于RNA提取;反转录试剂盒和荧光定量PCR试剂盒购于Takara公司;甘露醇和NaCl等试剂均为国药集团药品。
1.4 苹果MdGRFs基因启动子序列提取
从TAIR数据库(https://www.arabidopsis.org)下载拟南芥GRF家族的基因序列。苹果基因组序列从GDR数据库(https://www.rosaceae.org)下载。利用hmmer程序[28]搜索苹果所有潜在的GDR转录因子家族成员。从Pfam数据库(http://pfam.sanger.ac.uk)下载WRC(PF08879.8)和QLQ(PF08880.9)结构域的隐马尔可夫文件对苹果GDR家族进行鉴定。提取苹果所有GDR家族成员转录起始位点上游1 500 bp的DNA序列作为启动子序列进行后续分析。利用PlantCARE在线程序(http://bioinformatics.psb.ugent.be/ webtools/plantcare/html/)对苹果MdGRFs基因的启动子序列进行响应元件预测与分析。
1.5 苹果MdGRFs基因在非生物胁迫条件下的表达分析
采用Trizol法提取总RNA,用DNaseI除去基因组DNA后,根据反转录试剂盒说明书合成cDNA,用于qRT-PCR表达分析。荧光定量PCR使用的仪器为BIO-RAD IQ5,所有PCR反应均设3次重复。采用Md18S为内参基因。荧光定量PCR反应体系为:SYBR Green Ⅰ Master 10 μL,上、下游引物各1 μL,模板2 μL,加去离子水至20 μL。反应条件为94 ℃ 10 min;94 ℃ 10 s,60 ℃ 60 s,40个循环。采用2-ΔΔCT法对数据进行定量分析,用Excel 2010作图。
2 结果与分析
2.1 苹果MdGRFs转录因子基因上游的启动子序列分析
利用PlantCARE在线程序对12个MdGRFs转录因子基因上游1 500 bp启动子区域包含的非生物胁迫响应元件进行预测和分析,如表2所示,除MdGRF03外,11个MdGRFs的启动子区域存在多个响应元件,如MBS(MBS binding site involved in drought inducibility)、TC-rich repeat(Defense and stress responsive elements)、HSE(Heat stress responsive elements)、LTR(Low temperature stress)和C-repeat/DRE(Cold- and dehydration-responsiveness)等,非生物胁迫响应元件共46个,其中,MdGRF01、MdGRF02、MdGRF08、MdGRF09和MdGRF11分别含有8、7、7、6和6个元件,这些元件说明以上5个基因可能响应干旱、高温和低温等不同胁迫(表2)。
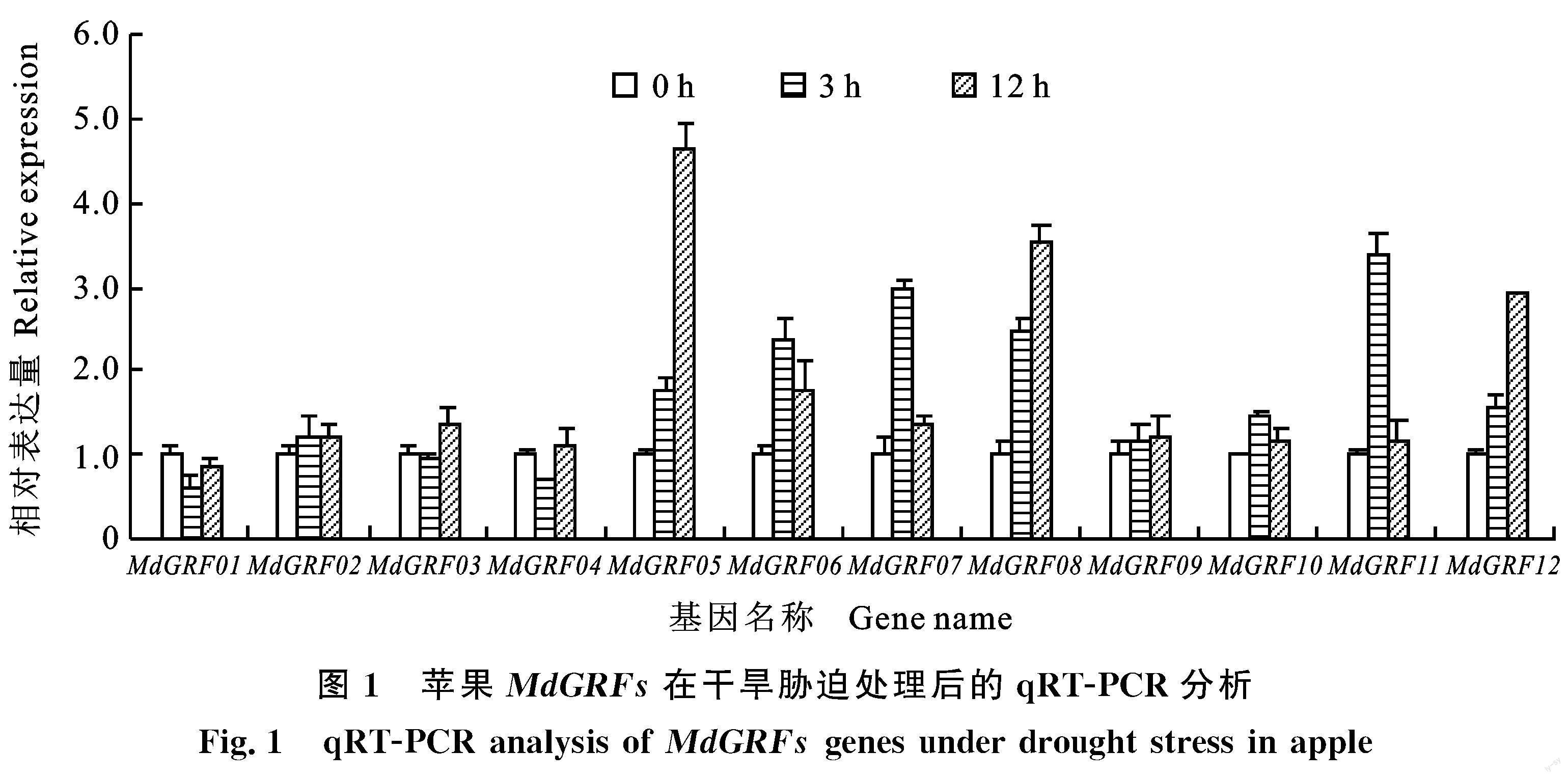
2.2 苹果MdGRFs在干旱胁迫条件下的表达 分析
12个MdGRFs基因的表达量均有不同程度变化,但是干旱胁迫条件下基因下调的情况并没有检测到。结果表明,MdGRF05、MdGRF06、MdGRF07、MdGRF08、MdGRF11和MdGRF12 6 个基因的表达明显上调,上调倍数为2.39~4.64(图1),其中,5个基因的启动子预测分析均包含相关响应元件,只有MdGRF06的启动子中无干旱相关响应元件(表2),MdGRF05经过12 h甘露醇处理后表达量升高至对照的4.64倍,表明该基因明显受到干旱诱导(图1)。
2.3 苹果MdGRFs在盐胁迫条件下的表达分析
由图2可知,苹果MdGRF02、MdGRF03、MdGRF05、MdGRF07、MdGRF11和MdGRF12共6个基因的表达明显上调,基因表达量均达到对照的2.0倍以上,最高的达到4.15倍,同时MdGRF01、MdGRF08和MdGRF09的表达量变化也很明显,盐胁迫处理后,表达量降低至不足对照的1/2。
2.4 苹果MdGRFs在高温条件下的表达分析
近年来,全球温室效应导致极端天气增加,气候反常,尤其是高温天气严重影响着苹果的生理生化反应和代谢过程,对苹果果实的产量和品质造成显著负面影响[23]。由图3可知,MdGRF04和MdGRF11的表達量明显增加,高温处理3 h后MdGRF11的表达量达到对照的3.33倍;检测到基因表达量下调的有4个基因,包括MdGRF01、MdGRF02、MdGRF03和MdGRF10,高温处理12 h后,MdGRF10的表达量降至对照的1/20,表明以上6个基因的表达量均不同程度响应高温胁迫。MdGRF01、MdGRF02、MdGRF10和MdGRF11均含有1~3个HSE元件(表2)。
2.5 苹果MdGRFs在低温条件下的表达分析
MdGRF01、MdGRF02和MdGRF04的表达有明显下降趋势,该趋势在低温处理12 h时显现;MdGRF05~MdGRF10 6 个基因启动子区域内只有MdGRF08包含1个LTR元件,但是6 个基因经过低温处理后表达均有明显上调,最高达5.47倍(表2和图4),说明低温处理时基因表达的变化趋势与基因内的LTR响应元件数量相关性不大。
3 讨 论
植物GRFs基因在根和地上部组织中有不同程度的表达,在细胞增殖的组织部位的表达较高[1,9,12]。苹果MdGRFs基因在根、茎、叶、花和果实等多种组织中表达,但在幼苗叶片中的表达水平高于成熟叶片,也符合GRF在不同组织生长发育早期发挥作用的结果[27];NtGRFs和BnGRFs在不同的器官或组织中存在差异表达[3,29-30],很多GRF基因也具有组织特异性的表达模式,表明它们可能在调控植物生长发育方面具有不同的功能。
研究表明,响应非生物胁迫和激素处理的GRF基因通常包含胁迫相关的顺式响应元件[3,22,31]。本研究分析得知11个苹果MdGRFs基因的启动子区域分别包含1~8个非生物胁迫响应顺式元件(表2),因此,初步预测苹果MdGRFs基因可能参与非生物胁迫信号通路。结合qRT-PCR分析得知,干旱和高温胁迫处理后,基因表达量的变化与含有的MBS、HSE等响应元件的相关性分别为83.3%和66.7%,而低温处理后苹果MdGRFs的表达量变化与基因启动子区域含有的LTR元件并没有紧密联系。
通过深入分析qRT-PCR结果还发现,很多非生物胁迫条件下的调控模式有相似性,比如:干旱、盐害胁迫后,MdGRF05、MdGRF07、MdGRF11和MdGRF12均有上调表达趋势(图1和图2);同时,干旱、低温处理后,MdGRF05、MdGRF06、MdGRF07和MdGRF08的基因表达量增加,以上两种情况相似基因数占总上调基因数的2/3(图1和图4);MdGRF05和MdGRF07两个基因受到干旱、盐害和低温的诱导表达(图1、图2和图4),可作为今后重点研究的非生物胁迫响应途径的关键基因;另外,分析还发现MdGRF01多呈现下调模式,盐害、温度胁迫都会降低该基因的表达,MdGRF04受到高温诱导,低温处理后表达量下降;MdGRF10则正好相反(图2、图3和图4),以上结果说明:MdGRFs基因家族响应非生物胁迫是大多数基因具有相似性和少数基因多样化共存。
綜合上述研究结果,MdGRFs参与苹果响应干旱、盐胁迫、高温及低温信号途径,在调控苹果逆境响应机制中可能发挥着重要作用,但详细的逆境生物学功能以及分子调控机制需进一步探索。本文为今后研究苹果MdGRFs在干旱、盐胁迫及温度等非生物胁迫过程中的具体功能和抗性机理提供了一定的理论基础,也为培育抗逆苹果新品种提供了关键的候选基因资源。
参考文献 Reference:
[1] KIM J H,CHOI D,KENDE H.The AtGRF family of putative transcription factors is involved in leaf and cotyledon growth in Arabidopsis[J].The Plant Journal,2003, 36(1):94-104.
[2] OMIDBAKHSHFARD M A,PROOST S,FUJIKURA U,et al.Growth-regulating factors (GRFs):a small transcription factor family with important functions in plant biology[J].Molecular Plant,2015,8(7):998-1010.
[3] MA J Q,JIAN H J,YANG B,et al.Genome-wide analysis and expression profiling of the GRF gene family in oilseed rape (Brassica napus L.)[J].Gene,2017,620:36-45.
[4] VAN DER KNAAP E,KIM J H,KENDE H.A novel gibberellin-induced gene from rice and its potential regulatory role in stem growth[J].Plant Physiology,2000,122(3):695-704.
[5] CHOI D,KIM J H,KENDE H.Whole genome analysis of the OsGRF gene family encoding plant-specific putative transcription activators in rice (Oryza sativa L.)[J].Plant & Cell Physiology,2004,45(7):897-904.
[6] KIM J S,MIZOI J,KIDOKORO S,et al.Arabidopsis growth-regulating factor7 functions as a transcriptional repressor of abscisic acid- and osmotic stress-responsive genes,including DREB2A[J].The Plant Cell,2012,24(8):3393-3405.
[7] HORIGUCHI G,KIM G T,TSUKAYA H.The transcription factor AtGRF5 and the transcription coactivator AN3 regulate cell proliferation in leaf primordia of Arabidopsis thaliana[J].The Plant Journal,2005,43(1):68-78.
[8] KUIJT S J,GRECO R,AGALOU A,et al.Interaction between the GROWTH-REGULATING FACTOR and KNOTTED1-LIKE HOMEOBOX families of transcription factors[J].Plant Physiology,2014,164(4):1952-1966.
[9] KIM J H,KENDE H.A transcriptional coactivator,AtGIF1,is involved in regulating leaf growth and morphology in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004, 101(36):13374-13379.
[10]KIM J,LEE B.GROWTH-REGULATING FACTOR4 of Arabidopsis thaliana is required for development of leaves,cotyledons,and shoot apical meristem[J].Journal of Plant Biology,2006,49(6):463-468.
[11] VAN DAELE I,GONZALEZ N,VERCAUTEREN I, et al.A comparative study of seed yield parameters in Arabidopsis thaliana mutants and transgenics[J].Plant Biotechnology Journal,2012,10(4):488-500.
[12] LIU J,HUA W,YANG H L,et al.The BnGRF2 gene ( GRF2-like gene from Brassica napus) enhances seed oil production through regulating cell number and plant photosynthesis[J].Journal of Experimental Botany,2012,63(10):3727-3740.
[13] WU L,ZHANG D F,XUE M,et al.Overexpression of the maizeGRF10,an endogenous truncated growth-regulating factor protein,leads to reduction in leaf size and plant height[J].Journal of Integrative Plant Biology,2014, 56(11):1053-1063.
[14] HU J,WANG Y X,FANG Y X,et al.A rare allele of GS2 enhances grain size and grain yield in rice[J].Molecular Plant,2015,8(10):1455-1465.
[15] SUN P Y,ZHANG W H,WANG Y H,et al. OsGRF4 controls grain shape,panicle length and seed shattering in rice[J].Journal of Integrative Plant Biology,2016, 58(10):836-847.
[16] GAO F,WANG K,LIU Y,et al.Blocking miR396 increases rice yield by shaping inflorescence architecture[J].Nature Plants,2015,2:15196.
[17] TANG Y Y,LIU H H,GUO S Y,et al.OsmiR396d miRNA affects gibberellin and brassinosteroid signaling to regulate plant architecture in rice[J].Plant Physiology,2018,176(1):946-959.
[18] LIU H H,GUO S Y,XU Y Y,et al.OsmiR396d-regulated OsGRFs function in floral organogenesis in rice through binding to their targets OsJMJ706 and OsCR4[J].Plant Physiology,2014,165(1):160-174.
[19] SCHOMMER C,DEBERNARDI J M,BRESSO E G, et al.Repression of cell proliferation by miR319-Regulated TCP4[J].Molecular Plant,2014,7(10):1533-1544.
[20] KIM J H,TSUKAYA H.Regulation of plant growth and development by the GROWTH-REGULATING FACTOR and GRF-INTERACTING FACTOR duo[J].Journal of Experimental Botany,2015,66(20):6093-6107.
[21] NELISSEN H,EECKHOUT D,DEMUYNCK K,et al.Dynamic changes in ANGUSTIFOLIA3 complex composition reveal a growth regulatory mechanism in the maize leaf[J].The Plant Cell,2015,27(6):1605-1619.
[22] 何 彬,王俞丹,宋世威.miR396-GRF模塊参与植物逆境胁迫响应的研究进展[J].植物科学学报,2022,40(3):437-447.
HE B,WANG Y D,SONG SH W,et al.Research progress on miR396-GRF module regulating plant stress response[J].Plant Science Journal,2022,40(3):437-447.
[23] LEE S Y,CHANG S S,SHIN J H,et al.Membrane filtration method for enumeration and isolation of Alicyclobacillus spp. from apple juice[J].Letters in Applied Microbiology,2007,45(5):540-546.
[24] 赵政阳,冯宝荣,王雷存,等.我国苹果产业向优势区域集中的战略思考[J].西北农业学报,2004,13(4):195-199.
ZHAO ZH Y,FENG B R,WANG L C,et al.The strategic thinkings on the concentrating apple industry in the superior district of China[J].Acta Agriculturae Boreali-occidentalis Sinica,2004,13(4):195-199.
[25] CHALLINOR A,WATSON J,LOBELL D,et al.A meta-analysis of crop yield under climate change and adaptation[J].Nature Climate Change,2014,4:287-291.
[26] 趙明玉,李 宏,武胜利,等.果实膨大期干旱胁迫对'红富士'苹果树生理特性的影响[J].西北农业学报,2020, 30(12):1839-1847.
ZHAO M Y,LI H,WU SH L,et al.Effect of drought stress on physiological characteristics of ‘Red Fuji apple trees during fruit expansion period[J].Acta Agriculturae Boreali-occidentalis Sinica,2020,30(12):1839-1847.
[27] XU R R,GAO M G,LI M,et al.Identification of MdGRF genes and the necessary role of MdGRF02 in apple root growth regulation[J].Scientia Horticulturae,2022,295:110866.
[28] JOHNSON L S,EDDY S R,PORTUGALY E.Hidden Markov model speed heuristic and iterative HMM search procedure[J].BMC Bioinformatics,2010,11:431.
[29] 韦燕红,刘 桢,李 珂,等.苹果miR396家族鉴定及在不定根发育过程中的表达分析[J].园艺学报,2020, 47(7):1237-1252.
WEI Y H,LIU ZH,LI K,et al.Genome-wide identification and expression analysis of miR396 family during adventitious root development in apple[J].Acta Horticulturae Sinica,2020,47(7):1237-1252.
[30] ZHANG J F,LI Z F,JIN J J,et al.Genome wide identification and analysis of the growth-regulating factor family in tobacco(Nicotiana tabacum) [J].Gene,2018,639:117-127.
[31] ZOU X Y,XIANG W,LI K,et al.MdGRF11,a growth-regulating factor,participates in the regulation of flowering time and interacts with MdTFL1/MdFT1 in apple[J].Plant Science,2022 321:111339.
Expression Analysis of GRF Gene Family under Abiotic Stress in Apple
Abstract Growth Regulating Factor (GRF) gene family is a kind of plant-specific transcription factors,which play an important role in regulating the growth and development of plants and osmotic stress,mainly the role in promoting the growth of plant tissues and organs by regulating the cell proliferation process,and improving the adaptability to environmental stress in plants.Therefore,it is of great significance to study the expression regulation of GRF gene family under abiotic stress in plant.In this study,bioinformatics analysis and quantitative real-time PCR were used to detect the expression of 12 MdGRFs genes under drought,salt and temperature stress in apple.The results showed that MdGRFs were involved in response to abiotic stress,and the expression level of MdGRFs changed significantly under drought,salt injury,high temperature and low temperature.MdGRF05,MdGRF06,MdGRF07,MdGRF08 and MdGRF11 showed similar regulation pattern,and the regulation of MdGRF09 and MdGRF12 was different under drought and cold stress.After salt stress,eight MdGRFs were significantly up-regulated and four MdGRFs were significantly down-regulated.Under high temperature stress,the expression of MdGRF04,MdGRF05,MdGRF07,MdGRF09 and MdGRF11 genes were slightly up-regulated,and the expression of MdGRF02,MdGRF03 and MdGRF10 were down-regulated.The expression of MdGRF10 could hardly be detected after 12 h of high temperature.
Key words Apple; GRF gene family; Abiotic stress; Expression analysis

