不同温度条件下赤铁矿对腐殖酸的吸附性能和机制研究
周灿瑶,戴 伟,栾亚宁①,王旭琴 (.北京林业大学林学院/ 森林培育与保护教育部重点实验室,北京 00083;.内蒙古自治区环境监测总站鄂尔多斯分站,内蒙古 鄂尔多斯 07000)
土壤有机质(SOC)是陆地碳元素的主要存在形式,矿物是土壤的重要组成部分,矿物通过表面吸附SOC的方式与SOC形成有机质-矿物复合体[1],对SOC的稳定性产生影响:例如矿物结合态有机质(MOC)的形成可以降低SOC的温度敏感性(Q10)[2],有机质-矿物复合体可以作为胶结物质将SOC和黏土矿物联结形成土壤微团聚体,阻止微生物分解SOC并限制氧气扩散,从而抵抗微生物对SOC的分解作用[3-4],由此可见,土壤矿物对有机质吸附的环境意义在于:一方面,可增强土壤吸附能力,提高土壤固持养分的能力,减少土壤养分流失;另一方面,可提高有机质稳定性,延长有机碳在生态系统中的循环周期。
铁氧化物是土壤中的常见矿物,已有研究[5]发现铁氧化物对SOC的吸附强于黏土矿物,其他研究者也得到相同结论,例如TOMBCZ等[6]发现赤铁矿对腐殖酸的吸附能力要高于高岭石和蒙脱石,MEIER等[7]发现在相同条件下针铁矿对有机质的吸附量约为高岭石的3倍,目前大多数研究者认为铁氧化物对SOC的吸附占土壤矿物吸附SOC的主要部分。此外,影响铁氧化物吸附SOC的因素还有土壤pH,例如MAYES等[8]研究发现土壤pH越低,铁氧化物对SOC的吸附作用越强,吸附等温线的非线性就越强,随着土壤pH的增加,铁氧化物对SOC的最大吸附量逐渐降低,这是由于SOC呈负电性,pH增加导致铁氧化物与SOC之间的静电作用降低进而导致吸附强度减弱。SOC浓度[9]也会影响铁氧化物对SOC的吸附,例如KAISER等[10-11]研究发现SOC浓度与平衡吸附量之间呈现一定的负相关,但MOORE等[12]却认为SOC含量与平衡吸附量之间呈现较好的正相关性,这是由于铁氧化物对SOC的吸附存在一个临界浓度,当SOC浓度在临界浓度以内时两者呈正相关,当超过临界浓度时两者呈负相关。矿物径级影响铁氧化物对SOC的吸附主要体现在细径级铁氧化物的阳离子交换量更高,比表面积更大,且活性位点更多,导致吸附SOC能力更强[13],结合SOC更紧密[14]。微生物的分布也会影响铁氧化物吸附SOC,这是由于一方面铁氧化物表面微生物可能分解部分结合不紧密的MOC[13],另一方面与铁氧化物结合的微生物可能是微团聚体形成的核心[15]。铁氧化物吸附SOC是一个动态、可逆的过程,在吸附过程中SOC的化学结构在影响吸附时具有选择性,会出现优先吸附更新鲜、分解程度更低且化学结构更简单的SOC[16]。LEINEMANN等[13]通过研究发现吸附结构更简单的SOC可以置换出之前被吸附的化学结构更复杂的旧SOC,并且旧SOC会继续向下迁移,最终置换出更旧的SOC。
总之,土壤pH、SOC浓度和结构、微生物等因素均会影响铁氧化物对SOC的吸附。然而在当前实现碳中和目标的背景下[17],温室效应加剧影响气候变化,气候变化进而会影响铁氧化物对SOC的吸附,这对土壤碳循环和碳固持具有重要影响[18],但目前关于温度对铁氧化物吸附SOC影响的研究尚鲜见报道。笔者以赤铁矿(Hem)和腐殖酸(HA)为研究对象,通过批量吸附试验来研究温度对赤铁矿吸附腐殖酸的影响,为了解温度变化对Hem吸附HA的环境行为提供理论依据。当SOC被固定在矿物表面时,会导致矿物的表面形貌、表面官能团、结晶度、元素含量和电荷状态等理化性质[10]发生改变,所以笔者借助扫描电镜-能谱仪(SEM-EDS)、红外光谱(FTIR)、X射线衍射(XRD)和zeta电位仪等手段深入探究不同温度条件下Hem对HA的吸附机制。
1 材料与方法
1.1 供试材料
Hem(分析纯)和HA(分析纯)均购自上海麦克林试剂有限公司。
腐殖酸标准液的配制:称取100 mg HA溶于100 mL 0.1 mol·L-1NaOH溶液中,然后用超纯水定容至1 000 mL,在避光环境下放置12 h,再用0.45 μm孔径滤膜对其进行抽滤,滤液用棕色广口瓶保存备用。
赤铁矿悬浮液的配制:称取1 000 mg Hem用超纯水定容至1 000 mL,摇匀后用透明广口瓶保存备用。
1.2 吸附动力学试验
在300 mL血清瓶中加入100 mL腐殖酸标准液和100 mL赤铁矿悬浮液,用封口膜密封,分别放入25、30、35和40 ℃恒温培养箱中振荡培养(150 r·min-1)[19],在培养0、0.5、1、2、4、8、12和24 h时用注射器抽取水样,经0.45 μm孔径滤膜后收集滤液,用总氮总碳分析仪(TOC)测定水样中HA浓度[20]并计算Hem对HA的吸附量。HA吸附量计算公式为
q=(C0-C)V/m。
(1)
式(1)中,q为HA吸附量,mg·g-1;C0为初始HA质量浓度,mg·L-1;C为吸附后溶液中剩余HA质量浓度,mg·L-1;V为HA溶液体积,L;m为赤铁矿质量,g。
采用准一级动力学模型和准二级动力学模型对动力学数据进行拟合,其计算公式分别为
准一级动力学模型:
ln (qe-qt)=lnqe-k1t,
(2)
qt=qe(1-e-k1t)。
(3)
准二级动力学模型:
t/qt=1/(k2qe2)+t/qe,
(4)
qt=k2qe2t/(1+k2qet)。
(5)
式(2)~(5)中,t为吸附时间,min;qe为达到吸附平衡时HA吸附量,mg·g-1;qt为t时刻HA吸附量,mg·g-1;k1为准一级吸附速率常数,min-1;k2为准二级吸附速率常数,g·mg-1·min-1。
1.3 培养试验
在300 mL血清瓶中加入100 mL腐殖酸标准液和100 mL赤铁矿悬浮液,用封口膜密封,分别放入25、30、35和40 ℃恒温培养箱中振荡培养24 h[21-22],然后在转速为1 000 r·min-1条件下离心 20 min(离心半径为20 cm),抽取上清液后将沉淀物分别置于25、30、35和40 ℃恒温培养箱中风干,得到的残留固态物质为HA-Hem复合体,将其分别标记为Hem25、Hem30、Hem35和Hem40。每个温度处理均设置3次重复。
1.4 表征测试分析
将样品用导电胶固定在样品台上,经喷金后放入特定位置,采用扫描电镜(SEM)和透射电镜(TEM)分析样品的形貌结构,采用能谱仪(EDS)分析样品表面元素,工作电压为30 kV,工作距离为10 mm,采集时间为100 s。经KBr压片后采用红外光谱(FTIR)分析样品的表面官能团[23],测量范围为400~4 000 cm-1,分辨率为4 cm-1,扫描温度为25 ℃,相对湿度保持在35%~45%,测定结果均通过基线校正后在相同波段下计算峰面积。采用德国Bruker AXS D8型X射线粉末衍射仪(Cu靶,Kα射线)分析样品的物相和结晶度[24-25],测试条件:Cu靶,Kα射线,40 kV管电压,40 mA管电流,扫描速度为10°·min-1,步长为0.02°,扫描范围为10°~90°,电压为45 kV,电流为200 mA。采用zeta电位分析仪(Nano Z)测定样品zeta电位值。
1.5 数据处理
所有处理均设置3个重复。采用Microsoft Excel 2010软件进行数据处理,采用Origin 2019软件绘图和进行方程拟合,采用SPSS 19.0软件进行统计分析。
2 结果与讨论
2.1 吸附动力学
图1显示,Hem对HA的吸附过程呈现先快后慢然后达到吸附平衡的状况,在吸附1 h内,HA浓度梯度较大,Hem表面活性位点多,使Hem对HA的吸附非常迅速(如Hem25~Hem40在吸附1 h内对HA吸附量分别占其总吸附量的87.24%、89.76%、94.16%和99.16%)。随着吸附反应的进行,Hem表面活性位点逐渐被占据,其表面HA与溶液中HA浓度差降低并且已被吸附HA向Hem内部扩散的速率也降低,使HA吸附量的增加趋势逐渐放缓,直至最终Hem吸附位点饱和,吸附达到平衡。不同温度条件下的吸附过程达到平衡的时间不同,Hem25~Hem40分别在吸附4、3、2和1 h时达到平衡,随着温度的升高,达到平衡的时间逐渐提前。

Hem25~Hem40分别为在25、30、35和40 ℃条件下吸附腐殖酸后的赤铁矿,qt为实测平衡吸附量。图1 赤铁矿对腐殖酸的吸附动力学过程Fig.1 Kinetics process of humic acid adsorption by hematite
Hem25~Hem40对HA的实测平衡吸附量分别为28.52、28.99、29.74和30.69 mg·g-1,吸附量随温度的升高而增加,这与以往他人[26]的研究结论相同,且在相同反应时间内,Hem25~Hem40吸附量也呈现随温度升高而增加的现象。分别采用准一级动力学模型和准二级动力学模型对动力学数据进行拟合,结果见表1,4个温度条件下Hem对HA的准二级动力学方程模拟获得的决定系数R2均大于准一级动力学方程模拟获得的R2,且根据准二级动力学方程计算得到的HA理论平衡吸附量qe都与实际平衡吸附量更为接近,说明准二级动力学方程能够用于更好地描述Hem对HA的吸附过程,表明Hem对HA的吸附过程主要受化学吸附的控制[27-29]。准二级动力学方程模拟结果表明,不同温度条件下理论平衡吸附量qe,cal由大到小依次为Hem40、Hem35、Hem30和Hem25。通常,准一级动力学模型对吸附的初级阶段描述更科学,准二级动力学模型对整个吸附过程的描述更真实全面[30]。采用准二级动力学模型拟合得到的吸附速率常数k2可以反映吸附过程的快慢,吸附速率常数k2越大,表明吸附过程越快,达到平衡所需时间也越短[31]。采用准二级动力学模型所模拟的不同样品对HA的吸附速率由大到小依次为Hem40、Hem35、Hem30和Hem25,这与实际吸附速率相吻合。该吸附速率常数k2随温度升高而逐渐增大,也表明升高温度有利于该吸附反应的进行,所以该吸附反应为吸热反应[32]。
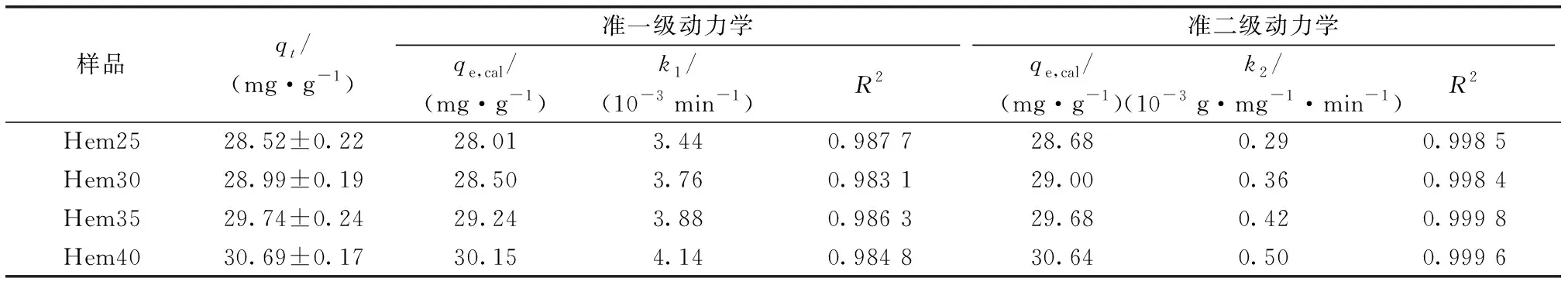
表1 赤铁矿对腐殖酸的吸附动力学模型拟合参数Table 1 Parameters of kinetics equations fitting humic acid adsorption by hematite
Hem25~Hem40分别为在25、30、35和40 ℃条件下吸附腐殖酸后的赤铁矿。qt为实测平衡吸附量,其值以平均值±标准差形式表示(n=3);qe,cal为理论平衡吸附量;k1和k2分别为准一级和准二级吸附速率常数;R2为决定系数。
2.2 赤铁矿的微观表征
2.2.1SEM表征和TEM表征
吸附前后Hem的SEM图和TEM图见图2。

a~e分别指Hem、Hem25、Hem30、Hem35和Hem40,Hem25~Hem40分别为在25、30、35和40 ℃条件下吸附腐殖酸后的赤铁矿。图2 吸附前后赤铁矿的扫描电镜(SEM)图和透射电镜(TEM)图Fig.2 SEM and TEM photograph of hematite before and after adsorption
吸附前Hem表面较为粗糙,呈菱形粒状和规则片状晶体,Hem25~Hem40表面均趋于光滑,颗粒呈不规则形状,以扁圆形和椭圆形为主;经超声分散后采用透射电镜观察,Hem~Hem40单粒粒径分别为112、204、220、268和291 nm,随着温度的升高,Hem单粒粒径逐渐增大。
2.2.2EDS表征
吸附HA前后Hem表面元素含量测定结果见表2,吸附前Hem含有少量C元素杂质,这是由于Hem在煅烧过程中,有少量表面活性剂未被烧尽而残留[33];Hem25~Hem40的C含量均大于Hem,并且随着温度的升高,Hem的C含量逐渐增加,Fe含量逐渐降低,C/Fe比值逐渐增大。

表2 吸附前后赤铁矿的元素含量Table 2 Elemental contents of hematite before and after adsorption
2.2.3FTIR表征
吸附HA前后Hem表面官能团测定结果见图3,吸附HA后Hem25~Hem40具有基本相同的特征吸收峰,表明它们的表面官能团种类大致相同。

Hem25~Hem40分别为在25、30、35和40 ℃条件下吸附腐殖酸后的赤铁矿。图3 吸附前后赤铁矿的红外光谱(FTIR)图Fig.3 Infrared spectra of hematite before and after adsorption
吸附前Hem主要吸收峰是3 400、536和466 cm-1,3 400 cm-1处吸收峰是Hem表面—OH的伸缩振动特征峰[34],为多分子缔合体中O—H振动,主要是由—OH与H2O产生的氢键[25]引起;536和466 cm-1处吸收峰是由Hem的Fe—O键所引起[35]。Hem25~Hem40原吸收峰位置均发生偏移,3 400、536和466 cm-1处分别偏移至3 420、537和467 cm-1处,3处吸收峰的峰强度和峰面积均发生改变,表明表面—OH和Fe—O键数量发生改变[36],这是由于HA与Hem表面—OH和Fe—O键发生作用使峰强度和峰面积发生变化[37]。

Hem25~Hem40分别为在25、30、35和40 ℃条件下吸附腐殖酸后的赤铁矿。


表3 吸附前后赤铁矿在不同吸收峰处峰面积Table 3 Peak area of hematite at different absorption peaks before and after adsorption
Hem25~Hem40分别为在25、30、35和40 ℃条件下吸附腐殖酸后的赤铁矿。

红外光谱结果表明随着温度的升高,腐殖酸和赤铁矿分子碰撞的机会增加[45],导致Hem表面羟基与HA中羧基、Hem表面Fe和HA中羧基等活性官能团更容易发生配体交换作用,导致更多HA吸附在Hem表面,这与马晓燕等[46]的结论相似。
2.2.4XRD表征
吸附HA前后Hem的XRD结果见图4,吸附HA前后Hem在2θ分别为24.12°、33.32°、35.55°、41.01°、49.56°、54.10°、57.66°、62.42°、63.99°、71.78°和75.44°处均出现明显的衍射峰,经过数据比对,所有衍射峰位置与XRD标准卡片(赤铁矿,Hematite卡片号03-0800)中赤铁矿的特征衍射峰相吻合,其分别对应(012)、(104)、(110)、(113)、(024)、(116)、(018)、(214)、(300)、(1010)和(220)晶面[47]。吸附前Hem衍射峰峰高较高,峰宽较窄,表明纯度较高,结晶性较好[48],Hem25~Hem40衍射峰位置与Hem基本一致,说明吸附HA后未改变Hem原有的晶型结构,但每个衍射峰峰强度均有所减弱。

Hem25~Hem40分别为在25、30、35和40 ℃条件下吸附腐殖酸后的赤铁矿。图4 吸附前后赤铁矿的X射线衍射(XRD)图Fig.4 XRD patterns of hematite before and after adsorption
吸附前后Hem结晶区面积和非结晶区面积计算[49]结果(表4)表明,随着温度的升高,Hem25至Hem40的结晶度逐渐降低,说明温度促进Hem对HA的吸附,包裹在Hem表面的HA吸附量进一步影响Hem结晶度。
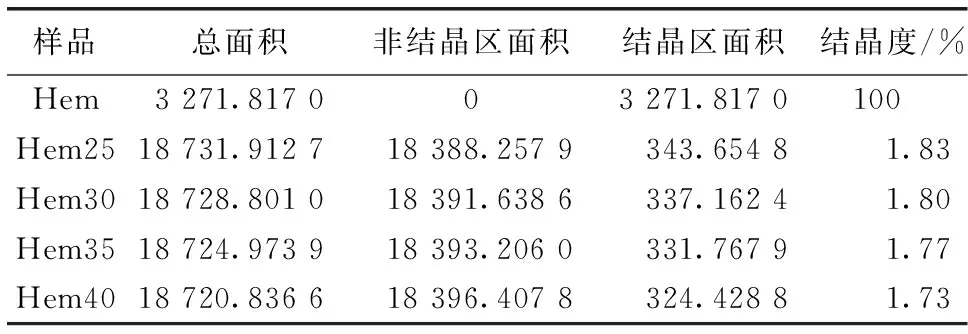
表4 吸附前后赤铁矿结晶度Table 4 Crystallinity of hematite before and after adsorption
结晶度为结晶区面积与总面积的比值,总面积为结晶区面积与非结晶区面积之和,Hem25~Hem40分别为在25、30、35和40 ℃条件下吸附腐殖酸后的赤铁矿。
2.2.5zeta电位
Hem25~Hem40的zeta电位数值均为负值(图5),这是由于带负电的HA被吸附在Hem表面后导致Hem整体也带负电[38]。电位值大小呈Hem35>Hem30>Hem25>Hem40,随着温度的升高,由Hem25到Hem35的zeta电位逐渐变大,但Hem40的zeta电位又出现变小的情况,这是由于Hem40对HA的吸附量最大,HA占据了Hem绝大部分吸附位点,使Hem的负电性增强。

Hem25~Hem40分别为在25、30、35和40 ℃条件下吸附腐殖酸后的赤铁矿。柱子上方英文小写字母不同表示不同Hem处理间zeta电位绝对值差异显著(P<0.5)。图5 吸附后赤铁矿的zeta电位Fig.5 Zeta potential of hematite after adsorption
3 结论
(1)25、30、35和40 ℃条件下赤铁矿对腐殖酸的实测平衡吸附量分别为28.52、28.99、29.74和30.69 mg·g-1,温度越高越有利于赤铁矿对腐殖酸的吸附。
(2)相较于准一级动力学模型,准二级动力学模型能更好地用于描述不同温度条件下赤铁矿对腐殖酸的吸附动力学特性,表明吸附速率主要由化学吸附机制决定。
(3)随着温度的升高,赤铁矿表面C/Fe比值逐渐变大,单粒粒径逐渐增大,结晶度不断下降,zeta电位值呈现先上升后下降的变化过程,表面不同官能团含量呈现不同的变化趋势。

