CT 影像组学联合临床及CT 特征预测胸腺上皮肿瘤TNM 分期
刘 晋,尹 平,王思聪,洪 楠*
[1.北京大学人民医院放射科,北京 100044;2.通用电气医疗(中国),北京 100176]
针对胸腺上皮性肿瘤(thymic epithelial tumor,TET)临床分期方法较多,国际癌症研究协会和国际胸腺恶性肿瘤兴趣小组提出的TNM 分期系统更为具体、规范[1],已获得美国癌症联合委员会和国际癌症控制联盟2017 年第8 版《恶性肿瘤TNM 分期》认可[2]。对早期(TNM Ⅰ~Ⅱ期)TET 可通过手术切除实现长期无复发生存,而对晚期(TNM Ⅲ~Ⅳ期)TET 多需采用跨学科、多模式治疗,包括根治性切除、辅助化学和放射治疗[3],准确预测TET TNM 分期至关重要。CT 是诊断TET 的重要影像学方法[4-5]。影像组学模型(radiomics model,RM)已广泛用于预测肿瘤病理分型、分期及淋巴结转移,以及患者预后等[6-7]。本研究观察以TET 的CT 影像组学联合临床资料及CT 特征预测其TNM 分期的价值。
1 资料与方法
1.1 研究对象 回顾性分析2012 年7 月—2021 年12月北京大学人民医院经手术病理证实的216 例单发TET 患者,男122 例、女94 例,年龄24~83 岁、平均(52.3±12.7)岁;均于术前1个月内接受胸部CT 扫描;以其中151 例TNM Ⅰ期者为早期组、27 例TNM Ⅲ期及38例Ⅳ期为晚期组(n=65)。排除CT 扫描前曾接受肿瘤相关治疗或图像质量差者。本研究经院伦理委员会批准(2023PHB154-001);检查前患者均知情同意。
1.2 仪器与方法 嘱患者仰卧、双臂上举,扫描时屏气。采用Philips Brilliance 256 层iCT(n=86)或 GE Lightspeed VCT(n=130)64 层CT 机 行胸部非增强CT(non-contrast-enhanced CT,NECT)扫描,管电压120 kV,自动管电流或管电流150 mA,层厚5 mm,层间距0.980 mm/0.516 mm,重建层厚 1 mm/0.625 mm。之后采用高压注射器以3.0 ml/s 流率经前臂静脉注射对比剂碘溴胺或碘己醇(300 mgI/ml)1.0 ml/kg 体质量,延迟60 s 采集增强CT(contrast-enhanced CT,CECT)。
1.3 图像分析 由具有5 或10 年胸部影像学诊断经验的主治医师(医师1)和副主任医师(医师2)各1 名采用双盲法独立观察CT 表现,包括病灶长径、短径(于肿瘤最大层面测量),病灶内有无钙化及囊变、周围脂肪浸润,有无胸腔积液及纵隔淋巴结肿大(以淋巴结短径>1 cm 为标准)。2 名医师评估结果有分歧时,经协商统一意见。
1.4 分割肿瘤 将CT 数据导入ITK-SNAP 软件(3.6.0 版本,www.itksnap.org)手动分割肿瘤。由医师1 于NECT 及CECT 中逐层手动勾画病灶ROI(图1),含边缘毛糙和周围脂肪浸润区域,获得相应感兴趣容积(volume of interest,VOI);由医师2 进行审核。
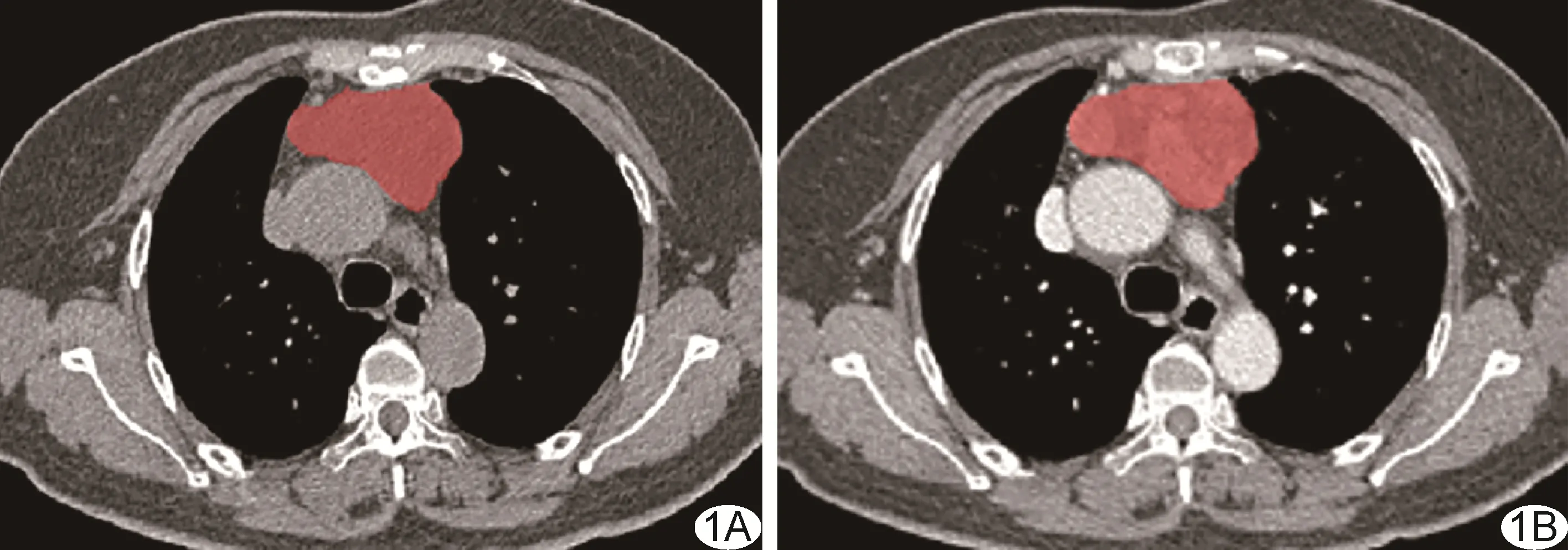
图1 分割肿瘤ROI 示意图 A、B.于胸部轴位NECT(A)及CECT(B)中逐层勾画肿瘤ROI(红色区域)示意图
1.5 提取及筛选特征 应用GE AK 软件(3.3.0 版本)分别基于NECT 和CECT 提取1 338 个影像组学特征,以组内相关系数(intra-class correlation coefficient,ICC)分析基于不同CT 设备所获CT 影像组学特征的一致性,保留ICC≥0.75 的特征。对特征进行预处理及归一化,特征值超过时,以特定方差向量的中值加以替换;采用最大相关最小冗余法消除冗余及不相关特征,之后以最小绝对收缩和选择算子算法筛选最优影像组学特征。
1.6 统计学分析及构建模型 采用R(版本3.5.1)和Python(版本3.5.6)软件进行统计学分析。以中位数(上下四分位数)表示不符合正态分布的计量资料,组间行Mann-WhitneyU检验。采用χ2检验或Fisher 精确概率法比较计数资料。
分别基于NECT 和CECT 所获最优影像组学特征以逻辑回归方法构建二分类RM,获得RMNECT和RMCECT;分别基于组间差异有统计学意义的临床、CT特征及RM 构建RMNECT-临床、RMCECT-临床、RMNECT-临床-CT及RMCECT-临床-CT。按7∶3 比例将全部患者分为训练集(n=151)及验证集(n=65),采用5 折交叉验证方法于训练集对上述模型进行训练,并以验证集评估模型预测TET TNM 分期的效能。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC)评估各模型预测效能。P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料 2 组患者症状差异有统计学意义(P<0.05),性别及年龄差异均无统计学意义(P均>0.05)。见表1。
2.2 CT 表现 组间病灶周围脂肪浸润、纵隔淋巴结肿大及胸腔积液差异均有统计学意义(P均<0.05),见表2。
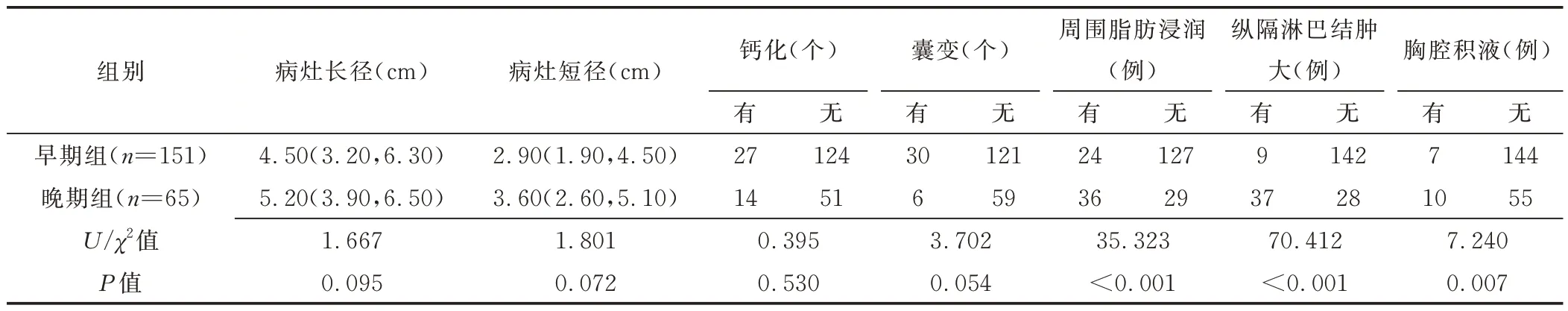
表2 216 例TET 患者CT 表现比较
3.3 构建模型及评估效能 经ICC检验分别保留基于NECT 及CECT 获得的1 125 个及1 218 个影像组学特征,再经最大相关最小冗余法分析各保留20 个特征,以最小绝对收缩和选择算子算法分别选出2 个及9个最优特征(图2)以构建RM。训练集中,RMNECT-临床-CT预 测TET TNM 分期的AUC(0.873)高 于RMNECT及 RMNECT-临床(AUC=0.642、0.784,Z=4.445、3.689,P均<0.001),RMCECT-临床-CT的AUC(0.882)高于RMCECT及RMCECT-临床(AUC=0.714、0.773,Z=4.143、3.847,P均 <0.001);验证集中,RMNECT-临床-CT的AUC(0.864)高 于RMNECT及 RMNECT-临床(AUC=0.634、0.721,Z=3.081、2.937,P=0.002、0.003),RMCECT-临床-CT的AUC(0.920)高 于 RMCECT及RMCECT-临床(AUC=0.689、0.751,Z=2.698、2.390,P=0.007、0.017)。见图3 及表3。
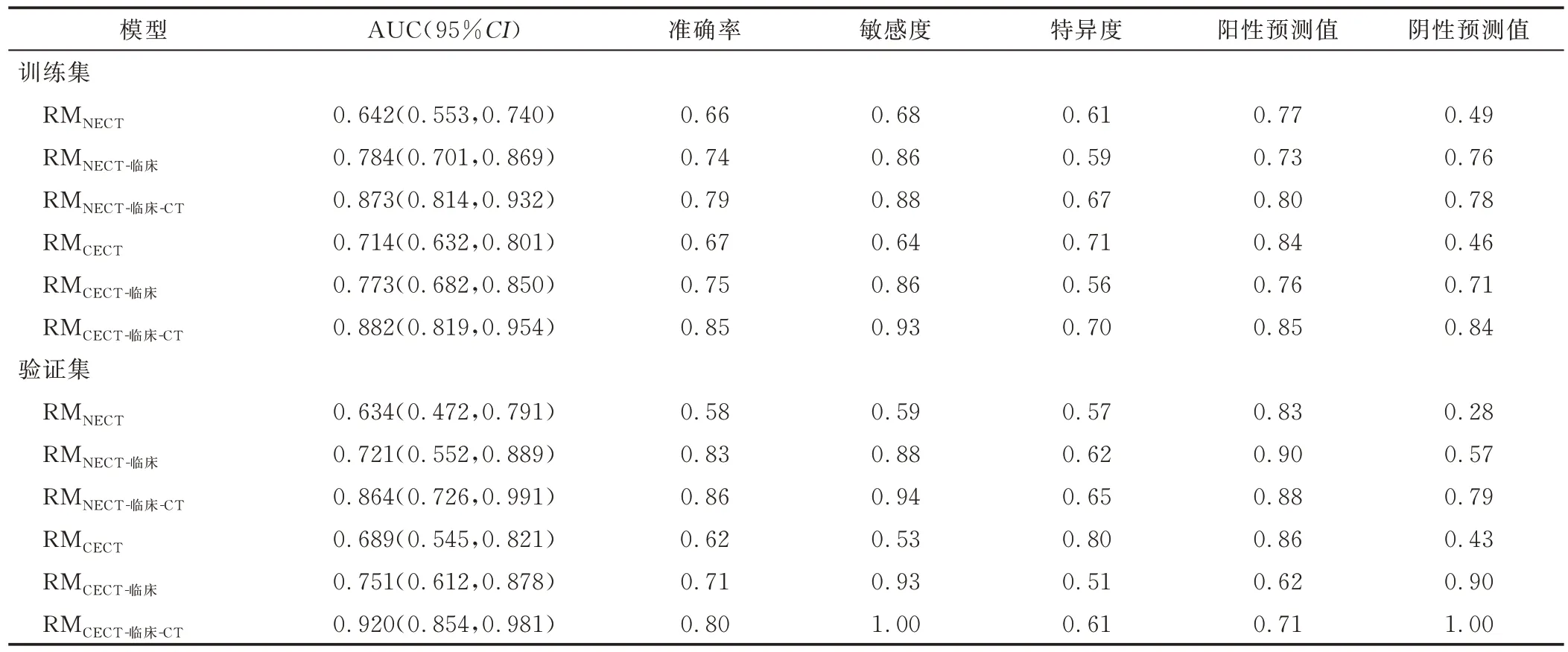
表3 各模型预测TET TNM 分期效能
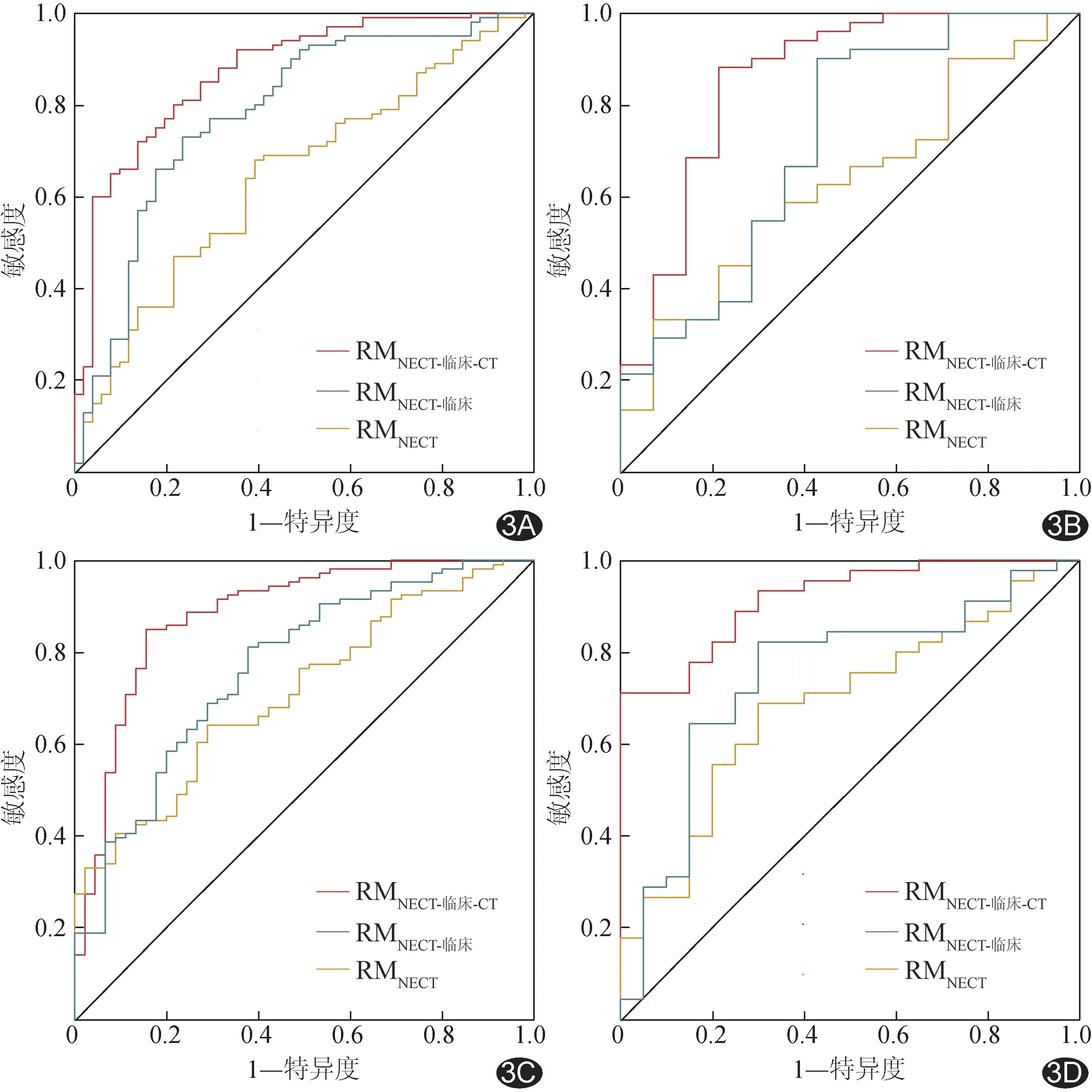
图3 各模型预测TET TNM 分期的ROC 曲线 A、B.RMNECT、RMNECT-临床、RMNECT-临床-CT 在训练集(A)及验证集(B);C、D.RMCECT、RMCECT-临床、RMCECT-临床-CT在训练集(C)及验证集(D)
3 讨论
重症肌无力是TET 主要临床表现之一,而早期TET 患者常无明显临床症状[8]。本研究中,仅14例患者(14/216,6.48%)临床表现为重症肌无力,且相比早期组,晚期组CT 显示病灶周围脂肪浸润、纵隔淋巴结肿大及胸腔积液者占比更高。由于临床准确区分早期与晚期TET 存在一定难度,使得寻找可用于术前评估TET TNM 分期的定量参数至关重要。
基于肿瘤异质性,影像组学可非侵入性地定量分析肿瘤特征,监测肿瘤发生、发展及其对于治疗的反应,以协助临床制定治疗方案[9-11]。既往研究[12-13]以影像组学进行TET 分期及风险分类等,获得良好效果。本研究分别基于216 例TET 患者的NECT 和CECT 构建RM 预测TET TNM 分期,结合临床及CT 特征分别构建临床-影像组学及临床-CT-影像组学模型,所获RMNECT和RMCECT在验证集的AUC 分别为0.634 及0.689,低于BLÜTHGEN 等[12]结果(AUC=0.838),可能与所提取影像组学特征、分类方法或检查方法不同有关;RMNECT-临床和RMCECT-临床在验证集的AUC 分别为0.721、0.751,而RMNECT-临床-CT和RMCECT-临床-CT在验证集的AUC 分别为0.864 及0.920,高于其他模型,表明RM 结合临床及CT 特征可提高效能,为鉴别TET TNM 分期提供更多依据。
综上所述,CT 影像组学联合临床资料及肿瘤CT特征能有效预测TET TNM 分期。但本研究为单中心回顾性分析,样本量有限,有待后续通过多中心、前瞻性多模态成像研究进一步观察。
利益冲突:全体作者声明无利益冲突。
作者贡献:刘晋研究设计和实施、查阅文献、图像分析、撰写文章;尹平指导、研究设计、图像分析、修改文章;王思聪图像处理、数据和统计分析;洪楠指导、研究设计、审阅文章。

