促性腺激素释放激素类似物治疗下丘脑错构瘤导致性早熟5例临床分析
伊 鹏,李翠玲,黄新疆,曾春华
(广州医科大学附属妇女儿童医疗中心 广东省儿童健康与疾病临床医学研究中心,广东 广州 510623)
下丘脑错构瘤(hypothalamic hamartoma,HH)又称灰结节错构瘤、下丘脑神经元错构瘤。错构瘤不是真正的肿瘤,是器官内正常组织的错误组合与排列。错构瘤生长缓慢,可发生在全身任何部位,极少恶性变。HH主要由异位脑灰质、神经元、神经胶质细胞和纤维束等组成。发病率约为 1/50万~1/100万,多数在婴幼儿期发病,男女比例约1.52∶1[1]。2007年世界卫生组织在关于中枢神经系统肿瘤的分类中,将HH归于类肿瘤病变[2]。其临床表现主要为中枢性性早熟和痴笑样癫痫。此外,也有部分HH患儿伴发认知功能障碍和其他类型癫痫(如癫痫大发作、全身发作等),也见无症状病例报道[3]。
既往主张表现为单纯性早熟的HH患儿首选手术治疗。自1980年,促性腺激素释放激素类似物 (gonadotropin releasing hormone analogue, GnRHa)成为中枢性性早熟的首选治疗方案[3-4]。本文通过对GnRHa治疗HH导致性早熟患儿5例进行回顾性分析,旨在为临床提供依据。
1 资料与方法
1.1病例选择 选取2017年5月至2021年5月广州医科大学附属妇女儿童医疗中心诊治的HH患儿5例。纳入标准:①有性早熟的临床表现:女孩表现为乳腺发育,阴道出血,阴毛生长等。男孩表现为睾丸阴茎增大,阴毛生长等。②头颅磁共振成像(magnetic resonance imaging,MRI)检查明确诊断HH。③排除其他疾病因素以及饮食药物因素导致的性早熟的可能。
1.2资料收集和治疗方案 收集患儿的一般资料和临床表现(性别、身高、体重、初诊年龄、主要症状、主要体征、初诊骨龄、头颅MRI检查)、实验室检查、疗效评价。
1.2.1实验室检查 GnRHa激发试验采用的药物是醋酸曲普瑞林注射液0.1 mg,静脉注射,剂量按照2.5 μg/kg,最大不超过0.1 mg。若促黄体生成素(luteinizing hormone,LH)基础值大于10 IU/L,不再进行性激素激发实验。于注射前(基础值)和注射后30、60、90、120 min分别采血测定血清促卵泡激素(follicle stimulating hormone, FSH)和LH。当LH峰值大于10 IU/L认为性腺轴功能已经启动,判定为中枢性性早熟。当患儿使用GnRHa治疗3次后复查简易GnRHa激发试验,只采集注射前(基础值)和注射后60 min的血,测定血清FSH和LH。
1.2.2治疗方案 ①使用醋酸亮丙瑞林注射液(3.75 mg)或醋酸曲普瑞林注射液(3.75 mg)抑制性发育治疗, 起始剂量约为100 μg/kg,每月1针。根据后续性发育的变化情况,调整药物的剂量。维持剂量100 μg/kg,如果性发育明显减缓,将给以药物减量至60~80 μg/kg。根据每个患儿的情况,给以复查子宫卵巢超声,性激素,骨龄。②避免服用人参、燕窝、鹿茸、动物卵巢胎盘等。避免大量使用糖皮质激素类药物,避免误服避孕药物。
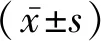
2 结 果
2.1一般资料和临床表现 5例患儿中,女性3例,男性2例。初诊年龄为6月~8岁。女童主要表现为乳腺发育和阴道出血,男童主要表现为阴茎睾丸增大。初诊骨龄均有超前,头颅MRI检查均发现下丘脑灰结节区有占位性病变。见表1。

表1 患儿一般资料
2.2实验室检查 5例患儿均行GnRHa激发试验和简易GnRHa激发试验,见表2~3。

表2 GnRHa激发试验
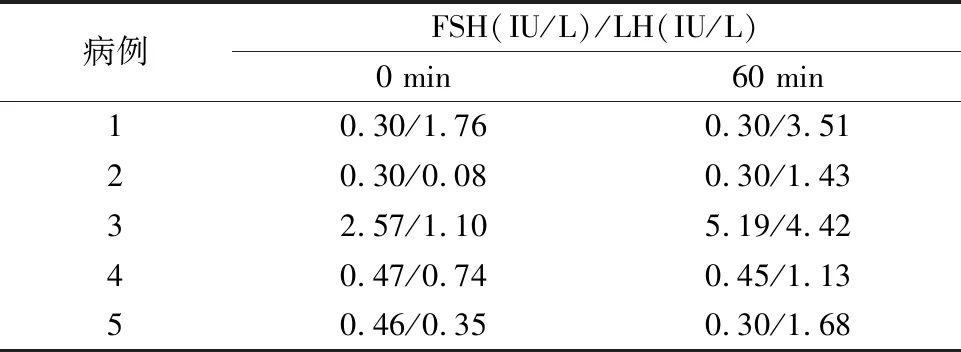
表3 简易GnRHa激发试验
2.3疗效评价 5例患儿性激素水平均明显下降。病例1月经消失,乳腺从B2期减小到B1期。病例2和5的阴茎睾丸没有进一步增大。病例3和4乳腺从B3期减小到B2期。见表4。

表4 治疗药物效果评价
经过治疗3次以后,总体FSH和LH值均获得明显下降。除LH 0 min,治疗后FSH 0 min,FSH 60 min及LH 60 min较治疗前降低,差异均具有统计学意义(P<0.05)。见表5。
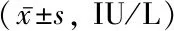
表5 FSH和LH治疗前后比较
3 讨 论
HH并非真正的肿瘤,而是一种异位的神经组织块,起源于下丘脑乳头体和灰结节间,向下生长至脚间窝的蛛网膜下腔,由内分泌神经元纤维和胶质细胞构成[5]。国外报道女性多于男性。本病多在儿童期发病,主要临床表现为痴笑样癫痫,性早熟,行为异常及智力低下等[6]。痴笑样癫痫表现为发作性傻笑,持续数秒或者数十秒,发作时意识清醒,每天可反复发作。女孩性早熟表现为乳腺发育,阴毛生长,月经初潮等。男孩性早熟表现为阴囊阴茎增大,外阴色素沉着,阴毛生长等。性早熟是由于错构瘤可释放促性腺激素释放激素,进而刺激垂体分泌促性腺激素所导致。痴笑样癫痫与错构瘤有异常放电或错构瘤分泌致痫神经肽有关。也要注意HH少见的临床表现,比如阵发性强直性眼偏斜[7],糖尿病[8],婴儿痉挛[9],神经纤维瘤[10]。
HH发病原因可能为中线神经管闭合不全所致。它可单独存在,也可以同时伴有其他发育异常,如胼胝体缺如,视隔发育不良,灰质异位和大脑半球发育不良等。MRI检查显示脚间池内相当于乳头体,灰结节和垂体柄处有等信号肿物。HH分为2个类型:Ⅰ型为“有蒂型”,表现为HH附着于灰结节、乳头体或两者间,下丘脑无变形,此类患者表现为性早熟或无症状,首选药物治疗;Ⅱ型为“无蒂型”,指HH有广泛的基底面并长入下丘脑和第三脑室,导致下丘脑和第三脑室变形,此类患者表现为痴笑样癫痫及认知功能障碍,首选手术切除病灶[11]。
通过全外显子测序的方式检测切除的错构瘤标本和外周血,在37%的HH导致的痴笑样癫痫患者中,可发现位于Hedgehog信号通路上的基因突变[12],例如GLI3基因突变[13]。GLI3基因突变会导致pallister hall综合征,其临床表现包括HH,垂体功能减退,会厌分叉,肛门闭锁,并指(趾)及多指(趾)畸形。有学者在HH患者中发现了染色体6p25.1-25.3区域的序列重复,考虑可能为致病的遗传因素[14]。
自1980年,如HH患儿只表现为性早熟,未合并癫痫等其他症状,首选治疗方案为单独使用GnRHa,不建议手术治疗[15-16]。但是药物治疗的缺点是费用高,每年需要2万元左右。每个月需要打针,用药时间长,需要持续到正常的青春期年龄。手术治疗适用于以下性早熟患者:①GnRHa治疗不能控制性早熟者;②虽然GnRHa治疗可以控制性早熟,但是患者在用药期间,又出现了痴笑样癫痫等神经系统症状;③患者家庭无法承担长期药物治疗的经济成本和时间成本。如果HH患儿一开始就表现为癫痫,则就首选手术治疗[17-18],另外也有多种新的手术方式可供选择,如神经内镜离断术、伽玛刀照射、射频热凝术、激光间质热疗等。
有研究报道14例HH导性早熟患儿接受GnRHa治疗后,追踪到成人期,均达到了正常的成年身高,未合并生殖系统疾病[19]。杨培蓉等[20]使用醋酸曲普瑞林注射液治疗4例HH致性早熟患儿,患儿的性发育均获得明显的抑制。本研究5例患儿症状均获得了良好控制,家长对于治疗效果满意,患儿成年期的身高还需要进一步的追踪。

