脓毒症患儿血SAA、sTREM-1、NLR、PGRN的变化及预后因素分析
廉 稳,温慧敏
(河北中石油中心医院新生儿科,河北 廊坊 065000)
脓毒症是一种严重的感染性疾病,会导致全身炎症反应综合征和器官功能衰竭,其发病率较高,尤其是在新生儿中更加常见[1]。脓毒症患儿通常表现出呼吸急促、心跳过快、发热、乏力、厌食等症状[2]。对于重症患者,可能还会出现低血压、神志淡漠、休克等症状,尽早对其诊断和治疗非常关键[3]。目前,诊断脓毒症的手段主要包括临床表现、实验室检查和影像学检查等[4]。但是,对于一些早期脓毒症或者轻微病例来说,诊断可能比较困难[5]。因此,新的生物标志物和检测技术正在不断发展,以帮助更准确地诊断和治疗该疾病。可溶性髓样细胞触发受体-1(soluble triggering receptor expressed on myeloid cell-1,sTREM-1)作为炎症标志物,已被证明在早期诊断脓毒症方面具有一定的价值[6];淀粉样蛋白A(serum amyloid A,SAA)也是一种常见的炎症标志物,其水平通常会随着炎症程度的加重而升高[7];中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)则反映了机体中炎症性细胞和免疫细胞之间的平衡,其水平升高通常意味着机体炎症反应的增强[8];颗粒体上皮蛋白前体(progranulin,PGRN)是一种与炎症相关的前体蛋白,其水平的升高也被认为与脓毒症的发生和发展有关[9]。因此本研究通过探讨脓毒症患儿SAA、sTREM-1、NLR、PGRN与预后的关系,并分析其对脓毒症的诊断价值,以期为临床新生儿脓毒症诊疗提供思路,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2019年1月至2022年12月河北中石油中心医院收入的脓毒血症患儿120例为观察组,另匹配同时间段非脓毒症健康新生儿46例为健康组。观察组纳入标准:①年龄在28d以内,属新生儿期;②入院明确诊断为脓毒症,存在两项及以上临床表征,如体温>38℃或<36.5℃,心率>180次/min,呼吸频率>60次/min,收缩压<70mmHg,动脉血二氧化碳分压<32mmHg,外周血白细胞总数≥18 000/mm3或<5 000/mm3;③伴随全身症状,如有意识改变,高血糖表现,水肿表现等;④胎龄<32周,出生体重<1 500g;⑤器官功能障碍。排除标准:①合并恶性肿瘤;②合并自身免疫疾病;③合并中性粒细胞减少症;④入住重症监护病房后24h内死亡。本研究对照组男26例,女20例;年龄14~28d,平均(22.15±5.16)d。观察组男64例,女56例;年龄17~28d,平均(23.01±2.19)d。两组受试者性别、年龄比较无显著差异(P>0.05),具有可比性。本研究符合《赫尔辛基宣言》内容,受试者家属均签署知情同意书。
1.2 研究方法
采集所有受试者静脉血样本:从新生儿的肘部或手腕处,进行消毒后使用一根无菌的针头采集适量的静脉血。将采集到的静脉血置于室温下15~30min,等待血液凝固后,用离心机分离出血清。在适当的实验室条件下采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定血清SAA、sTREM-1、NLR、PGRN水平。
1.3 统计学方法
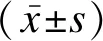
2 结果
2.1 两组受试者SAA、sTREM-1、NLR、PGRN水平比较
与健康组比较,观察组患儿SAA、sTREM-1、NLR水平更高,PGRN水平更低,差异有统计学意义(t值分别为44.598、7.137、7.141、-16.695,P<0.05),见表1。
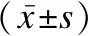
表1 两组受试者SAA、sTREM-1、NLR、PGRN水平比较
2.2 不同预后患儿一般资料比较
与存活组相比,死亡或放弃治疗组患儿入院心率、入院呼吸频率、胎龄≤28周占比、SAA、sTREM-1、NLR水平更高,PGRN水平、入院氧饱和度更低,差异有统计学意义(χ2/t值介于-5.388~9.038之间,P<0.05);两组患儿性别、年龄、出生体重比较差异无统计学意义(P>0.05),见表2。
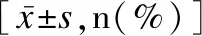
表2 不同预后患儿一般资料比较
2.3 影响脓毒症患儿预后的二元Logistic回归分析
以入院心率、入院呼吸频率、SAA、sTREM-1、NLR、PGRN、氧饱和度、胎龄(≤28周=1,>28周=0)为自变量,以脓毒症患儿预后(死亡或放弃=1,存活=0)为因变量,多因素Logistic回归分析结果显示入院心率、SAA、sTREM-1、NLR是影响脓毒症患儿预后的危险因素,其OR值及95%CI分别为1.534(1.203~1.955)、1.037(1.017~1.058)、1.255(1.052~1.496)、1.755(1.228~2.507),氧饱和度、PGRN是影响脓毒症患儿预后的保护因素,其OR值及95%CI分别为0.282(0.142~0.560)、0.926(0.884~0.970),见表3。

表3 影响脓毒症患儿预后的二元Logistic回归分析
2.4 SAA、sTREM-1、NLR、PGRN水平预测脓毒症患儿发展结局的ROC曲线分析
SAA、sTREM-1、NLR、PGRN预测脓毒症患儿发展结局的曲线下面积(area under the curve,AUC)分别为0.804、0.718、0.873、0.780,联合预测的曲线下面积为0.928,联合预测的灵敏度为0.731,特异度为0.947,见表4及图1。
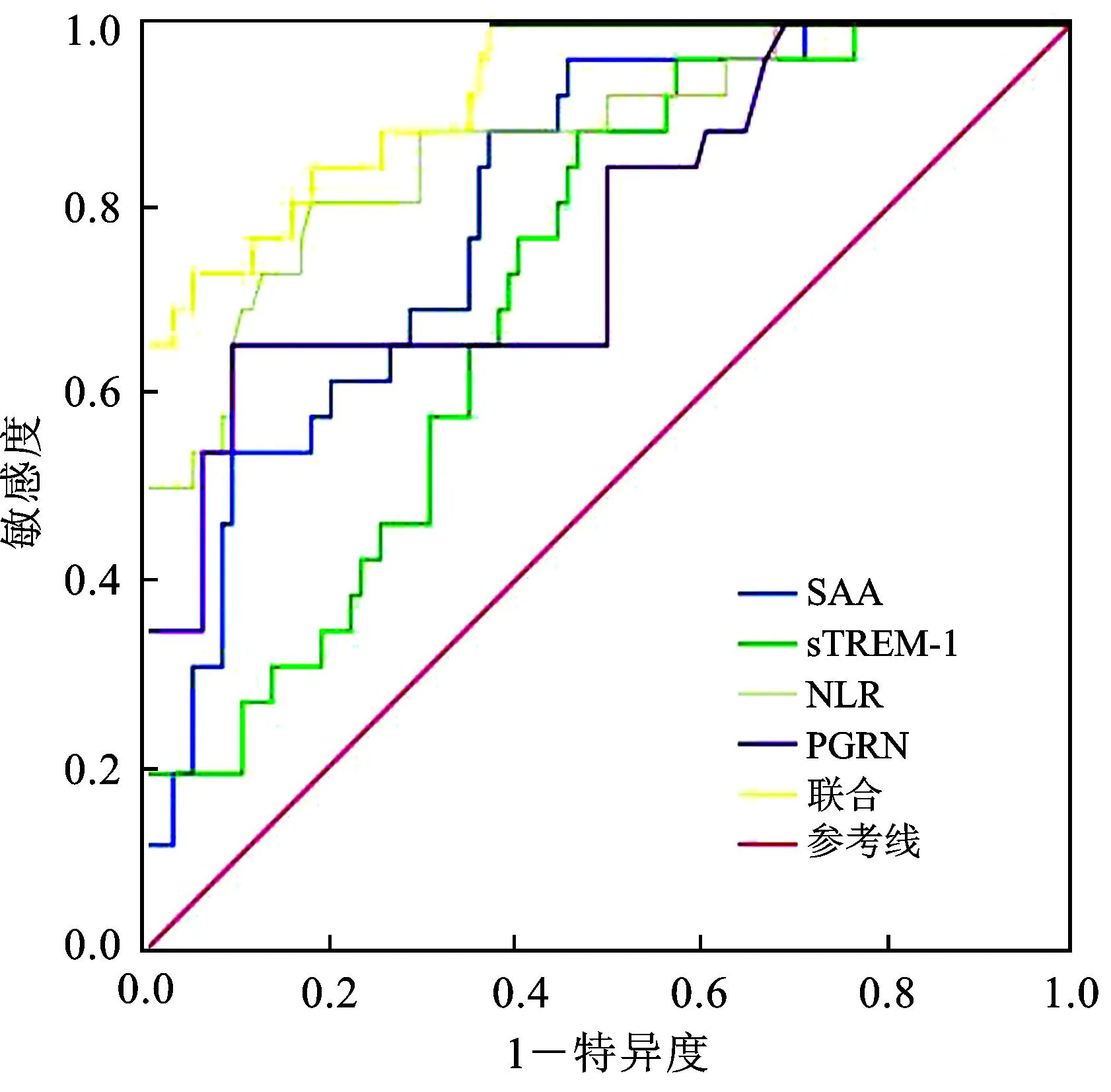
图1 SAA、sTREM-1、NLR、PGRN单独及联合预测患儿结局的ROC曲线
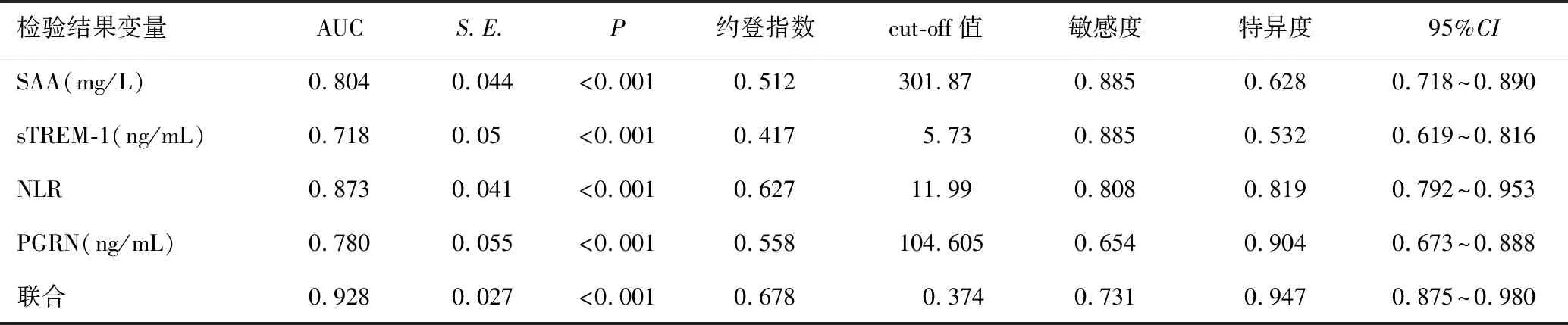
表4 SAA、sTREM-1、NLR、PGRN预测脓毒症患儿结局的ROC曲线分析
3 讨论
对于脓毒症患儿的预后,尽早诊断和治疗非常关键。一些研究表明,脓毒症的死亡率随着病情的严重程度而增加[10]。虽然部分患儿可以通过早期诊断和治疗获得良好的预后,但也有部分患儿出现长期伤害和并发症[11]。例如,多器官功能衰竭可能导致肺部感染、急性肾损伤、中枢神经系统损伤等。目前,诊断脓毒症的手段主要包括临床表现、实验室检查和影像学检查等[12]。但是,对于一些早期脓毒症或者轻微病例来说,诊断可能比较困难[13]。因此,新的生物标志物和检测技术正在不断发展,以帮助更准确地诊断和治疗该疾病。
3.1 脓毒症患儿血SAA、sTREM-1、NLR、PGRN与健康人群的差异
sTREM-1水平升高提示机体炎症反应较强,并且有一定的预测价值。一些研究表明,sTREM-1与脓毒症患者死亡率呈正相关[14]。SAA水平可以反映机体内炎症反应的强度,其水平升高也被认为与脓毒症患儿的预后不良有关。NLR水平升高可能提示机体内中性粒细胞和淋巴细胞的平衡失调,从而影响机体免疫功能,在脓毒症的发生和治疗中可能会起到一定的预测作用。另外,PGRN可以抑制细胞凋亡和促进炎症反应,因此可能参与脓毒症的发生和发展过程。
本研究结果发现,与健康组比较,观察组患儿SAA、sTREM-1、NLR水平明显更高,PGRN明显更低,差异有统计学意义。脓毒症患儿血SAA、sTREM-1、NLR水平较健康新生儿有异常升高,PGRN降低的原因可能是机体对感染的免疫反应过度激活,导致炎症介质分泌增加,包括细胞因子、趋化因子等等。这些分子可以诱导血液中各种白细胞的激活并趋向感染部位,以应对感染所带来的挑战。但如果这种免疫反应过度激活,就可能导致炎症反应失控,引发组织损伤和多器官功能障碍。
3.2 血SAA、sTREM-1、NLR、PGRN与脓毒症患儿预后的关系
与存活组相比,死亡或放弃治疗组患儿入院心率、入院呼吸频率、SAA、sTREM-1、NLR、PGRN水平更高,入院氧饱和度更低,胎龄≤28周占比更大。多因素Logistic回归分析显示入院心率、SAA、sTREM-1、NLR、PGRN、氧饱和度是脓毒症患儿预后的影响因素。其中,入院时心率的增加通常与炎症反应的加剧和组织损伤的程度相关,因此预示着患儿病情较严重。血液中SAA、sTREM-1、NLR水平增加,PGRN降低则反映了机体内炎症反应过度激活,从而提示患儿病情严重。氧饱和度的降低可以反映患儿组织缺氧的程度,这也是多器官功能衰竭的重要原因之一。胎龄低的患儿由于免疫系统尚未完全发育,可能会对感染更为敏感,因此需要更严密的监护和治疗。
3.3 血SAA、sTREM-1、NLR、PGRN预测患儿结局的价值
ROC曲线分析结果显示,SAA、sTREM-1、NLR、PGRN单独及联合预测患儿预后不良的曲线下面积分别为0.804、0.718、0.873、0.780、0.928,提示SAA、sTREM-1、NLR、PGRN预测脓毒症患儿结局均有一定临床参考价值。SAA是一种急性期蛋白,在发生急性炎症或感染时会快速升高,可以反映炎症的早期过程。脓毒症患儿血SAA水平升高意味着机体对感染做出了强烈的炎症反应,该指标可用于评估脓毒症患儿疾病严重程度。sTREM-1水平是一种单核细胞表面上的分子,通常只在炎症和感染过程中才会表达出来,可以反映炎症局部的严重程度。脓毒症患儿血sTREM-1水平升高提示机体出现了严重的炎症反应,因脓毒症患儿sTREM-1升高意味着患儿病情的加重。血NLR水平可以反映出机体内炎症反应的强度。PGRN水平是一种细胞因子,可以抵制炎症反应并促进组织修复和再生。脓毒症患儿血PGRN水平降低可能会加重机体内炎症反应和损伤,加重脓毒症的严重程度。
总之,这些指标可以作为判断脓毒症患儿是否存在预后不良的参考指标。但需要注意的是,单一指标不能作出完全准确的预测,需要多个指标结合临床表现和其他检查结果进行综合评估。

