复发性流产风险基因的临床应用价值
徐梦梦,牛 惠,2,朱思静,向婉婉,2,冯佳圆,2,李晓雪,3,孙兰迪,2,张博星,2,杨文方
(1.西安交通大学第一附属医院妇产科/妇幼中心,陕西 西安 710061;2.西安交通大学医学部公共卫生学院,陕西 西安 710061;3.天津医科大学,天津 300070)
复发性流产(recurrent spontaneous abortion,RSA)是指与同一性伴侣连续发生3次及以上的自然流产,但RSA的定义目前尚不统一。2022年复发性流产诊治专家共识建议,将与同一配偶连续发生2次及以上,在妊娠28周之前的妊娠丢失定义为 RSA,包括生化妊娠;英国皇家妇产科医师协会将复发性流产定义为连续发生3次及以上在妊娠24周之前的妊娠丢失,包括生化妊娠,但未明确妊娠定义;美国生殖医学学会将复发性流产定义为连续发生2次及以上的妊娠丢失,需为超声或组织学确认的宫内妊娠[1]。据估计,全球每年发生约2 300万例流产,复发性流产的患病率约为2.6%[2],中国、美国和瑞典的流产发生率似乎在增加,1%~5%的育龄妇女受到影响[3]。复发性流产不仅给夫妇双方带来巨大的心理压力,同时也给家庭、社会和公共卫生系统带来沉重负担。
RSA 病因复杂,约50%的RSA原因未明[3],夫妇年龄和流产次数对流产风险有明显影响。未有流产史的妇女流产风险最低,而每增加1次流产,再次流产的风险增加约10%,有3次或3次以上流产史的妇女流产风险达到约42%[2]。影响RSA的因素包括解剖、血栓前状态、内分泌、免疫、遗传、环境、生活方式、心理状况和男性因素等[4]。为了探索RSA的风险因素并挖掘其致病机制,越来越多的研究深入探索了遗传因素与反复流产的关联。然而,目前还没有高质量证据支持的复发性流产的高效监测和治疗方法。因此,我们仍需要明确与流产相关的致病基因,筛选风险易感基因,并寻找RSA的系统风险评估方法,以便制定个体化治疗方案。
1 RSA风险预测
目前对于复发性流产的风险评估,常采用临床因素构建预测评分模型,其中包括既往流产次数、年龄、体重指数、吸烟饮酒状况以及膳食补充剂摄入量等风险因素[5]。一些研究发现,血栓形成相关的凝血纤溶系统指标,如凝血酶时间、活化部分凝血活酶时间和D-二聚体等,在一定程度上能准确有效地预测复发性流产的血栓形成风险[6]。此外,胎心率、超声特征等也被发现可以作为预测因子,预测妊娠丢失的风险[7-8]。复发性流产是一种复杂的疾病,其发生受到基因和环境因素相互作用的影响。尽管常规风险因子有助于优化可改变的因素,降低自然流产的风险,但不能忽略遗传因素在RAS发生过程中的重要性。因此,评估遗传因素的疾病风险,并综合考虑临床因素和遗传因素的相互作用,对于整体风险评估是非常必要的[5-6]。
近年来,遗传因素在疾病预测中的应用与价值倍受关注。研究不再局限于评估单基因与疾病的关联性,而是通过多种基因检测及统计学分析来探索基因相互作用,进而提高遗传因素预测疾病风险的准确性,推动了其在预测人群疾病风险的临床应用。研究表明[9],心脏代谢疾病与多个单核苷酸多态性相关,通过加权多基因风险分析,可以提高疾病预测的准确性,且当遗传风险评估被添加到临床风险模型中时,疾病预测能力可能更强。不明原因的复发性流产是一种可能受多基因影响的复杂疾病,基因互作及其与环境的相互作用在RSA的发生发展中起到重要作用。然而,目前多数研究仅关注单个基因与RSA的关联性,缺乏一个结合遗传和临床因素的复发性流产风险的高效预测模型。因此,迫切需要明确与RSA相关的风险基因,并综合这些基因的相互作用,将遗传因素与临床因素相结合,以构建一个准确高效的风险预测模型,深入挖掘遗传因素在临床中的应用价值。
2 RSA风险基因多态性
为了构建高效的风险预测模型,评估遗传因素在RSA风险预测的作用,全面系统地了解并选择适合的候选遗传标记是关键步骤之一。高质量的遗传关联研究已发现大量的风险易感位点,为从遗传层面进行RSA风险预测奠定了基础。本文总结了RSA的风险基因位点,以及其突变的功能后果和在gnomAD数据库中的次要等位基因频率(minor allele frequency,MAF),见表1。
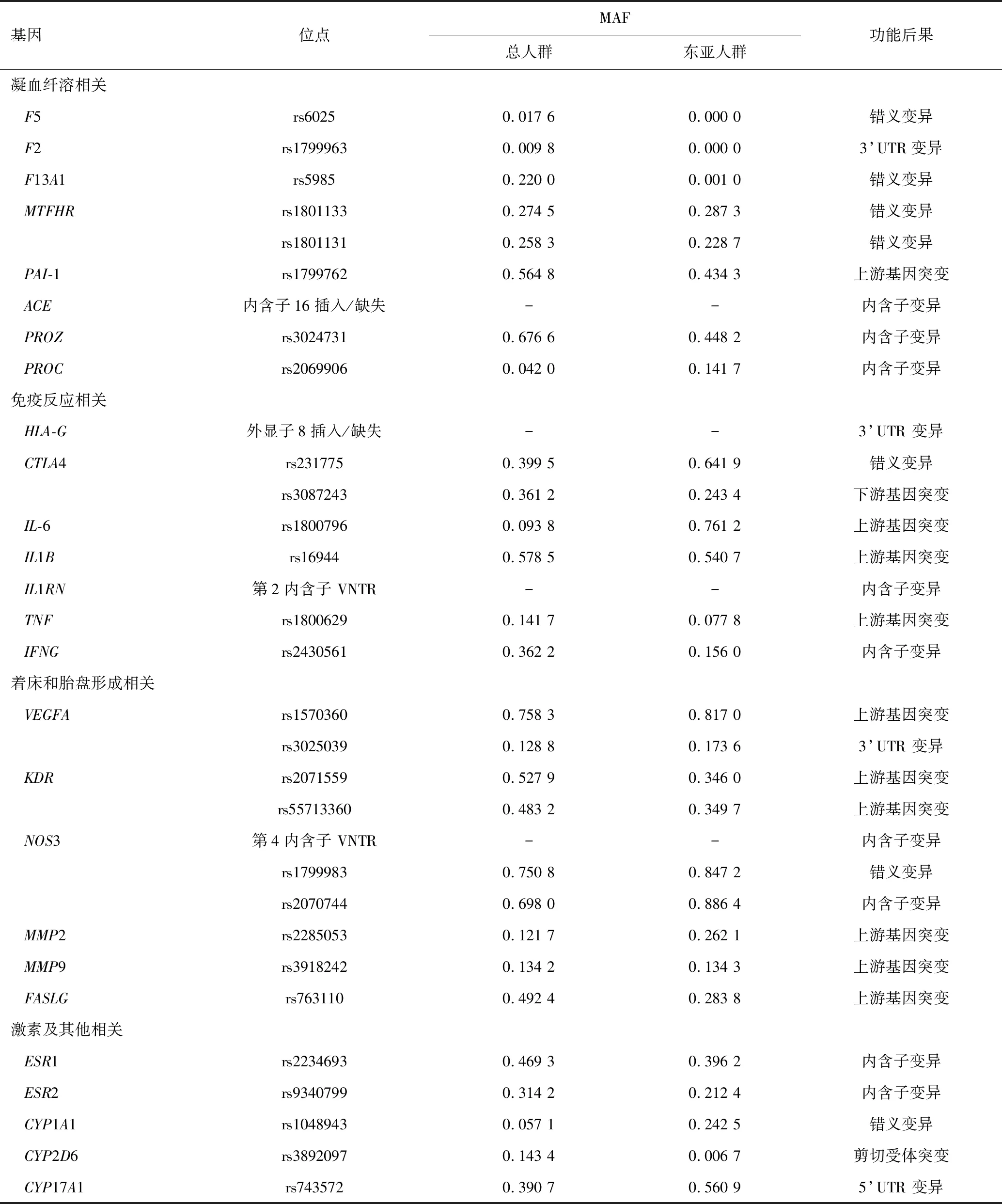
表1 RSA风险基因位点突变功能后果及MAF
2.1 血栓形成相关基因多态性与RSA
正常妊娠需要凝血和纤溶之间达到平衡,保证母胎界面有良好血供,而易诱发血栓栓塞事件的因素与RSA有关,胎盘血管形成的血栓增加了胎盘梗死的风险,从而导致流产[10]。F5的Leiden突变(factor V Leiden,FVL)可导致抗凝血蛋白C的失活,从而导致血液高凝,FVL的杂合子和纯合子突变均可增加血栓形成的风险。凝血酶原基因G20210A突变(prothrombin G20210A mutation,PGM)可致凝血酶原血浆浓度升高,增加血栓形成的风险。在美国人群中,FVL突变频率约为6.1%,而在我国人群中较为罕见[11],PGM突变频率在欧洲人群中约为2%~3%,而在亚洲和非洲人群中为0~0.3%[11]。2021年的Meta分析表明,FVL和PGM分别使RSA发生风险分别增加2.44倍和2.08倍,且亚洲人群中FVL突变与复发性流产显著关联[4]。F13A1基因编码的凝血因子XIII的A链在凝血级联、血管生成、伤口愈合和妊娠维持等多种生物过程中发挥重要作用,F13A1 基因Val34Leu位点多态性与复发性流产的发生有一定相关性[12]。纤溶酶原激活物抑制因子1由SERPINE1基因编码,其升高是血栓形成的风险因素,SERPINE1 rs1799762位点的插入/缺失和RSA发病风险之间存在相关性[13]。
MTHFR基因突变可使亚甲基四氢叶酸还原酶活性降低,从而导致叶酸代谢障碍,进而导致高同型半胱氨酸血症。高同型半胱氨酸血症会造成内皮功能障碍,抑制纤溶反应,导致血栓前状态,是包括静脉血栓栓塞在内的心血管疾病的独立危险因素,可能与流产发生相关[14]。研究表明,MTFHR基因 C677T位点的T等位基因和A1298C位点的C等位基因是RSA的易感因素[15-16],且患有复发性流产的患者同时携带C677T位点CT型和A1298C位点AC型的频率比对照组高6.589倍,说明同时携带两个位点突变的女性患病的风险更高[14]。与肾素-血管紧张素系统相关基因如AGT、AGTR1和ACE基因被认为是影响血栓形成的候选基因。基于伊朗人群的研究[17]显示,AGTC521T、AGTT702C和AGTR1 A1166C突变与不明原因的RSA显著相关。Wen等[12]通过 Meta分析表明,携带编码血管紧张素转移酶的ACE基因的D等位基因的个体,RSA的发病风险可能增加。Z蛋白、C蛋白缺乏也被认为与多种血栓性疾病有关,包括血栓形成和妊娠并发症,其蛋白编码基因的突变可能是血栓形成的重要原因之一,基于中国汉族女性的研究提示,PROZrs3024731和PROCrs2069906突变可能与RSA风险的增加相关[18]。
2.2 免疫反应相关基因多态性与RSA
妊娠潜在的母体免疫反应风险很可能是由于胎盘免疫屏障异常,正常妊娠时,胎儿免受母体的免疫排斥,而不明原因的反复流产可能为特定的母体人类白细胞抗原(human leucocyte antigen,HLA)与胎儿HLA存在不匹配情况有关[19]。Monti等[20]的Meta分析显示,HLA-G14 bp I/I基因型的女性RSA的患病率明显较高。免疫相关基因HLA-DRB1、HLA-DQB1、HLA-A和HLA-B可能是RSA的易感基因[21-22]。
T淋巴细胞是主要的免疫反应细胞,T淋巴细胞产生的细胞因子相关的基因多态性可通过影响免疫或炎症环境导致RSA的发生。细胞毒性T淋巴细胞抗原4 (cytotoxic T lymphocyte antigen 4,CTLA4)在调节性T细胞中的组成性表达,可能诱导免疫抑制酶吲哚胺2,3-双加氧酶的高表达,从而促进母胎耐受性[23]。研究发现,CTLA4基因 rs231775位点和rs3087243位点突变影响CTLA4表达水平,从而增加RSA的发生[23-24]。孕妇Th2细胞升高或Th1细胞减少的倾向反应,为妊娠提供了一个适宜的环境。在调节妊娠期Th1/Th2细胞平衡的细胞因子表达中,IL6基因、IL1B基因突变可增加RSA的风险[25]。IL1RN基因第2内含子可变数目串联重复序列(variable number of tandem repeat,VNTR)多态性与RSA有很强的相关性[26]。Shi等[27]的Meta分析显示,在亚洲人群中,TNF、INFG和TGF-B1基因是RSA发病的危险因素[27]。Zhang等[28]的研究表明IL4 、IL10、IL18、IL17和IL21基因多态性可能与RSA相关。
2.3 着床和胎盘形成相关基因多态性与RSA
血管内皮生长因子(vascular endothelial growth factor,VEGF)通过与其细胞表面特异性受体结合来维持健康的子宫微环境,VEGF是子宫内膜发育、微环境维持、妊娠早期胚胎着床和胎盘血管生成的重要因素,研究发现,其相关编码基因VEGFArs1570360 和rs3025039位点突变是RSA的危险因素[29],携带KDR基因rs2071559和rs55713360位点突变基因的个体发生不明原因RSA的风险增加[30-31]。内皮型一氧化氮合酶起着调节生殖系统的作用,NOS3多态性可影响酶活性,从而影响妊娠,NOS3基因 4VNTR、G894T及C786T位点多态性与RSA发生密切相关[32]。基质金属蛋白酶在胚胎着床过程中起关键作用,其编码基因MMP2 rs2285053位点T等位基因和MMP9 rs3918242位点T等位基因与RSA的风险有显著相关性[33]。妊娠早期的细胞凋亡有助于子宫重塑,以适应胎盘的形成,Fas分子与Fas配体相互作用是凋亡通路中重要的诱导因子之一,FAS基因突变可能通过改变细胞死亡信号增加RSA的风险[34]。目前发现FASLGrs763110突变和FASG1377A突变与RSA有一定的相关性[34-35]。
2.4 激素及其他相关基因多态性与RSA
雌激素与雌激素受体(estrogen receptor,ER)1和2结合产生的信号是维持妊娠成功的关键调控因子,ESR1基因rs2234693位点CC基因型个体发生RSA的风险是TT基因型的1.61倍[36],ESR2基因 rs4986938位点多态性与RSA存在显著相关性[37]。细胞色素P450家族的酶参与多种解毒过程,可保护子宫胎盘免受过度氧化应激的影响,其相关编码基因CYP1A1、CYP2D6和CYP17A1多态性与RSA有显著相关性[27]。
3 GRS在复发性流产中的临床应用
遗传风险评分(genetic risk score,GRS)是疾病风险评估的有效工具之一,其将遗传易感因素考虑在内,用于评估其在疾病风险预测模型中的作用。GRS方法有多种,包括简单相加遗传风险评分、以比值比(odds ratio,OR)为权重的遗传风险评分、直接基于logistic回归的遗传风险评分、多基因遗传风险评分和可释方差遗传风险评分。单核苷酸多态性(single nucleotide polymorphism,SNP)是指基因组特定位点上单个核苷酸改变导致的DNA序列多态性,是一种适用于评估疾病的简单且易获取的生物标志物。GRS通过结合多个SNP风险来评估疾病的易感性,识别个体和人群在疾病风险方面的水平,在非传染性疾病的预测、诊断和预后中,起着重要作用[38]。
多基因遗传风险评分(polygenic risk scores,PRS)可以理解为将疾病多个SNP的特定风险整合为单一分数。每个SNP对个体发生疾病的风险通常很小,但PRS能显著地分层个体之间的风险。PRS已广泛应用于预测冠状动脉疾病、高胆固醇血症、2型糖尿病、房颤和静脉血栓栓塞等疾病,通过对人群进行临床风险分层,更精确地识别风险人群。同时,它对于识别需要加强治疗的个体也发挥作用。例如,在治疗高血压和2型糖尿病患者方面,PRS可以指导选择最有效的药物,或者选择最有益的药物组合,以指导临床用药决策[39]。在与复发性流产相关的研究中,一项病例对照研究通过检测12个基因位点的基因型来预测RSA的风险,结果表明遗传风险评分有助于区分不同RSA风险的女性,并在一定程度上提高了鉴别RSA的能力[40]。然而,目前仍然缺乏高效准确的早期筛查模型来评估RSA风险,对个体进行精确评估和制定个体化的临床干预方案。
4 小结
本文综述了与复发性流产相关的血栓形成、免疫反应、胚胎着床和胎盘形成及激素等相关基因多态性,有利于深入探究基因与RSA的关联及其在RSA发病中的潜在作用机制,指导后续特定位点的研究。虽然目前尚缺乏高效的治疗方法,但鉴于RSA患者再次妊娠丢失的风险较高,应根据病因进行相应临床管理。例如,对于有血栓形成倾向的人群,可以考虑预防性抗凝治疗[41];对于免疫功能异常的人群,可以尝试免疫治疗,如注射免疫球蛋白等[42]。通过总结RSA的显著风险基因位点,有助于评估遗传因素对RSA风险的影响,为构建准确高效的个体化风险预测模型提供了基础,有利于全面评估RSA的患病风险等级,实现RSA的早期筛查和个体化诊疗策略,降低卫生保健系统和社会成本。

