超声辅助酶提取、双水相萃取及大孔树脂纯化天麻素的工艺研究*
田梦凡,高青青,易雅丽,国大亮,刘玉璇
(天津中医药大学,天津 301617)
中药材天麻由常年异养型兰科植物天麻(Gastrodia elata Bl.)的干燥块茎制作而来,味甘,性平,归肝经[1]。目前已知化学成分中占比最多的是酚类化合物[2],主要为天麻素,即4-羟甲基苯基-β-D-吡喃葡萄糖苷。天麻素属天麻中小分子酚型糖苷[3],具有镇静、催眠、抗惊厥、保护神经元、改善学习记忆能力、抗精神病等作用[4]。
目前天麻素提取纯化技术有限且瑕瑜互见,因此,我们致力于寻找高效、环保且易操作的新兴提取、纯化方法。超声辅助酶提取兼顾了超声的机械性能和酶的水解作用,在破碎细胞壁、增加目标产物溶出、提高天麻素提取率、避免天麻素分解方面具有优势[5]。本试验还对提取液进行分离纯化。近年来,双水相萃取作为一种高效的分离技术被越来越多科研工作者关注[6]。双水相体系是两种不相容聚合物(例如聚合物与盐或聚合物与聚合物)在水性溶剂中超过一定浓度,导致液相分离所形成[7]。双水相体系多用于分离蛋白质、抗体及植物活性成分等[8],可满足当前生产快速、经济和易于实施的要求[9]。
天麻素初步纯化后需要再次精细纯化,现有天麻素纯化方法主要有高速逆流色谱法[10]、制备型高效液相色谱法[11]和大孔树脂法[12]等。前两者纯化天麻素生产污染严重,且实验设备要求较高,不适用于工业大生产。大孔吸附树脂法吸附量大、热稳定性好且绿色环保[13]。因此本试验采用超声辅助酶提取天麻素,通过双水相萃取进行初步纯化,再通过大孔树脂进行精细纯化,以提高目标产物纯度,为制剂研发提供保障要求。
1 材 料
1.1 试药与试剂 天麻由河北全泰药业提供,经天津中医药大学中药学院中药资源教研室主任张坚副教授鉴定为天麻正品。天麻素对照品(批号:AF20100454,纯度:98%)购于成都埃法生物科技有限公司;纤维素酶(批号:C805042)、α-淀粉酶(批号:C12227987)均购于上海麦克林生化科技有限公司;柠檬酸(批号:20200529)购于天津渤化化学试剂有限公司;硫酸铵(批号:20230103)购于福晨化学试剂有限公司;D301型弱碱性苯乙烯系阴离子树脂(批号:20210720)、ADS-17大孔吸附树脂(批号:20210720)、HPD100大孔吸附树脂(批号:20231013)、AB-8型大孔吸附树脂(批号:20210715)均购于北京索莱宝科技有限公司;乙腈为色谱纯;无水乙醇为分析纯。
1.2 主要仪器 HH-2型数显恒温水浴锅(常州朗越仪器制造有限公司);JP-060S型超声波清洗器(深圳洁盟有限公司);PHS-25型数显酸度计(雷磁分析仪器厂);RE-52AA型旋转蒸发器(上海亚荣生化仪器厂);LC2000型高效液相色谱仪(上海天普分析仪器有限公司);HY-2型调速多用振荡器(江苏荣华仪器制造有限公司);L-530型离心机(湘仪离心机仪器有限公司)。
2 方 法
2.1 天麻素含量测定
2.1.1 色谱条件 色谱柱为GS-120-5 C18EX(4.6mm×250mm,5 μm);流动相为乙腈-0.05%磷酸水溶液(3∶97);流速为1.0 mL/min;柱温为25 ℃;检测波长为220 nm;进样量为20 μL。
2.1.2 对照品溶液的制备 精密称取5.05 mg天麻素对照品,置于25 mL容量瓶中,加乙腈-水(3∶97)溶液定容至刻度,即得质量浓度为0.202 mg/mL的天麻素对照品溶液。
2.1.3 供试品溶液的制备 取干燥天麻块茎粉碎,过30目筛,称取天麻粗粉2.0 g于具塞锥形瓶,按0.5%酶比例加入α-淀粉酶,按1∶30料液比加入pH值=7的溶剂,在60 ℃水浴锅中提取60 min,后经超声处理(功率:180 W,频率:40 kHz)30 min,于100 ℃中将酶灭活10 min,滤去药渣,减压旋转蒸发至生药质量浓度为0.1 g/mL。
2.2 天麻素标准曲线绘制 分别精密吸取对照品溶液1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL,于10 mL容量瓶,加乙腈-水(3∶97)溶液定容,得到质量浓度分别为0.020 2、0.040 4、0.060 6、0.080 8、0.101 0、0.121 2、0.141 4 mg/mL的天麻素溶液,按“2.1.1”项下色谱条件进样分析,测定峰面积,绘制天麻素标准曲线。
2.3 提取工艺优化
2.3.1 单因素试验考察 基于“2.1.3”项下供试品溶液制备方法及其他条件固定,对酶种类(纤维素酶、α-淀粉酶)及比例(0∶0、3∶0、2∶1、1∶1、1∶2、0∶3)、料液比(1∶20、1∶30、1∶40、1∶50、1∶60)、加酶量(0.2%、0.5%、0.8%、1.0%、1.5%)、酶解时间(20、40、60、80、100 min)、酶解温度(30、40、50、60、70 ℃)、酶解pH值(5.0、5.5、6.0、6.5、7.0)进行单因素试验考察,每组试验重复3次,以天麻素提取量为指标,考察不同因素对天麻中天麻素提取量的影响。
2.3.2 正交试验设计优选天麻素提取工艺 根据单因素考察结果,选取对天麻素提取量影响较大的4个因素[料液比(A)、加酶量(B)、酶解时间(C)、酶解温度(D)]用正交试验表设计试验。

表1 试验设计参数
2.3.3 最佳工艺验证 参照最优正交试验工艺参数提取3批天麻素,计算天麻素含量,验证工艺稳定性。
2.4 纯化工艺优化
2.4.1 双水相萃取初步纯化天麻素
2.4.1.1 双水相系图绘制 参照ALBERTSSON P A[14]的浊点滴定方法绘制双水相体系图,操作如下:称取一定量硫酸铵溶于去离子水,待完全溶解后滴加无水乙醇并震荡,加至溶液出现浑浊为止,记录消耗无水乙醇的体积。再向体系中滴加去离子水并震荡,加至溶液重新变为澄清,记录所加去离子水体积。反复进行上述操作,记录每次加入乙醇和去离子水体积,计算硫酸铵质量分数和乙醇体积分数,绘制双水相系图。
2.4.1.2 双水相萃取工艺 取一定量天麻提取液,加入一定量的硫酸铵,溶解后置4 ℃冰箱冷藏12 h,进行低温盐析反应,经3 000 r/min(离心半径为93 mm)离心5 min,弃去盐析出的不溶物,将上清液按一定乙醇体积分数加入乙醇,振摇5 min,静置,待分层清晰稳定后,吸取上层液测定天麻素含量。
2.4.1.3 双水相萃取工艺参数考察 基于“2.4.1.2”项下方法及其他条件固定,根据双水相系图和预试验结果,对硫酸铵质量分数(12.5%、15.0%、17.5%、20.0%、22.5%)、提取液浓度(0.10、0.15、0.20、0.30、0.40 g/mL),乙醇体积分数(40.0%、42.5%、45.0%、47.5%、50.0%)进行考察,计算天麻素萃取量。
2.4.1.4 双水相萃取工艺验证 将所得双水相萃取最佳工艺参数进行天麻素萃取,验证3批。
2.4.2 大孔树脂纯化天麻素
2.4.2.1 大孔树脂纯化工艺 (1)大孔树脂预处理:95%乙醇浸没大孔树脂(HPD100、AB-8、ADS-17、D301)24 h,并冲洗至白色浑浊彻底除去,后用蒸馏水冲洗至无醇味,依次用5%HCl和5%NaOH分别浸泡大孔树脂4 h后用蒸馏水冲洗至中性,装柱备用。
(2)静态吸附及解吸试验:称取各型号大孔树脂1.0 g于具塞锥形瓶中,分别加入20 mL萃取液,于25 ℃条件下以100 r/min(震荡幅度为20 mm)在恒温震荡仪上震荡24 h,测定上清液中天麻素含量,计算静态吸附率和静态吸附量。将吸附饱和的树脂用蒸馏水冲洗后用70%乙醇解吸,相同条件下震荡24 h。检测解吸出液体中天麻素含量,计算静态解吸率和静态解吸量。
(C0:吸附前天麻素浓度;C1:吸附后上清液天麻素浓度;V1:吸附后上清液体积;M:大孔树脂质量;C2:解吸液天麻素浓度;V2:解吸液体积。)
(3)动态吸附及解吸实验:取一定量筛选好的大孔树脂,预处理后,湿法装入洁净玻璃色谱柱,取一定浓度萃取液以一定流速上样,直至大孔树脂吸附饱和,收集未被吸附的流出液,计算吸附量和吸附率。后用大量蒸馏水冲洗至无萃取液残留。用一定质量分数乙醇以一定流速洗脱至完全,收集洗脱液,计算解吸量和解吸率。
2.4.2.2 大孔树脂纯化工艺参数考察 利用静态吸附及解吸试验对大孔树脂型号进行筛选,对上样液浓度(0.05、0.10、0.15、0.20、0.25 g/mL)和洗脱液体积分数(10%、30%、50%、70%、90%)进行考察;利用动态吸附及解吸实验对上样流速(2.0、2.5、3.0、3.5、4.0 BV/h)和径高比(1∶3、1∶5、1∶7)进行考察;后根据考察结果进行上样量考察,并对洗脱流速(2、3、4、5、6 BV/h)进行考察,最后对洗脱剂用量进行考察。
2.4.2.3 大孔树脂纯化工艺验证 将所得大孔树脂最佳工艺参数进行天麻素纯化验证,共验证3批。
3 结 果
3.1 天麻素标准曲线 对天麻素对照品质量浓度和峰面积进行线性关系考察,得到回归方程:y=847 536x+2 240.7,r=0.999 7,说明天麻素在0.020 2~0.141 4 mg/mL质量浓度范围内线性关系良好。(见图1)

图1 天麻素标准曲线图
3.2 提取工艺优化
3.2.1 单因素试验考察结果 由图2a可知,加纤维素酶和α-淀粉酶明显有助于提高天麻素提取量,且天麻素提取量随着α-淀粉酶所占比例增加而逐渐提高,当酶全部为α-淀粉酶时,天麻素提取量达到最高,且纤维素酶和α-淀粉酶没有协同作用,因此,选择单独用α-淀粉酶进行酶解反应。

图2 超声辅助酶提取单因素试验考察结果图
由图2b可知,天麻素提取量随着加酶量的增加呈现先上升后下降趋势。在加酶量到达0.5%时,天麻素提取率达到最高,后下降原因猜测是加酶量过多,吸附包裹在药材表面,从而影响有效成分溶出。因此,选择加酶量0.5%进行后续试验。
由图2c可知,天麻素提取量随料液比增大而呈现先增大后减小趋势。在料液比为1∶30时,天麻素提取量最大,推测可能原因是随料液比增加,使液体体积在增加,体系的黏度降低,天麻素较容易提取出来。当料液比超过1∶30,酶的有效作用浓度和底物浓度被稀释,酶的结合能力也随之降低,从而使天麻素溶出降低。因此,选择料液比为1∶30进行后续试验。
由图2d可知,天麻素提取量随着酶解时间的增加呈现先上升后下降趋势。在酶解时间达到60 min时,天麻素提取量达到最高。酶解时间过长导致有效成分性质改变,从而降低了天麻素提取量。因此,选择酶解时间60 min进行后续试验。
由图2e可知,天麻素提取量随着酶解温度的升高呈现先上升后下降趋势。在酶解温度达到50℃时,天麻素提取量达到最高,后下降原因是温度较高,酶活性降低,从而影响有效成分提取。因此,选择酶解温度50 ℃进行后续试验。
由图2f可知,天麻素提取量随着酶解pH值的增加呈现先上升后下降趋势。在酶解pH值达到5.5时,天麻素提取量达到最高;α-淀粉酶活性受pH值影响。pH值=5.5时,α-淀粉酶发挥最大活性,后随pH值增大而活性降低。因此选择pH值=5.5进行后续试验。
3.2.2 正交优化试验设计 正交优化试验结果见表2,4个因素对天麻素提取量影响顺序为:A>C>B>D。因此天麻素提取量的正交优化试验最优组合为A2B3C3D3,即料液比(g/mL)为1∶30,加酶量(g/g)为0.8%,酶解时间为80 min,酶解温度为60 ℃。方差分析见表3,因素A、B、C、D对天麻素提取量的影响均达到显著水平(P<0.05)。

表2 正交设计实验结果
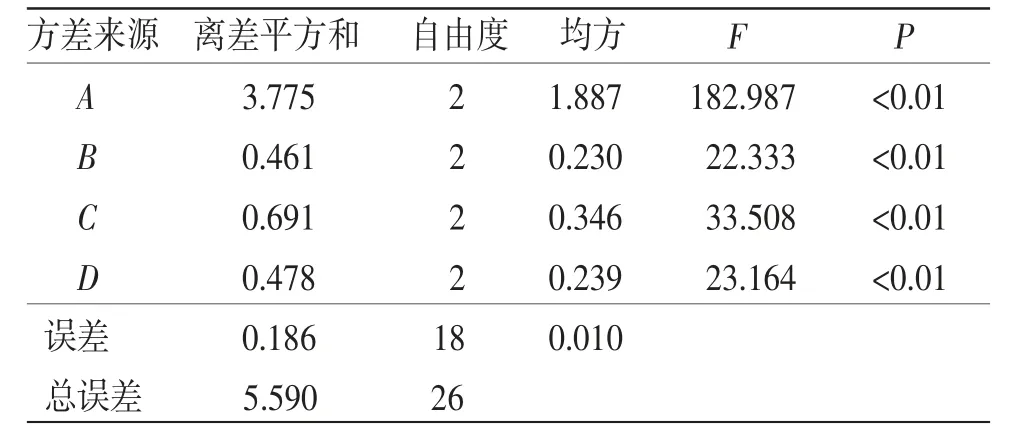
表3 方差分析结果
3.2.3 最佳提取工艺验证 按照天麻素提取量的正交优化试验最优组合A2B3C3D3,即料液比(g/mL)为1∶30,加酶量(g/g)为0.8%,酶解时间为80 min,酶解温度为60 ℃,进行3次平行验证试验,测得天麻素提取量结果依次为5.826、5.686、5.629 mg/g,平均值为5.714 mg/g,RSD值为1.77%,表明最优条件下提取天麻中天麻素工艺较为稳定可靠,可用于后续试验。
3.3 纯化工艺考察结果
3.3.1 双水相萃取
3.3.1.1 双水相系图绘制 乙醇-硫酸铵双水相系图见图3。图中曲线为双水相临界点,曲线下方是均一相区,上方是双水相区,在双水相体系中有机溶剂的质量分数与无机盐的质量分数呈负相关。双水相体系选择应遵从既能成相又不饱和析出原则,选择曲线上方合适乙醇体积分数和硫酸铵质量分数。
3.3.1.2 双水相萃取工艺参数考察 由图4a可知,当乙醇体积分数小于40%时,体系不能形成两相;乙醇体积分数大于50%时,会有盐析出。随着乙醇体积分数增加,两相的体积比亦随之增大,原因是乙醇夺取盐相中水分子,上相体积随乙醇体积分数增大而增加,且上相中乙醇的浓度是增加的。这有利于天麻素更多分配到上相中,因此天麻素萃取量增大。最终选择乙醇体积分数为47.5%。

图4 双水相萃取工艺考察结果
由图4b可知,随着硫酸铵质量分数的增加,萃取量先增加,到硫酸铵质量分数为17.5%时达到最大,而后呈现变化幅度较小的下降趋势。其原理是随着硫酸铵质量分数的增加,萃取逐渐达到完全,而超过17.5%后,继续增加盐浓度会争夺水导致萃取量下降。在硫酸铵质量分数为17.5%时,分配系数和萃取率均达到各自的最大值。考虑到节省成本,选择硫酸铵质量分数为15.0%。
由图4c可知,当提取液浓度高于0.2 g/mL时,随提取液质量浓度增加,天麻素萃取量降低,原因是浓度过高,乙醇和盐加入量变低,导致提取不完全,提取液质量浓度低于0.2 g/mL,趋于平稳。所以选择0.2 g/mL提取液浓度。
3.3.2 大孔树脂纯化工艺
3.3.2.1 大孔树脂型号筛选 由图5a可知,吸附率:HPD100>D301>ADS17>AB-8;解吸率:AB-8>HPD100>ADS-17>D301,综合考量4种大孔树脂吸附率和解吸率,选择HPD100进行后续处理。

图5 大孔树脂纯化工艺考察结果
3.3.2.2 上样浓度筛选 由图5b可知,天麻素上样浓度为0.1~0.2 g/mL时,吸附率变化不大且均大于50%;天麻素上样浓度高于0.2 g/mL时,吸附率随上样浓度升高逐渐降低。原因是低浓度天麻素萃取液经过大孔树脂时,树脂吸附量有限,当浓度大于0.2 g/mL时,大孔树脂较难吸附完全。考虑到吸附效率等因素,选择天麻素上样浓度为0.2 g/mL进行后续试验。
3.3.2.3 径高比 由图5c可知,径高比为1∶5时吸附量和吸附率均达到最大,猜测原因是径高比较小时,对天麻素上样液吸附不完全而导致浪费较多;径高比越大,树脂吸附越不饱和,树脂利用越不充分。因此选择径高比为1∶5进行后续试验。
3.3.2.4 上样流速考察 由图5d可知,随着天麻素上样液流速的增大,大孔树脂对天麻素的吸附率均呈现下降趋势。当天麻素上样液流速在2~3 BV/h时,吸附率趋向平稳。当天麻素上样液流速大于3 BV/h时,大孔树脂对天麻素的吸附率呈显著降低趋势。考虑到吸附效率等因素,选择3 BV/h进行后续试验。
3.3.2.5 上样量考察 由图5e可知,上样量达到60 mL时,天麻素已经发生泄露;上样量达到100 mL时,天麻素的质量浓度为0.07 mg/mL,达到上样液浓度的1/10;上样量超过180 mL后上样量与泄漏量达到动态平衡,此时大孔树脂吸附饱和。因此选择上样量为100 mL。
3.3.2.6 洗脱液体积分数考察 由图5f可知,随乙醇体积分数增大,解吸率先增加后减小。当乙醇体积分数为30%时,解吸率达到最高,为98.4%。因此选择洗脱液乙醇体积分数为30%进行后续试验。
3.3.2.7 洗脱流速考察 由图5 g可知,解吸率随洗脱流速增加呈现先增大后减小趋势,在洗脱流速为4 BV/h时解吸率最大。洗脱流速过快导致30%的乙醇大孔树脂上停留时间短,无法将天麻素解吸完全,因此选择洗脱流速为4 BV/h进行后续试验。
3.3.2.8 洗脱剂用量考察 由图5h可知,随着洗脱液用量增多,洗脱的天麻素质量浓度不断增大。当30%乙醇用量为90 mL时,洗脱出天麻素质量浓度达到最高,继续洗脱,洗脱出天麻素质量浓度持续下降。当洗脱液体积增加到230 mL时,洗脱出天麻素质量浓度约为洗脱液用量为90 mL时的1/25,表明被大孔树脂吸附的天麻素基本被洗脱完全,因此选择洗脱剂用量为230 mL。
3.3.3 试验验证 经试验选择双水相初步纯化天麻素最佳工艺为乙醇体积分数为47.5%,硫酸铵质量分数为15.0%,提取液浓度为0.2 g/mL。选择大孔树脂进一步纯化天麻素最佳工艺为选择HPD100大孔树脂,上样浓度为0.2 g/mL,径高比为1∶5,上样流速为3 BV/h,上样量为100 mL,洗脱液体积分数为30.0%,洗脱流速为4 BV/h,洗脱剂用量为230 mL。3批试验验证结果见表4。纯化后的天麻素纯度比纯化前提高了5.43倍,纯化效果显著。

表4 纯化工艺验证结果
4 讨 论
天麻始载于《神农本草经》[15],被列为“上品”,性温和,有息风通络、平肝止痉之功效。天麻常配伍川芎、半夏、钩藤等药物治疗头痛类病证[16]。近年来,对天麻药用研究愈来愈多。本研究着眼于天麻中含量较多,功效研究较全面的酚类化合物天麻素,考虑建立高效的提取纯化方法,为后续制剂及病证治疗奠定基础。目前天麻素提取方法主要有传统浸泡提法、热回流提取法等。这些方法耗时长且效率低,存在溶剂安全问题[17]。相较而言,超声辅助酶提取方法提取效率高、绿色环保[18]。其原理是利用酶的水解性使植物细胞壁及细胞间质组分中的有效成分溶出,并且利用超声波产生空化效应和强烈的振动使药材细胞壁破碎,从而促进药材中的有效成分转移至提取溶剂中[19]。本研究通过单因素试验和正交试验发现最佳提取工艺为:料液比(g/mL)为1∶30,加酶量(g/g)为0.8%,酶解时间为80 min,酶解温度为60 ℃,酶解pH值为5.5。3批验证试验结果也证明该工艺稳定。
本研究采用双水相体系进行初步分离,原理是利用天麻素在上、下相优先分布的分配系数会因电荷作用、化学键产生的影响发生相应的变化,达到分离目的[20]。此方法耗能低、耗材少,具有灵活性和可靠性。考察最佳工艺为乙醇体积分数为47.5%,硫酸铵质量分数为15.0%,天麻素提取液浓度为0.2 g/mL。吸附性大孔树脂是一种高度交联的非离子树脂,吸附/解吸机制受氢键和范德华力的调节[21],同时大孔吸附树脂的多孔结构使其具有分子筛作用[22]。本研究通过试验明晰最佳上样和洗脱条件,以达到最好的分离纯化效果。此前有研究纯化天麻素纯度可达到20.14 mg/g[12],本研究分离纯化效果更优。最佳工艺为选择HPD100大孔树脂,上样浓度为0.2 g/mL,径高比为1∶5,上样流速为3 BV/h,上样量为100 mL,洗脱液体积分数为30%,洗脱流速为4 BV/h,洗脱剂用量为230 mL。3批试验验证结果显示纯化后的天麻素纯度比纯化前提高了5.43倍,纯化效果显著。
天麻素提取纯化试验发现:(1)通过预试验验证超声辅助酶提取天麻素效果优于单纯超声提取和酶提取;(2)与传统双水相体系先配制分层后再加提取液不同,本研究采用先盐析,待除去盐析出的杂质后再加醇进行双水相萃取,分离效果更佳;(3)天麻素高效、可工业化纯化始终是个难点。采用其他方法,如硅胶色谱法、分子印迹法等进行纯化,可能取得更理想化成果,从而为天麻素成分深入研究和应用提供技术支持。

