乳痛软坚片抗炎镇痛及调节免疫药效作用的实验研究*
邓东方,王 鑫,姜 帆,雷诗卉,张胜丽,缪程锌,刘 林,葛安琪
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208)
乳腺增生是发生于育龄期妇女的一种乳腺组织良性增生性疾病[1],以乳腺疼痛、结块及肿块为主要表现。乳腺增生属于中医学中“乳癖”的范畴,气滞、痰凝、血瘀是其发病因素[2],治法有理气、化痰、活血等方法。研究表明乳腺增生患者发生乳腺癌的风险为1%~2%,比普通人患乳腺癌的概率增加了4倍左右[3-4],因此对乳腺增生的研究与治疗具有重要的意义。
乳痛软坚片是湖南中医药大学第一附属医院专家根据多年的临床经验总结研制而成的特色医院制剂,具有疏肝解郁、化痰散结、活血止痛的功效,对肝郁气滞、痰瘀互结型乳腺增生患者具有良好的治疗效果[5-6]。本研究通过镇痛、抗炎和调节免疫药理作用的动物实验研究,进一步明确其防治乳腺增生的药理作用机理及特点,旨在为其进一步临床运用推广和新药研发提供实验依据。
1 材 料
1.1 药物与试剂 乳痛软坚片(湖南中医药大学第一附属医院,批号:201804,人临床用量为7.2 g/d);醋酸泼尼松(浙江仙琚制药股份有限公司,批号:1909215,人临床用量为60 mg/d);乳核散结片(广州白云山中一药业有限公司,批号:VN0020,人临床用量为4.32 g/d);阿司匹林(舒泰神生物制药股份有限公司,批号:191408,人临床用量为3.0 g/d);罗通定(山西云鹏制药有限公司,批号:200807,人临床用量为120 mg/次);左旋咪唑(山西云鹏制药股份有限公司,批号:B150101);冰醋酸(天津市致远化学试剂有限公司,批号:20180901);角叉菜胶(Solarbio公司,批号:9000-07-1);豚鼠血清(北京鑫泉永硕科技有限公司,批号:20190702);印度墨汁(北京雷根生物技术有限公司,批号:1023A20)。
1.2 仪器 UV1800多功能分光光度计(日本岛津);YLS-7B型足趾容积测定仪(山东省医学科学院设备科);37370型足底热痛测试仪(意大利VGO);AY-120型电子分析天平(日本岛津);101-2ES型电热鼓风干燥箱(北京永光明医疗仪器有限公司);TP-2200B电子天平(湘仪天平仪器设备有限公司);LA612型超纯水仪(ELGA);H1850型低速台式离心机(湖南湘仪仪器有限公司);BCD-196TMZL型冰箱(海尔集团);HDPN-88型电热恒温培养箱(上海跃进医疗器械有限公司)。
1.3 实验动物 SD大鼠,120只,SPF级,雌雄各半,体质量(140±10)g;ICR小鼠,240只,SPF级,雌雄各半,体质量(20±2)g。动物均购自湖南斯莱克景达动物有限公司,许可证号:SCXK(湘)2019-0004。所有动物均适应性喂养4 d后开始实验,饲养温度维持在18~24 ℃,湿度40%~70%,照明时间随同自然昼夜变化,每2 d投喂饲料、清换垫料、清理笼具,定期消毒笼具。本实验经湖南中医药大学第一附属医院伦理委员会审查,批号:ZYFY20230509-01。
2 方 法
2.1 镇痛药理作用实验[7]
2.1.1 小鼠扭体实验[8]取60只ICR小鼠,雌雄各半,体质量18~22 g,按体质量随机分为模型组、罗通定组(46.8 mg/kg)、乳核散结片组(0.56 g/kg)、乳痛软坚片高剂量组(3.76 g/kg)、乳痛软坚片中剂量组(1.88 g/kg)、乳痛软坚片低剂量组(0.94 g/kg),每组10只。罗通定组、乳核散结片组、乳痛软坚片高剂量组、乳痛软坚片中剂量组、乳痛软坚片低剂量组分别灌胃相应药物,模型组灌胃等体积纯净水,灌胃体积均为20 mL/kg,1次/d,连续给药5 d。于末次药后1 h,腹腔注射0.6%冰醋酸0.2 mL/20 g,记录15 min内各组小鼠的扭体次数及潜伏期。
2.1.2 小鼠热板法实验 预选痛阈在5~30 s内的18~22 g雌性ICR小鼠60只,按痛阈值随机分为模型组、罗通定组(46.8 mg/kg)、乳核散结片组(0.56 g/kg)、乳痛软坚片高剂量组(3.76 g/kg)、乳痛软坚片中剂量组(1.88g/kg)、乳痛软坚片低剂量组(0.94g/kg),每组10只。罗通定组、乳核散结片组、乳痛软坚片高剂量组、乳痛软坚片中剂量组、乳痛软坚片低剂量组小鼠分别灌胃相应药物,模型组灌胃等体积纯净水,灌胃体积均为20 mL/kg,1次/d,连续给药5 d。用热板法分别测小鼠末次给药后1、2、3 h痛阈值。小鼠的足部受热板刺激而产生疼痛时,会发生舔舐后足(后足为身体支撑点)的特殊反应,以接触热板到舔舐后足所需的时间作为痛阈值。
2.2 抗炎药理作用实验[7]
2.2.1 大鼠肉芽肿实验 取60只SD大鼠,雌雄各半,体质量130~150 g,麻醉后进行腹部切口,将50 mg棉球(青霉素消毒)植入大鼠两侧腹股沟皮下,左右各1个,缝合,诱导大鼠肉芽肿增生。于手术后24 h,按体质量随机分为模型组、醋酸泼尼松组(5.4 mg/kg)、乳核散结片组(0.39 g/kg)、乳痛软坚片高剂量组(2.6 g/kg)、乳痛软坚片中剂量组(1.3 g/kg)、乳痛软坚片低剂量组(0.65 g/kg),每组10只。醋酸泼尼松组、乳核散结片组、乳痛软坚片高剂量组、乳痛软坚片中剂量组、乳痛软坚片低剂量组大鼠分别灌胃相应药物,模型组大鼠灌胃给予等体积纯净水,灌胃体积均为10 mL/kg,1次/d,连续7 d。末次灌胃1 h后,处死动物,将棉球和肉芽组织一同摘出,于60 ℃干燥24 h至恒重后,称重,空白棉球同法处理。肉芽组织与棉球的质量减去空白棉球质量,即为肉芽肿净重,按动物体质量折算成“肉芽肿质量(mg)/体质量(100 g)”。
2.2.2 大鼠足肿胀实验[9]取60只SD大鼠,雌雄各半,体质量130~150 g。按性别、体质量机分为模型组、阿司匹林组(0.27 g/kg)、乳核散结片组(0.39 g/kg)、乳痛软坚片高剂量组(2.6 g/kg)、乳痛软坚片中剂量组(1.3 g/kg)、乳痛软坚片低剂量组(0.65 g/kg),每组10只。阿司匹林组、乳核散结片组、乳痛软坚片高剂量组、乳痛软坚片中剂量组、乳痛软坚片低剂量组大鼠分别灌胃相应药物,模型组灌大鼠胃等体积纯净水,灌胃体积均为10 mL/kg,1次/d,连续7 d。末次给药前,用足趾容积测定仪测定大鼠右踝关节下容积为致炎前容积,末次给药30 min后,大鼠右后肢足跖皮下注射1%角叉菜胶0.1 mL致炎。于致炎后1、2、3、4、5、6 h测右踝关节下容积1次。以足肿胀度为指标。肿胀度=致炎后足趾容积-致炎前足趾容积。
2.3 调节免疫功能药理作用实验[10]
2.3.1 小鼠血清溶血素实验 取ICR小鼠60只,体质量18~22 g,雌雄各半,按体质量随机分为模型组、左旋咪唑组(22.75mg/kg)、乳核散结片组(0.56 g/kg)、乳痛软坚片高剂量组(3.76 g/kg)、乳痛软坚片中剂量组(1.88g/kg)、乳痛软坚片低剂量组(0.94g/kg),每组10只。左旋咪唑组、乳核散结片组、乳痛软坚片高剂量组、乳痛软坚片中剂量组、乳痛软坚片低剂量组小鼠分别灌胃相应药物,模型组小鼠灌胃等体积纯净水,灌胃体积均为20 mL/kg,1次/d,连续3 d。末次给药1 h后,腹腔注射5%氯化钠溶液鸡红细胞混悬液0.2 mL进行免疫,免疫后继续灌胃给药7d,第10天给药30 min后,各组小鼠摘眼球取血,3 000 r/min(离心半径10 cm),离心15 min,取血清用生理盐水稀释100倍,取稀释血清1 mL,与5%鸡红细胞混悬液0.5 mL、补体(10%豚鼠的血清)0.5 mL混合,37 ℃恒温箱保温30 min后,置0 ℃冰箱内中止反应,再离心待测定。另设不加血清的空白管,即5%鸡红细胞混悬液0.5 mL,10%补体0.5 mL混合,在37 ℃水浴保温30 min后,置于0 ℃冰箱中,中止反应,2 000 r/min(离心半径为10 cm)离心10 min,取其上清液测定光密度(OD),以OD值作为血清溶血素指标。
2.3.2 小鼠碳粒廓清试验 取ICR小鼠60只,雄性,体质量18~22 g,根据体质量随机分为模型组、左旋咪唑组(22.75 mg/kg)、乳核散结片组(0.56 g/kg)、乳痛软坚片高剂量组(3.76 g/kg)、乳痛软坚片中剂量组(1.88 g/kg)、乳痛软坚片低剂量组(0.94 g/kg),每组10只。左旋咪唑组、乳核散结片组、乳痛软坚片高剂量组、乳痛软坚片中剂量组、乳痛软坚片低剂量组小鼠分别灌胃相应药物,模型组小鼠灌胃等体积纯净水,灌胃体积均为20 mL/kg,1次/d,连续7d。末次给药1 h后,小鼠尾静脉注射20%印度墨汁(0.1 mL/10 g),分别于注入墨汁2 min和10 min后经眼眶静脉采血20 μL,加入2 mL 0.1%Na2CO3溶液中。于分光光度计波长600 nm处测OD值。按照公式计算各组廓清指数(K)和吞噬指数(α)。K=(lgOD2-lgOD10)/(t2-t1)=lg(OD2/OD10)/8。α=体质量/(肝质量+脾质量)×K1/3。
2.4 统计学方法 采用SPSS 27.0软件处理数据,计量资料以“均数±标准差”(±s)表示,计量资料符合正态分布且方差齐。计量资料比较采用单因素方差分析(One way ANOVA),两两比较采用LSD-t检验。不符合正态分布的重复测量数据,采用广义估计方程分析。P<0.05为差异有统计学意义。
3 结 果
3.1 小鼠扭体实验 乳痛软坚片高剂量组小鼠扭体潜伏期长于模型组,扭体次数少于模型组,差异均有统计学意义(P<0.01或P<0.05);乳痛软坚片中剂量组扭体次数少于模型组,差异有统计学意义(P<0.05)。乳痛软坚片高、中、低剂量组小鼠扭体潜伏期、扭体次数与罗通定组比较,差异均无统计学意义(P>0.05)。乳痛软坚片高、中剂量组小鼠扭体潜伏期长于乳核散结片组,扭体次数少于乳核散结片组,差异均有统计学意义(P<0.05)。乳痛软坚片能显著减少小鼠扭体次数,具有一定的镇痛作用。(见表1)
表1 各组小鼠扭体潜伏期、扭体次数比较 (±s)
注:与模型组比较,aP<0.05,bP<0.01;与乳核散结片组比较,dP<0.05。
组别 n 给药剂量 潜伏期/s 扭体次数/次模型组 10 212.42±83.59 36.41±14.81罗通定组 10 46.80 mg/kg 340.53±101.71b 17.53±6.49b乳核散结片组 10 0.56 g/kg 215.91±66.23 35.43±12.18乳痛软坚片高剂量组 10 3.76 g/kg 321.93±125.64ad 18.22±6.02bd乳痛软坚片中剂量组 10 1.88 g/kg 302.44±102.31d 22.51±8.27ad乳痛软坚片低剂量组 10 0.94 g/kg 278.63±89.13 25.24±8.53 F 3.13 6.99 P 0.014 0.000
3.2 小鼠热板法实验 乳痛软坚片组高剂量组小鼠给药后2、3 h痛域值均高于模型组,差异均有统计学意义(P<0.05);乳痛软坚片中剂量组小鼠给药后1 h痛域值高于模型组,差异有统计学意义(P<0.05)。乳痛软坚片高、中、低剂量组小鼠给药后1h痛阈值低于罗通定组,差异有统计学意义(P<0.01);乳痛软坚片高、中、低剂量组小鼠给药后2、3 h痛阈值与罗通定组比较,差异无统计学意义(P>0.05)。乳痛软坚片高、中、低剂量组小鼠给药后1、2 h痛阈值与乳核散结片组比较,差异无统计学意义(P>0.05);乳痛软坚片高、中剂量组小鼠给药后3 h痛阈值与乳核散结片组比较,差异无统计学意义(P>0.05);乳痛软坚片低剂量组小鼠给药后3 h痛阈值低于乳核散结片组,差异有统计学意义(P<0.05)。广义估计方程结果显示,组间比较Waldχ2=14.383,P=0.013,表明不同组别之间痛阈值差异有统计学意义(P<0.05);时间比较,Waldχ2=5.432,P=0.066,表明不同时间点之间痛阈值比较,差异无统计学意义(P>0.05);组别因素与时间因素存在交互效应(P<0.05),表明各组痛阈值变化幅度不一致。(见表2~3)
表2 各组小鼠痛域值比较 (±s)
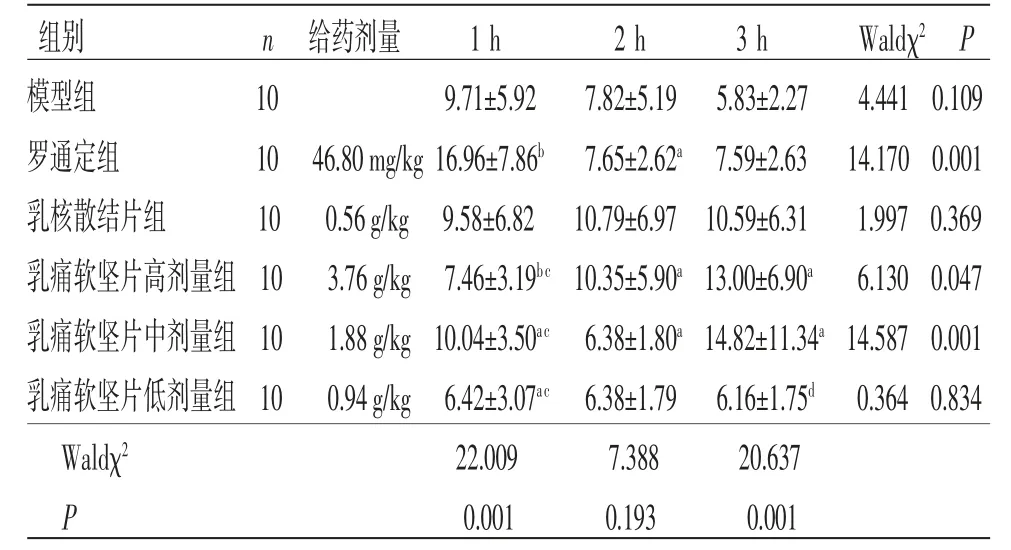
表2 各组小鼠痛域值比较 (±s)
注:与模型组比较,aP<0.05,bP<0.01;与罗通定组比较,cP<0.01,与乳核散结片组比较,dP<0.05。
组别 n 给药剂量 1 h 2 h 3 h Waldχ2 P模型组 10 9.71±5.92 7.82±5.19 5.83±2.27 4.441 0.109罗通定组 10 46.80 mg/kg 16.96±7.86b 7.65±2.62a 7.59±2.63 14.170 0.001乳核散结片组 10 0.56 g/kg 9.58±6.82 10.79±6.97 10.59±6.31 1.997 0.369乳痛软坚片高剂量组 10 3.76 g/kg 7.46±3.19bc 10.35±5.90a 13.00±6.90a 6.130 0.047乳痛软坚片中剂量组 10 1.88 g/kg 10.04±3.50ac 6.38±1.80a 14.82±11.34a 14.587 0.001乳痛软坚片低剂量组 10 0.94 g/kg 6.42±3.07ac 6.38±1.79 6.16±1.75d 0.364 0.834 Waldχ2 22.009 7.388 20.637 P 0.001 0.193 0.001

表3 小鼠痛域值广义估计方程模型效应检验结果
3.3 大鼠肉芽肿实验 乳痛软坚片组高、中、低剂量组大鼠肉芽质量均低于模型组,差异均有统计学意义(P<0.01或P<0.05);乳痛软坚片组高、中、低剂量组大鼠肉芽质量与醋酸泼尼松组、乳核散结片组比较,差异均无统计学意义(P>0.05)。乳痛软坚片能抑制肉芽生长。(见表4)
表4 各组大鼠肉芽质量比较 (±s)

表4 各组大鼠肉芽质量比较 (±s)
注:与模型组比较,aP<0.05,bP<0.01。
组别 n 给药剂量 肉芽质量/(mg/100 g)模型组 10 59.54±9.41醋酸泼尼松组 10 5.40 mg/kg 44.83±11.31b乳核散结片组 10 0.39 g/kg 51.52±15.01乳痛软坚片高剂量组 10 2.60 g/kg 48.02±8.13b乳痛软坚片中剂量组 10 1.30 g/kg 50.59±5.52a乳痛软坚片低剂量组 10 0.65 g/kg 49.62±10.04a F 2.28 P 0.059
3.4 大鼠足肿胀实验 乳痛软坚片高剂量组大鼠在致炎后1、3、4 h足跖肿胀度均低于模型组,差异有统计学意义(P<0.05);乳痛软坚片中剂量组大鼠在致炎后3、4 h足跖肿胀度均低于模型组,差异有统计学意义(P<0.05)。乳痛软坚片高、中剂量组大鼠在致炎后1、2、3、4、5、6 h足跖肿胀度与阿司匹林组比较,差异均无统计学意义(P>0.05);乳痛软坚片低剂量组大鼠在致炎后1、2、4 h足跖肿胀度高于阿司匹林组,差异有统计学意义(P<0.05);乳痛软坚片低剂量组大鼠在致炎后3、4、5、6 h足跖肿胀度与阿司匹林组比较,差异均无统计学意义(P>0.05)。乳痛软坚片高剂量组大鼠在致炎后1 h足跖肿胀度低于乳核散结片组,差异有统计学意义(P<0.05);乳痛软坚片中、低剂量组大鼠在致炎后1 h足跖肿胀度与乳核散结片组比较,差异无统计学意义(P>0.05);乳痛软坚片高、中、低剂量组大鼠在致炎后2 h足跖肿胀度与乳核散结片组比较,差异无统计学意义(P>0.05);乳痛软坚片高、中剂量组大鼠在致炎后3 h足跖肿胀度低于乳核散结片组,差异有统计学意义(P<0.05);乳痛软坚片低剂量组大鼠在致炎后3 h足跖肿胀度与乳核散结片组比较,差异无统计学意义(P>0.05);乳痛软坚片高、中、低剂量组大鼠在致炎后4、5、6 h足跖肿胀度与乳核散结片组比较,差异无统计学意义(P>0.05)。广义估计方程结果显示,组间比较Waldχ2=52.079,P=0.000,表明不同组别之间足肿胀度差异有统计学意义(P<0.05);时间比较,Waldχ2=59.600,P=0.000,表明不同时间点之间足肿胀度差异有统计学意义(P<0.05);组别因素与时间因素存在交互效应(P>0.05),表明不同组别大鼠足肿胀度变化幅度不一致。(见表5~6)
表5 各组大鼠足肿胀度比较 (±s,mL)
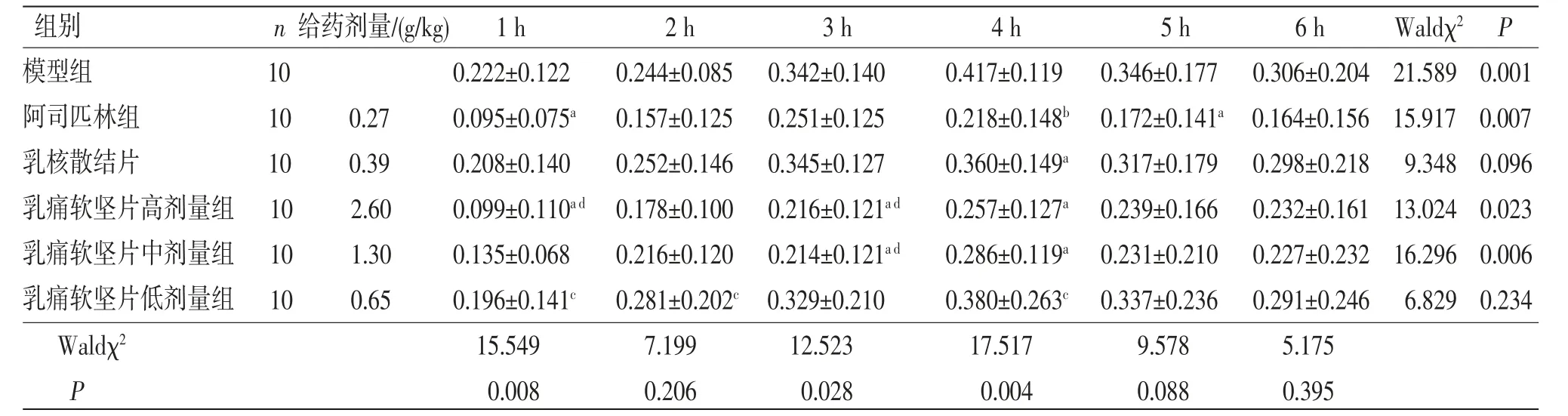
表5 各组大鼠足肿胀度比较 (±s,mL)
注:与模型组比较,aP<0.05,bP<0.01;与阿司匹林组比较,cP<0.05;与乳核散结片组比较,dP<0.05。
组别 n 给药剂量/(g/kg) 1 h 2 h 3 h 4 h 5 h 6 h Waldχ2 P模型组 10 0.222±0.122 0.244±0.085 0.342±0.140 0.417±0.119 0.346±0.177 0.306±0.204 21.589 0.001阿司匹林组 10 0.27 0.095±0.075a 0.157±0.125 0.251±0.125 0.218±0.148b 0.172±0.141a 0.164±0.156 15.917 0.007乳核散结片 10 0.39 0.208±0.140 0.252±0.146 0.345±0.127 0.360±0.149a 0.317±0.179 0.298±0.218 9.348 0.096乳痛软坚片高剂量组 10 2.60 0.099±0.110a d 0.178±0.100 0.216±0.121a d 0.257±0.127a 0.239±0.166 0.232±0.161 13.024 0.023乳痛软坚片中剂量组 10 1.30 0.135±0.068 0.216±0.120 0.214±0.121a d 0.286±0.119a 0.231±0.210 0.227±0.232 16.296 0.006乳痛软坚片低剂量组 10 0.65 0.196±0.141c 0.281±0.202c 0.329±0.210 0.380±0.263c 0.337±0.236 0.291±0.246 6.829 0.234 Waldχ2 15.549 7.199 12.523 17.517 9.578 5.175 P 0.008 0.206 0.028 0.004 0.088 0.395
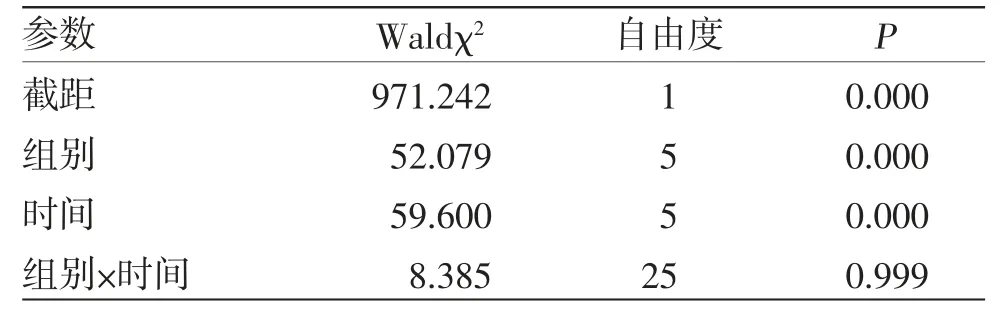
表6 大鼠足肿胀度广义估计方程模型效应检验结果
3.5 小鼠血清溶血素实验 乳痛软坚片高剂量组小鼠血清溶血素高于模型组,差异有统计学意义(P<0.01);乳痛软坚片中、低剂量组小鼠血清溶血素与模型组比较,差异无统计学意义(P>0.05)。乳痛软坚片高、中、低剂量组小鼠溶血素与左旋咪唑组、乳核散结片组比较,差异均无统计学意义(P>0.05)。(见表7)
表7 各组小鼠血清溶血素比较 (±s)

表7 各组小鼠血清溶血素比较 (±s)
注:与模型组比较,aP<0.05,bP<0.01。
组别 n 给药剂量 溶血素/(光密度OD)模型组 10 0.764±0.342左旋咪唑组 10 22.75 mg/kg 1.234±0.350b乳核散结片组 10 0.56 g/kg 1.137±0.430a乳痛软坚片高剂量组 10 3.76 g/kg 1.155±0.205b乳痛软坚片中剂量组 10 1.88 g/kg 1.165±0.406乳痛软坚片低剂量组 10 0.94 g/kg 0.940±0.327 F 2.57 P 0.037
3.6 碳粒廓清实验 乳痛软坚片高、中、低剂量组小鼠廓清指数、吞噬指数均高于模型组,差异均有统计学意义(P<0.01或P<0.05)。乳痛软坚片高、中、低剂量组小鼠廓清指数、吞噬指数均低于左旋咪唑组,差异均有统计学意义(P<0.05)。乳痛软坚片高、低剂量组小鼠廓清指数与乳核散结片组比较,差异均无统计学意义(P>0.05);乳痛软坚片中剂量组小鼠廓清指数高于乳核散结片组,差异有统计学意义(P<0.05);乳痛软坚片高、中、低剂量组小鼠吞噬指数与乳核散结片组比较,差异均无统计学意义(P>0.05)。(见表8)
表8 各组小鼠廓清指数、吞噬指数比较 (±s)
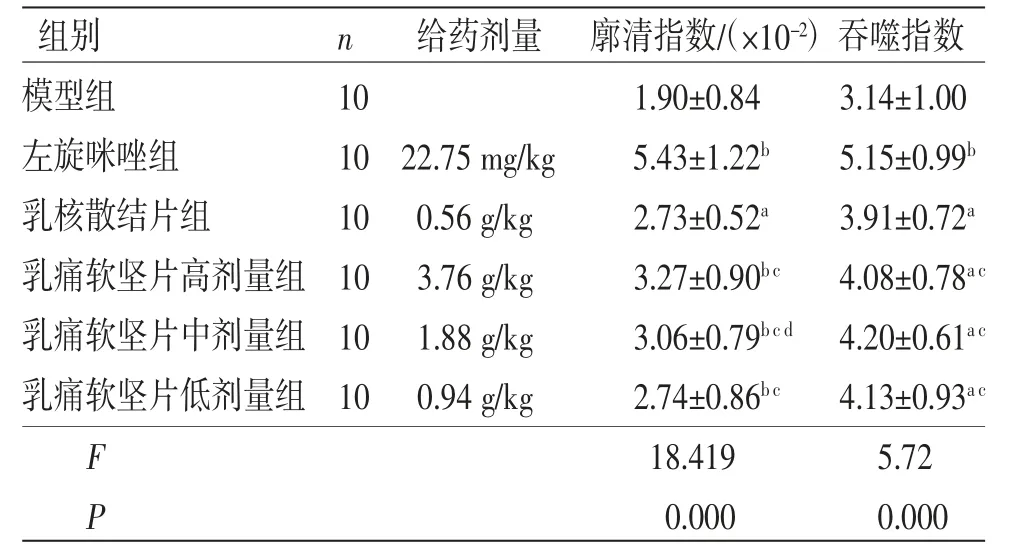
表8 各组小鼠廓清指数、吞噬指数比较 (±s)
注:与模型组比较,aP<0.05,bP<0.01;与左旋咪唑组比较,cP<0.05;与乳核散结片组比较,dP<0.05。
组别 n 给药剂量 廓清指数/(×10-2)吞噬指数模型组 10 1.90±0.84 3.14±1.00左旋咪唑组 10 22.75 mg/kg 5.43±1.22b 5.15±0.99b乳核散结片组 10 0.56 g/kg 2.73±0.52a 3.91±0.72a乳痛软坚片高剂量组 10 3.76 g/kg 3.27±0.90b c 4.08±0.78a c乳痛软坚片中剂量组 10 1.88 g/kg 3.06±0.79b c d 4.20±0.61a c乳痛软坚片低剂量组 10 0.94 g/kg 2.74±0.86b c 4.13±0.93a c F 18.419 5.72 P 0.000 0.000
4 讨 论
目前,乳腺增生治疗主要以口服激素类药物或碘制剂为主。此外,手术也可治疗乳腺增生。但上述治疗存在不良反应、依赖性、易复发、损伤大等问题,给患者造成较大的困扰。中医药疗法以活血化瘀、疏肝理气、调和冲任为主要治法,可以标本兼治,且疗效确切。中药治疗乳腺增生以中药内服为主,该类方剂大多数以柴胡、当归等药物为主要组成,如柴胡舒肝散、柴青消痛颗粒等[11]。除此之外,中药穴位贴敷、针灸、推拿、膏药外贴等中医外治法也可运用于乳腺增生治疗,具有较好的治疗效果[12-13]。
乳痛软坚片基本组成药物为柴胡、陈皮、川楝子、延胡索、当归、白芍、莪术、川贝母、党参、甘草等。方中柴胡解表退热,疏肝解郁;陈皮理气健脾,燥湿化痰;川楝子行气止痛;延胡索活血,行气,止痛;当归补血调经,活血止痛;白芍养血敛阴,柔肝止痛,平抑肝阳;莪术破血行气,消积止痛;川贝母清热化痰,散结消痈;党参补脾肺之气,补血生津;甘草补脾益气,缓急止痛,清热解毒,调和药性。全方配伍,共奏疏肝解郁、化痰散结、活血止痛之功。延胡索主要有效成分延胡索乙素具有明显止痛作用。川楝子醇提物具有明显的抗炎镇痛作用[14]。莪术的主要单体成分为姜黄素、莪术醇、β-榄香烯等,其中姜黄素具有抗炎、抗肿瘤作用,莪术醇、β-榄香烯具有抗肿瘤活性[15]。川贝母中的生物碱类成分具有良好的抗炎作用[16]。其作用机制是通过抑制炎症反应信号通路中MAPKs的磷酸化活性从而使炎症介质水平下降,并且使核转录因子NF-κB转录强度降低[17-18]。川贝母中的贝母素甲能阻断Nav1.7靶点以及其他钠离子通道以达到镇痛效果[19-20]。柴胡主要活性成分为挥发油类、柴胡皂苷类、黄酮类、香豆素类等,具有调节免疫、抗炎、退热、保肝、抗肿瘤等多种作用[21]。当归中富含苯酞类、有机酸、酯类、多糖等多种化学成分,具有抗炎、镇痛、调节免疫、抗肿瘤、治疗心血管疾病、神经保护和抗氧化等作用[22-23]。白芍主要成分白芍总苷可通过多种途径抑制自身免疫反应并双向调节免疫功能,维持机体免疫耐受[24-25]。陈皮中的黄酮类、挥发油类等成分均具有抑菌消炎的作用[26]。党参中的党参多糖(CPP)可以增强环磷酰胺所导致免疫功能低下大鼠的免疫功能[27]。甘草总黄酮能下调一氧化氮合酶(iNOS)、环氧化酶2(COX-2)表达,降低细胞外调节蛋白激酶(ERK)的磷酸化水平,调控RK/MAPK和PPAR-γ从而达到抗炎的功效[28]。甘草多糖具有增强免疫的作用,能促使T淋巴细胞的激活,从而增强免疫活性[29]。
本研究中镇痛实验显示乳痛软坚片可减少小鼠的扭体次数,延长潜伏期和增加小鼠痛阈值,表明乳痛软坚片具有明显的镇痛作用。抗炎动物实验显示,乳痛软坚片能显著抑制大鼠肉芽肿的生长,降低大鼠足肿胀度,具有抗炎及抑制炎症组织增生的作用。调节免疫药理实验显示,乳痛软坚片能升高小鼠血清溶血素水平、廓清指数和吞噬指数,表现出良好调节免疫作用。
综上所述,乳痛软坚片具有镇痛、抗炎和调节免疫的作用,可为其临床防治乳腺增生提供实验依据。

