脱氢胆酸调控OPG/RANK和TRAF3抑制破骨细胞分化
朱禹潼 张晓楠 关溪 尚东,3*
1.大连医科大学附属第一医院中西医结合临床重点学科实验室,辽宁 大连 116011
2.大连医科大学中西医结合研究院(学院),辽宁 大连 116044
3.大连医科大学附属第一医院普外三科,辽宁 大连 116011
骨质疏松症是一种代谢性骨病,以骨量丢失和结构退化为特征,易发生脆性骨折[1]。骨质疏松症影响着全球2亿多人[2]。在中国,骨质疏松症和老龄化的速度都在上升。中国男性和女性老年人大于50岁的骨质疏松患病率分别为6.46%和29.13%[3]。在全球范围内,骨质疏松及其相关的脆性骨折给患者带来了巨大的健康和经济负担,一直是主要的健康问题[4-5]。目前治疗骨质疏松的药物有双膦酸盐、降钙素、选择性雌激素受体调节剂和地诺单抗[6]。然而,大多数药物有严重的副作用或不适合长期使用。
骨骼经过不断的重塑以保持矿化平衡和结构完整性。骨重建过程中,成骨细胞(骨形成)与破骨细胞(骨吸收)相互作用导致骨稳态[7]。过度骨吸收引起的骨稳态紊乱可导致骨质疏松[8]。来自单核巨噬细胞的破骨细胞(osteoclasts,OCs)促进骨吸收。巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)和核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)共同诱导破骨细胞分化[9]。NF-κB受体活化因子(receptor activator of NF-κB,RANK)与RANKL结合,通过激活一系列下游靶向因子激活OCs[10]。
脱氢胆酸(dehydrocholic acid,DHCA)是一种人工合成的胆汁酸衍生物。DHCA作为一种利胆药,用于治疗急性胆源性胰腺炎,可抑制胰腺组织水肿和坏死[11]。也用于治疗胆管功能障碍、胆囊结石等疾病。然而,DHAC在骨质疏松症中的作用尚不清楚。有研究首次报道了正常人血清中DHCA含量显著高于骨质疏松患者[12]。因此,DHCA可能是用于治疗骨质疏松的一种新方法,本文研究了DHCA在体外对OCs分化和功能的影响。
1 材料与方法
1.1 材料
粒细胞-巨噬细胞集落刺激因子(美伦公司);RANKL(MedChemExpress公司);Phalloidin-iFluor 594(Abcam公司);OPG和β-actin单克隆兔抗小鼠抗体(Abcam公司);RANK单克隆兔抗小鼠抗体(Zenbio公司);TRAF3单克隆兔抗小鼠抗体(Proteintech公司);TRAP染色试剂盒(Genmed scientific公司);RNA提取试剂盒、Evo M-MLV逆转录试剂盒和SYBR®Green Pro Taq HS预混qPCR试剂盒(艾科瑞公司);DHCA(CAS编号81-23-2,Panphy Chemicals公司)。
1.2 方法
1.2.1骨髓巨噬细胞的分离与培养:由大连医科大学实验动物中心提供雄性C57BL/6小鼠(6~8周龄,体重20 g左右)用于研究(许可证号:AEE19001)。所有小鼠麻醉后颈椎脱位处死。将胫骨和股骨置于无菌超净实验台上,去除胫骨和股骨上的肌肉后,将骨骼置于PBS中。剪断骨骺,用PBS轻轻冲洗股骨和胫骨的髓腔,直至骨变成半透明。将细胞悬液离心(1 000 r/min,5 min),加入5 mL红细胞裂解液重悬细胞,4 ℃静置10 min后离心。在DMEM培养基(10%FBS+20 ng/mL GM-CSF)中培养3 d获得BMMs。
1.2.2破骨细胞的分化:BMMs在DMEM(10% FBS+20 ng/mL GM-CSF+50 ng/mL RANKL)完全培养基中分化为OCs。DHCA(10、50、100、150、200 μmol/L)与BMMs共培养至OCs分化成熟。培养4 d后采用TRAP染色法对OCs进行计数,显微镜下观察≥3个细胞核被视为OCs[13]。
1.2.3细胞活力测定:将细胞悬液接种于96孔板(2×103细胞/孔),孵育3 d。在第4天,实验组每孔分别加入10、50、100、200、500、1 000 μmol/L DHCA,每组6个复孔,孵育4 d后,加入CCK8孵育2 h后在波长450 nm,测定各孔的吸光度值。
1.2.4破骨细胞F-肌动蛋白(F-actin)染色:DHCA作用培养4 d采用F-actin染色。取出细胞培养皿,PBS冲洗细胞3次。4%多聚甲醛固定,0.5% Triton X-100溶液透化处理。加入Phalloidin-iFluor 594对F-actin染色。使用DAPI对细胞核进行复染,共聚焦显微镜下进行荧光观察。
1.2.5qRT-PCR:Trizol法提取总RNA。使用Evo M-MLV逆转录试剂盒进行逆转录反应。最后,采用SYBR®Green Pro Taq HS预混qPCR试剂盒检测OCs形成和分化相关基因。采用2-△△Ct法对结果进行分析。引物序列见表1。

表1 引物序列
1.2.6Western blot:培养至OCs分化成熟后,提取细胞蛋白。SDS-PAGE跑胶,转移到PVDF膜上,然后用5%脱脂牛奶封闭1 h,按照说明书稀释TRAF3、OPG、RANK(1∶2 000)和β-actin(1∶5 000),4 ℃孵育过夜。二抗(1∶10 000)于次日室温孵育1 h。采用ECL系统(Tanon-5200)进行印迹检测。根据灰度值数据(ImageJ 1.8.0)分析各蛋白的相对表达量。
1.3 统计分析
使用GraphPad Prism 8.4.3对所有数据进行分析,用t检验分析两组间的显著性差异。P<0.05为差异有统计学意义。
2 结果
2.1 DHCA抑制破骨细胞形成
为探讨DHCA抑制OCs分化的有效浓度,首先检测DHCA的细胞毒性,结果显示当DHCA浓度≥500 μmol/L时,细胞活力下降(图1A)。随后分别用10、50、100、150、200 μmol/L DHCA干预OCs分化。TRAP染色显示,与未使用DHCA的对照组相比,DHCA处理后TRAP阳性细胞(红色区域)数量呈剂量依赖性减少。DHCA在200 μmol/L时对OCs分化的抑制率最大(图1B、1C)。
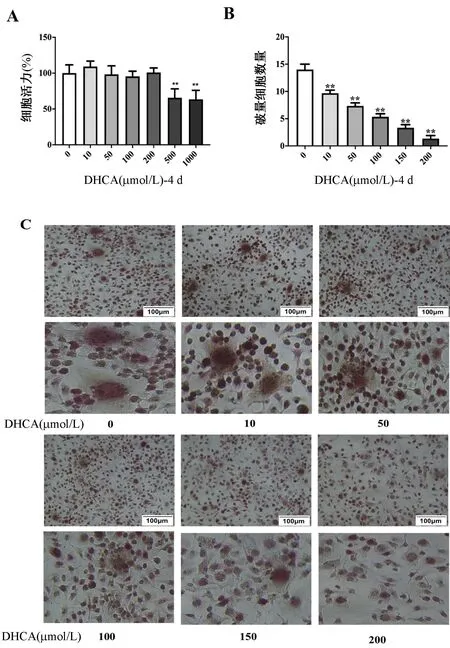
图1 DHCA抑制破骨细胞分化
2.2 DHCA抑制破骨细胞F-actin环的形成
采用破骨细胞F-actin染色,以观察成熟的破骨细胞F-actin的形成。与对照组(未使用DHCA)相比,DHCA能抑制F-actin环的形成,见图2。

图2 DHCA抑制破骨细胞F-actin环的形成
2.3 DHCA抑制破骨细胞形成与分化功能相关基因表达
用200 μmol/L DHCA干预OCs分化,qRT-PCR检测OCs特异性基因ACP5、CTSK和MMP9的表达水平。如图3所示,与对照组(未使用DHCA)相比,DHCA显著抑制了与OCs分化成熟相关的ACP5 mRNA,以及与骨吸收功能相关的CTSK和MMP9 mRNA的表达。
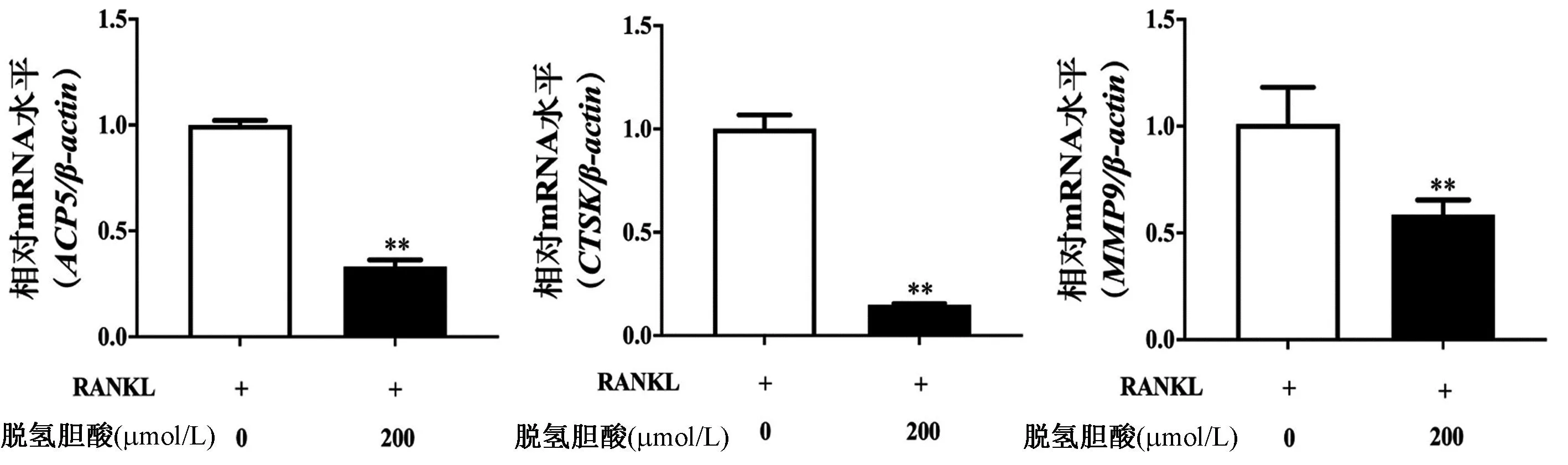
图3 DHCA抑制破骨细胞特异性基因表达
2.4 DHCA通过OPG/RANK和TRAF3抑制破骨细胞分化
Western blot结果显示,与对照组(未使用DHCA)相比,DHCA显著增加OPG水平,降低RANK水平,见图4。结果表明,DHCA通过抑制OPG/RANK/RANKL信号通路抑制OCs分化。RANKL刺激后,TRAF3蛋白水平降低,DHCA可逆转该作用。DHCA可通过抑制TRAF3蛋白降解从而抑制OCs分化。

图4 DHCA通过OPG/RANK和TRAF3抑制OCs分化(DHCA体外作用4 d)
3 讨论
骨重建功能稳态依赖于成骨细胞的骨形成和OCs的骨吸收的共同维持。OCs的过度激活导致骨量丢失和骨微结构破坏,导致骨质疏松性骨病。抑制OCs的活化、分化和功能是目前公认的治疗骨质疏松的有效方法。目前尚无DHCA用于治疗骨质疏松或其他骨代谢疾病的报道。根据代谢组学分析,骨质疏松患者血清中DHCA含量较正常人明显降低,为骨代谢疾病药物的开发提供了拓展思路。在OC和OC前体细胞中,RANKL与其配体RANK结合,通过激活下游通路,包括NF-κB和丝裂原活化蛋白激酶,刺激OC相关下游因子的表达,导致OC的分化、活化和成熟[14-15]。本研究中,TRAP染色显示DHCA以剂量依赖性方式抑制RANKL诱导的OCs形成。ACP5在活化的OCs中高表达,是OCs分化的特异性基因。CTSK是OCs中最重要的细胞因子,对骨组织具有特异性降解活性,反映了OCs的骨吸收功能[16]。MMP参与了骨的发育、修复以及细胞外基质的重塑。OCs分化过程中MMP9的表达上调,进而刺激骨吸收[17-18]。本研究发现DHCA通过下调ACP5、CTSK和MMP9基因的表达来抑制OCs分化和骨吸收。
OPG/RANK/RANKL信号通路在调控成骨细胞和OCs的成熟和分化,维持成骨细胞和OCs的动态平衡中发挥重要作用[19]。OPG/RANKL/RANK信号的异常调控是骨质疏松发生的前提。OC前体细胞或OC表面RANK与RANKL结合,介导信号激活OC前体细胞分化为成熟OC,抑制OC凋亡[20-21]。OPG是一种分泌型糖蛋白,属于TNF受体超家族。OPG可与RANKL竞争性结合,从而抑制RANKL与RANK结合,抑制OCs分化和骨吸收活性[22-23]。DHCA可上调OPG蛋白的表达,下调RANK蛋白的表达,表明DHCA通过OPG/RANK/RANKL信号通路抑制OCs分化。
TNF受体相关因子(TNF receptor-associated factors,TRAF)是OCs中RANK激活所必需的[24]。RANK通过招募TRAFs启动下游信号级联[25]。TRAFs由多种亚型组成,TRAF2、TRAF3和TRAF6在OCs分化的研究中常见。TRAF3使cIAP1/2介导K48-link泛素化,导致蛋白酶体中TRAF3降解,激活非经典NF-κB信号通路[26-28]。TRAF3抑制衰老中破骨细胞的生成[29]。此外,一项研究表明氯喹可以通过阻止TRAF3降解来减少破骨细胞的生成[30]。本研究结果表明TRAF3是OCs形成的重要负调控因子,表明DHCA可以通过阻断TRAF3的降解来抑制OCs的形成。
综上所述,本研究表明DHCA抑制OCs形成与分化,可能是通过抑制OPG/RANK/RANKL信号通路及阻断TRAF3降解,抑制OCs形成与分化。

