淫羊藿苷预防模拟微重力大鼠骨丢失及氧化应激的作用
王中琪 吴西 高玉海 柏鑫 陈克明,3*
1.中国人民解放军联勤保障部队第九四○医院基础医学实验室,甘肃 兰州 730050
2.甘肃中医药大学中医临床学院,甘肃 兰州 730030
3.甘肃省干细胞与基因药物重点实验室,甘肃 兰州 730050
伴随着载人航空事业的进步,宇航员在太空失重环境发生的骨骼和肌肉丢失、心血管功能障碍等问题却日益突出,其中骨丢失是至今仍未解决的一个难题[1]。有研究发现在国际空间站任务期间,8名航天员的股骨骨密度降低了3%~10%,其中4名股骨颈骨密度降低了1.7%~10.5%。并且有7名宇航员的腰椎骨密度降低了2.5%~10.6%,而在正常重力环境中患有骨质疏松症的人群每年的骨量流失率仅为0.5%~1%[2]。这一发现表明,失重条件下骨密度的下降速度远快于骨质疏松症的人群[3]。目前针对太空失重引起骨丢失采取的防治措施包括运动预防法、电磁场疗法和药物治疗等[4]。但运动疗法与电磁场疗法存在一定的不便,而长期使用双膦酸盐类药物又存在潜在的副作用,因此笔者尝试从中医角度寻找新的治疗方法。
中药淫羊藿最早记载于《神农本草经》,认为其具有温肾益阳、强筋骨、固精等功效[5]。研究发现淫羊藿有效成分含量研究主要集中于黄酮类成分,其中淫羊藿苷为淫羊藿黄酮类中主要有效成分,在预防绝经后骨质疏松方面也具有较好的疗效[6]。相关研究表明淫羊藿苷可以通过激活成骨基因表达,促进骨髓间充质干细胞成骨分化,预防绝经后骨质疏松[7]。程琳燕等[8]研究发现,淫羊藿苷通过下调RANKL-p38/ERK-NFAT信号通路抑制破骨细胞分化,从而保护骨组织结构。同时本课题组前期研究发现,淫羊藿苷可以提高成骨细胞活性,促进骨髓基质干细胞的成骨性分化,抑制破骨细胞发生与骨吸收活性,并且通过体内实验发现淫羊藿苷可以提高生长期大鼠峰值骨量以及预防切出卵巢发生绝经后骨质疏松[9-15]。
基于淫羊藿苷抗绝经后骨质疏松症领域的研究以及本团队前期研究成果,本研究提出淫羊藿苷具有预防微重力环境导致的骨丢失作用的假说。为了证明此假说,本实验采用国际公认的大鼠鼠尾悬吊模型来研究微重力环境下引起的骨丢失,并查阅相关文献给予淫羊藿苷50 mg/kg进行干预治疗,对比各组大鼠的骨微结构、血清骨代谢指标、骨形成相关蛋白表达水平及氧化应激水平的差异来证明淫羊藿苷能预防模拟微重力环境下大鼠骨丢失并研究其作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物:2月龄Wistar雄性大鼠30只,体重(200±10) g。饲养于中国人民解放军联勤保障部队第九四○医院动物实验中心(许可证编号:SYXK(军)2017-0047),自由进食、摄水。本实验经中国人民解放军联勤保障部队第九四○医院科研管理伦理委员会审查符合动物伦理(审批编号:2021KYLL184)。
1.1.2实验药物及试剂:淫羊藿苷(宝鸡辰光生物科技有限公司,纯度98%,产品批号:HI008055298);戊巴比妥钠(美国sigma化学公司,产品批号:11715-100G);β-actin、Runx2、COL-1、BMP2、OSX抗体(江苏亲科生物有限公司,批号:AF7018、AF4770、AF7001、DF6034、AF7580);山羊抗兔IgG-HRP抗体(巴傲得生物科技有限公司,批号:BS13278);PINP、CTX-1、OPG、RANKL、8-iso-PGF2α、8-OHdG ELISA试剂盒(泉州睿信生物科技有限公司,批号:20211217-30103B、20211217-35070B、20211217-30397B、20211217-30432B、20211217-30030B、20211217-30027C);MDA、SOD试剂盒(南京建成生物工程研究所,批号:A003-1-2、A001-3-2)。
1.1.3实验仪器与设备:NMC-100型Micro-CT(平生医疗科技);全波长酶标测试仪(Epoch Biotek);Scientz-48L冷冻型高通量组织研磨器(宁波新芝生物科技有限公司);MiniChemiTM580型化学发光成像分析系统(森西赛智);DP71型正置显微镜(奥林巴斯)。
1.2 方法
1.2.1动物分组及模型建立:将2月龄雄性Wistar大鼠利用随机数字表法分为CON组、HLS组、ICA组,每组10只,CON组单只分笼饲养,HLS组和ICA组大鼠均建立大鼠鼠尾悬吊模型,具体模型建立方法参考陈杰等[16]的改良方法。尾吊模型建立后,ICA组按50 mg/kg浓度灌胃给药,CON组及HLS组给予等体积的蒸馏水灌胃,每日1次,灌服28 d后,腹腔注射戊巴比妥钠(40 mg/kg)麻醉下取血处死,摘取主要脏器及骨骼。
1.2.2检测指标:(1)Micro-CT扫描股骨及腰椎。对大鼠左侧股骨及第4腰椎进行Micro-CT扫描,感兴趣区域为距离股骨髁上2 mm,厚度2 mm区域及第4腰椎椎体中心1 cm3立方体,获得三维结构图以及骨小梁详细结构参数。(2)ELISA血清骨代谢指标分析。大鼠通过腹主动脉采血液样本,4 ℃冰箱静置1 h后以3 500 r/min离心15 min,吸取上清液,按照双抗体酶联免试剂盒说明书,采用ELISA检测法测定大鼠血清骨代谢指标PINP、CTX-1、OPG、RANKL的含量。(3)Western blotting分析骨形成相关蛋白。取胫骨髁下4 mm骨组织剪碎,提取骨组织蛋白样品,上样,电泳,电转,封闭2 h,分别加入COL-1、Runx2、BMP2、OSX和β-actin抗体4 ℃过夜,次日加入山羊抗兔IgG-HRP抗体,室温孵育2 h后曝光,用ImageJ软件对结果进行量化分析。(4)氧化与抗氧化指标检测。采用WST-1法检测血清中的SOD活力,TBA法检测血清中的MDA含量,ELISA检测法测定大鼠血清中8异前列腺素F2α(8-iso-PGF2α)和8-羟基脱氧鸟苷(8-OHdG)的含量。
1.3 统计学处理
采用SPSS 23.0、Graphpad Prism9.3.1软件进行数据分析,本实验所有数据均为定量资料,符合正态分布的数据以均数±标准差表示,不服从正态分布采用中位数和四分位数间距(M,IQ)表示。符合正态分布且方差齐性的多组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 Micro-CT股骨及腰椎扫描结果
通过股骨骨小梁三维重建图及股骨纵截面可观察到CON组骨小梁密集交织呈网状;HLS组的骨小梁分布稀疏且骨小梁之间的孔隙明显;ICA组骨小梁分布密度与CON组接近(图1A)。骨小梁参数的量化结果显示,与CON组相比,HLS组的BMD、BS/TV、BV/TV、Tb.N及Tb.Th均降低(P<0.05),且Tb.Sp升高(P<0.05)。与HLS组相比,ICA组的BMD、BS/TV、BV/TV、Tb.N及Tb.Th均升高(P<0.05),而Tb.Sp降低(P<0.05)(图1B)。
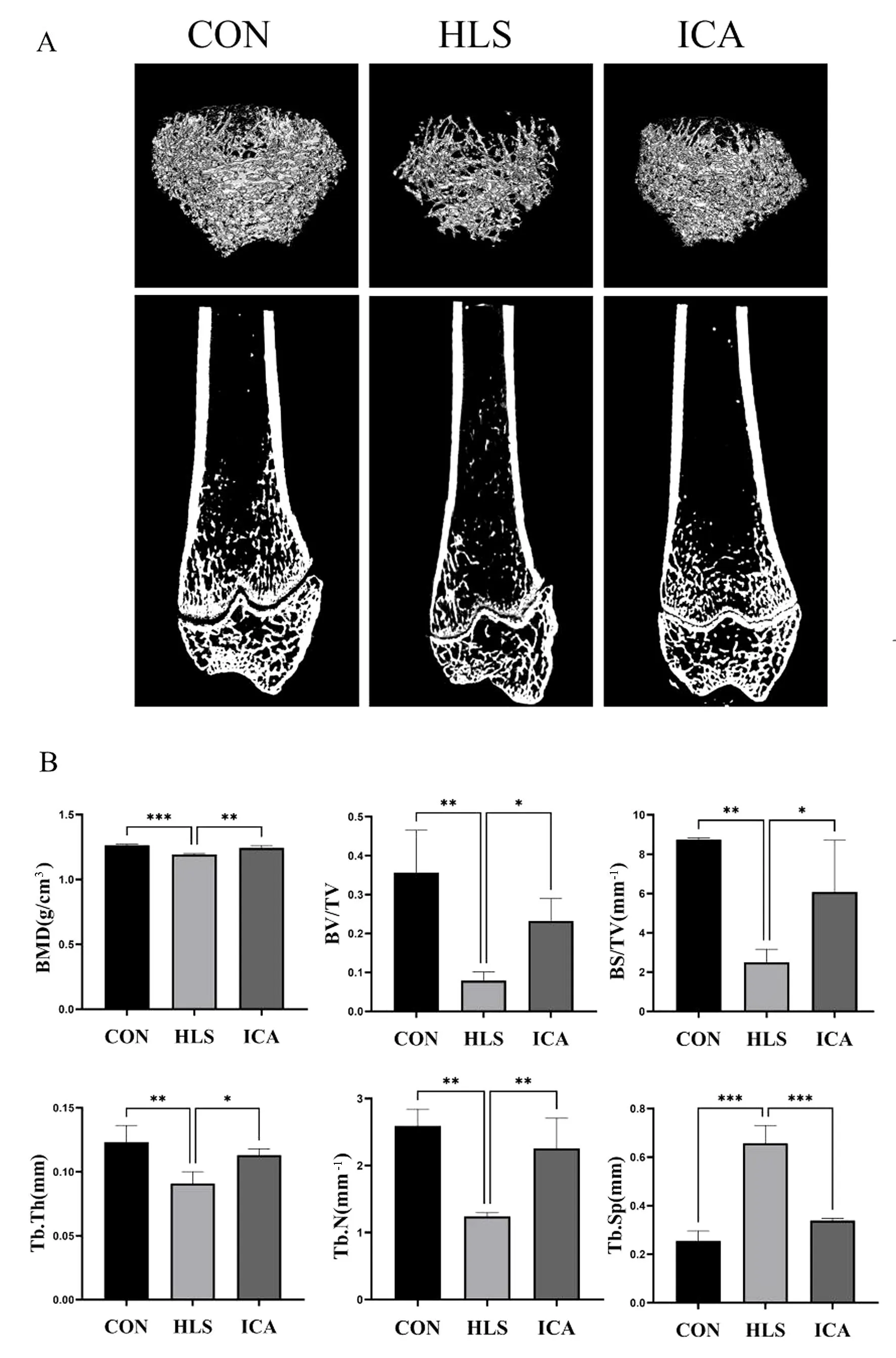
图1 各组大鼠股骨远端Mirco-CT三维重建及扫描参数
同样在第4腰椎的三维重建图中,能观察到CON组的骨小梁交错排列,形成了紧密的网状结构;HLS组中的骨小梁分支显著减少,间隙增大,结构疏松;ICA组骨小梁仍呈致密的网状结构(图2A)。根据对骨小梁参数的量化结果可知,与CON组相比,HLS组的BMD、BS/TV、BV/TV、Tb.N及Tb.Th均降低(P<0.05),且Tb.Sp升高(P<0.05)。与HLS组相比,ICA组的BMD、BS/TV、BV/TV、Tb.N及Tb.Th均升高(P<0.05),且Tb.Sp降低(P<0.05)(图2B)。
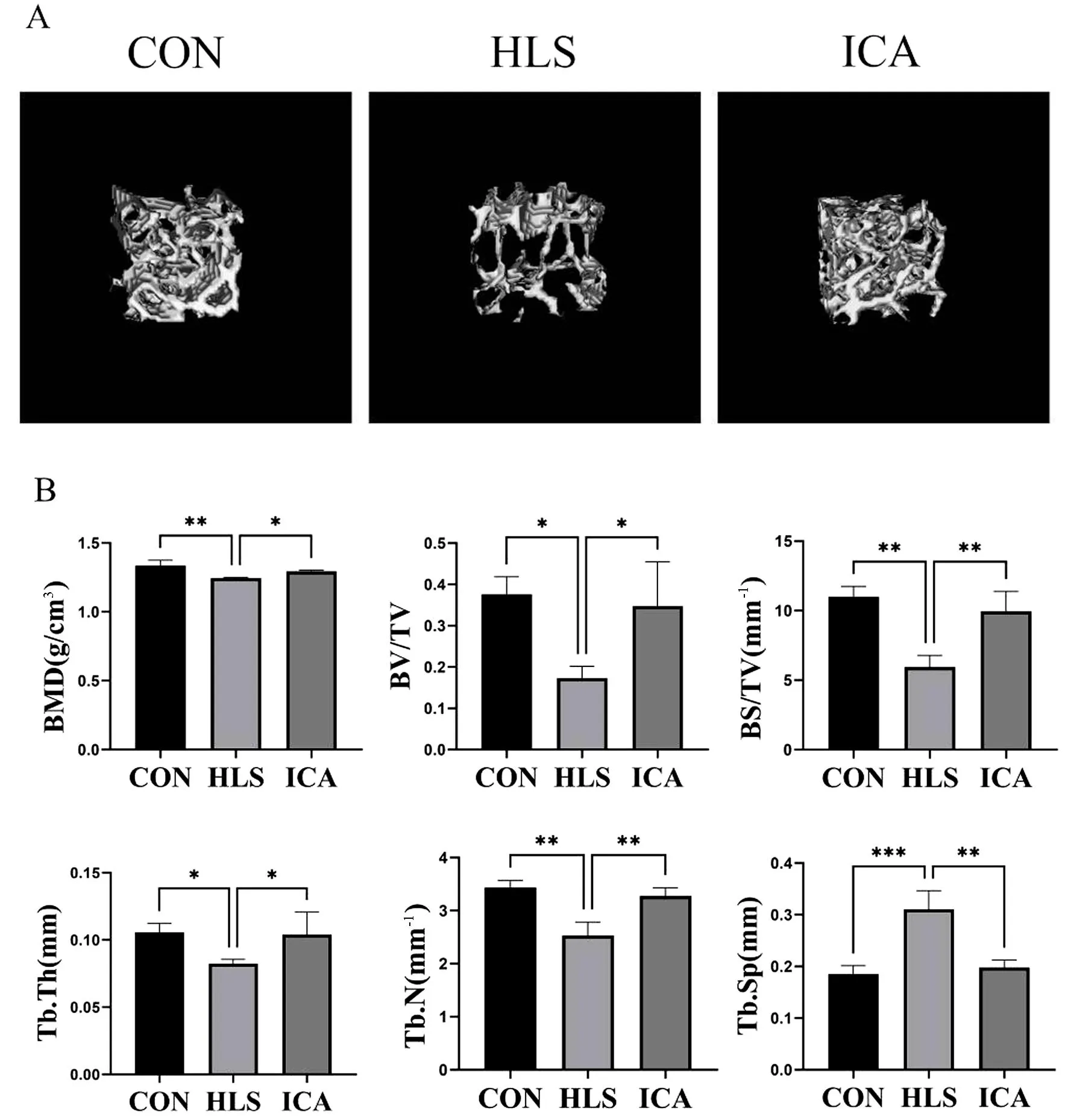
图2 各组大鼠第4腰椎Mirco-CT三维重建及扫描参数
2.2 血清骨代谢指标检测结果
如图3所示,与CON组相比,HLS组血清中骨形成指标PINP、OPG含量均降低(P<0.05),而骨吸收指标CTX-1、RANKL含量均升高(P<0.05);ICA组中骨形成指标PINP、OPG含量与骨吸收指标CTX-1含量与CON组相近(P>0.05)。与HLS组相比,ICA组血清中骨形成指标PINP、OPG含量均升高(P<0.05),骨吸收指标CTX-1、RANKL含量均降低(P<0.05)。
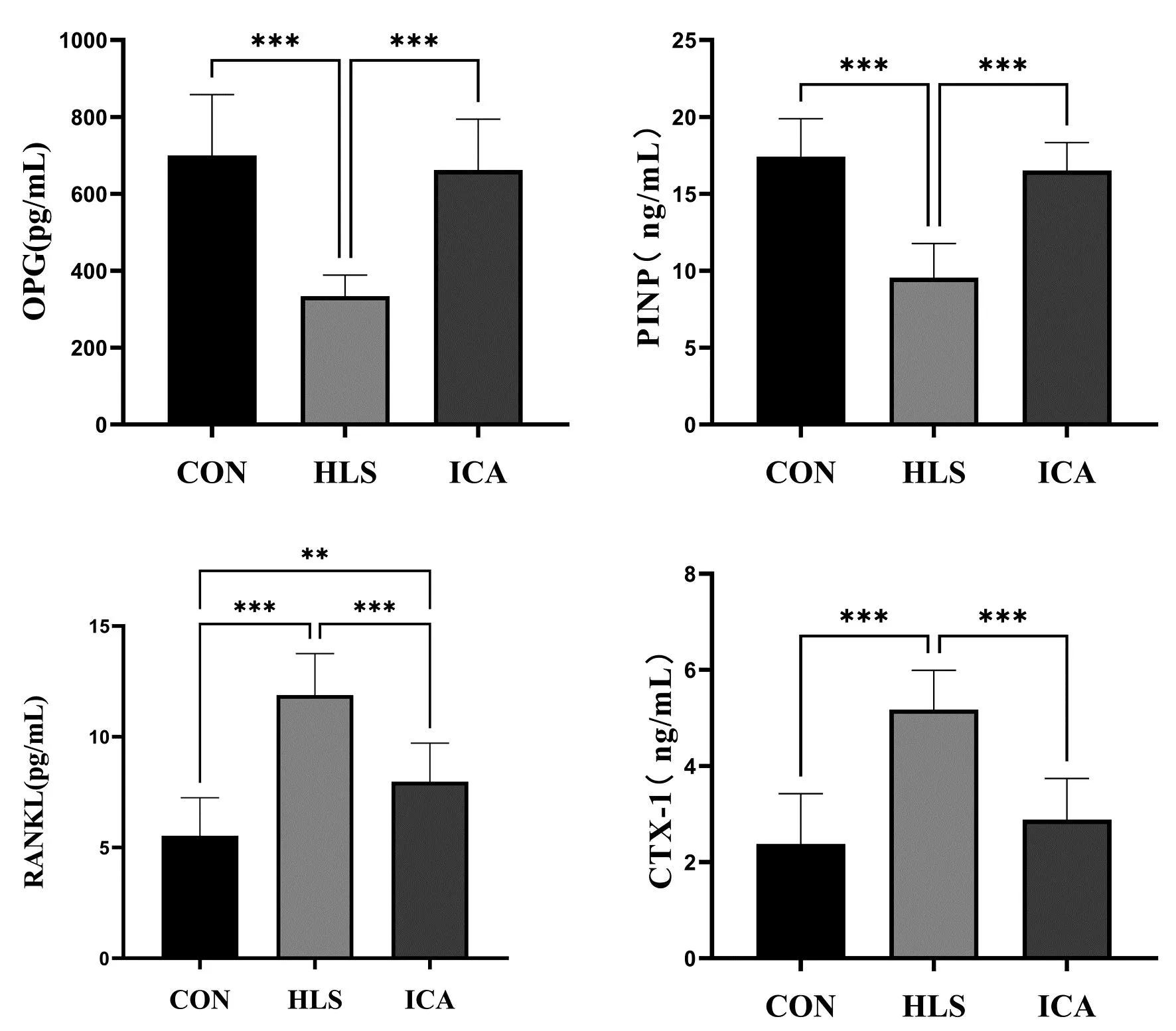
图3 各组大鼠血清骨代谢指标量化结果
2.3 Western blotting 检测骨形成蛋白结果
如图4所示,与CON组相比,HLS组BMP2、Runx2、COL-1、OSX蛋白表达均降低(P<0.05);ICA组Runx2、OSX蛋白表达与CON组相近(P>0.05)。与HLS组相比,ICA组BMP2、Runx2、COL-1、OSX蛋白表达均升高(P<0.05)。
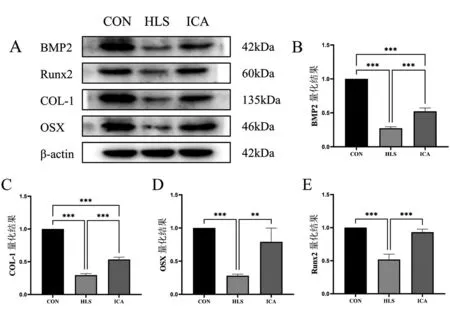
图4 各组大鼠骨形成蛋白表达结果
2.4 氧化与抗氧化指标检测结果
与CON组相比,HLS组血清中氧化指标8-iso-PGF2α、8-OhdG和MDA含量均升高(P<0.05),抗氧化指标SOD酶活力降低(P<0.05)。与HLS组相比,ICA组血清中8-iso-PGF2α、8-OHdG、MDA含量降低(P<0.05),SOD酶活力升高(P<0.05)(图5)。
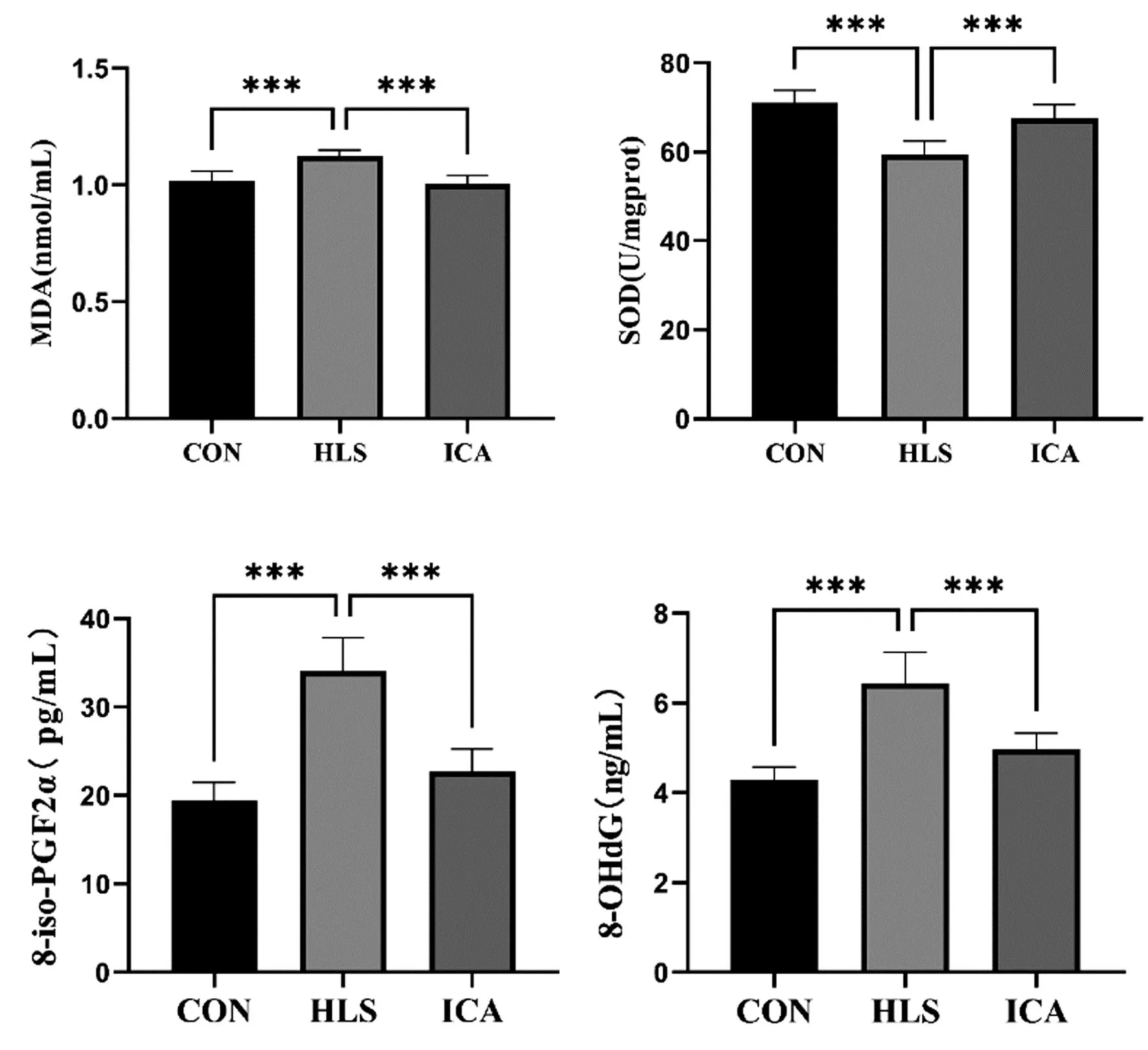
图5 各组大鼠氧化与抗氧化指标结果
3 讨论
骨丢失导致的骨小梁的显微结构和几何形状的改变是丢失程度的直观显示[17]。本实验首先通过Micro-CT提供的三维图像,观察骨小梁的形态结构和数量,分析骨小梁的参数变化。其结果能清晰地对比出各组间的骨丢失程度,与CON相比,HLS组骨小梁分布稀疏且连续性较差,骨小梁厚度减少,说明尾吊后导致HLS组发生骨丢失,骨微结构遭到破坏;与HLS组相比,ICA组骨小梁增厚,连续性较好,分布均匀。说明淫羊藿苷预防了骨小梁结构的破坏,抵抗了骨丢失导致的骨小梁形态特征改变。
在骨骼重建过程中,成骨细胞和破骨细胞会分泌不同的细胞因子、蛋白质和特定分子,这些分子可以影响骨吸收和骨形成[18]。这些分子也被称为骨形成标志物和骨吸收标志物,在血清中检测可反映骨细胞的活动状态[19]。本实验中HLS组PINP、OPG均降低,CTX-1、RANKL均升高,说明模拟微重力环境下大鼠成骨活动减弱,骨矿化减少,骨吸收增加;ICA组相较于HLS组PINP、OPG均升高,CTX-1、RANKL均降低,说明淫羊藿苷可以改善尾吊大鼠造成的成骨活动减弱,骨吸收增加。同时ICA组骨形成指标PINP、OPG含量与骨吸收指标CTX-1含量与CON组相近,说明灌服淫羊藿苷能促进尾吊大鼠骨形成,抑制骨吸收,并在一定程度上使骨形成和骨吸收恢复至正常水平。基于以上,本研究也对参与骨形成的相关蛋白COL-1、BMP-2、Runx2、OSX的表达进行了检测,结果显示HLS组的骨形成相关蛋白均呈下降趋势,ICA组的骨形成相关蛋白均高于HLS组,但与CON组仍存在一定差距。说明淫羊藿苷能在一定程度上调大鼠骨组织中COL-1、BMP2、Runx2、OSX的表达量,进而减缓微重力导致的骨丢失。
长时间的空间飞行后,人体内氧化剂的产生和抗氧化剂的防御之间的平衡被打乱,过量的氧化剂会导致骨骼氧化损伤[20]。相关研究表明,模拟微重力条件下成骨细胞的活性氧水平升高,增殖速率减慢,成骨活性下降,抗氧化干预能恢复成骨细胞细胞增殖速率和代谢[21]。MDA是常见氧化代谢产物,可以反映出体内细胞的损伤程度,8-iso-PGF2α和8-OhdG也是氧化损伤标志物,分别与脂质和DNA相关[22]。同时,测量SOD可以间接反映人体清除氧自由基的能力,与氧化损伤结合指标起来,可以较为全面地反映氧化应激状态。本实验中大鼠在微重力环境下体内脂质过氧化水平升高,清除氧自由基的能力下降,而淫羊藿苷能够减轻大鼠体内氧化应激水平预防骨丢失。相关研究表明,尾吊后大鼠体内的氧化标志物显著升高,并且包慧兰等[23]、赵博雅等[24]的研究中发现淫羊藿苷能抑制心肌线粒体MDA含量,增加心肌线粒体SOD活性。上述结果进一步验证本结论,淫羊藿苷能够减轻尾吊状态引起的氧化应激程度从而减少对骨细胞的损害,维持正常骨微结构及骨质量。
综上所述,本研究结果表明模拟微重力环境会引起骨密度下降,最大载荷下降,骨微结构退化,而淫羊藿苷能促进骨形成,抑制骨吸收,减轻体内氧化程度,提升抗氧化能力从而有效预防大鼠产生氧化应激反应导致骨丢失。未来,通过更多的实验和研究,也可以继续探索我国传统中药在太空探索和太空医学等领域的应用,为太空探索提供更多解决方案。

