pH 对大黄鱼肌原纤维蛋白结构性质及乳化性的影响
任中阳,崔雅清,陈玉峰,石林凡,2,郝更新,2,杨 燊,2,邱绪建,2,刘淑集,翁武银,2*
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.集美大学,厦门市海洋功能食品重点实验室,福建 厦门 361021;3.浙江工业大学,浙江省深蓝渔业资源高效开发利用重点实验室,浙江 杭州 310014;4.浙江工业大学食品科学与工程学院,浙江 杭州 310014;5.福建省水产研究所,福建 厦门 361000)
大黄鱼(Larimichthys crocea)具有肉质鲜美、蛋白含量高、胆固醇少等特点,深受广大消费者的喜爱[1]。其主要分布于黄海、东海、台湾海峡及南海北部,是中国四大海水经济鱼类之一[2]。大黄鱼作为中国特色水产养殖产品,是我国最具优势的出口水产品之一[3]。2019 年,我国养殖大黄鱼年产量达到22.55 万t,2020 年产量提升至25.4 万t[4-5]。为提升大黄鱼附加值,深入了解大黄鱼肌原纤维蛋白(myofibrillar protein,MP)结构和功能特性非常必要。
MP 是鱼肉的重要组成部分,占肌肉蛋白总量的60%~70%。关于采用不同处理方式如超高压处理、辐照处理、pH 处理、外源物添加等研究鱼肉MP 的结构组成和功能性质等已有大量报道[6]。张登科等[7]对养殖大黄鱼MP 的处理压力和保压时间的研究表明,其最大发射波长峰值随着压力增大而变大。张晗等[8]对花鲈(Lateolabrax japonicus)MP 表面疏水性的研究表明,其随电子束辐照剂量上升先增大后减小。Kristinsson 等[9]研究不同pH 下大西洋鳕(Gadus morhua)肌肉蛋白功能性质,结果表明酸和碱处理提高了MP 的乳化性能,这与表面疏水性有关,疏水性越高越有利于蛋白质与非极性油滴表面相互作用。何青[10]对不同pH下猪肉MP 的聚集状态分析表明,MP 颗粒的微观形态呈纤维状和不规则聚集状态。在pH 对MP 相关功能性质的研究中,主要集中在凝胶特性方面,通过改变pH 得到组织良好、相对有序致密的凝胶网络[11-12]。
pH 对MP 乳化特性影响的研究大部分集中在猪肉[13]、鸡肉[14]和部分鱼类如鳕[9]等方面。周心雅等[15]研究兔肉MP 性质,结果表明随pH 接近等电点,其氢键稳定性降低,二级结构变化,内部疏水性氨基酸暴露,蛋白三级结构展开,导致乳化活性减小。郭延娜等[16]研究在不同pH 条件下猪肉MP 的乳化性质,结果表明等电点附近(pH 值5~6)无法形成稳定乳液,而在pH 值6~7形成明显的水包油结构。选择合适的pH 对于大黄鱼MP 制备乳液的稳定性尤为重要。乳液可作为运输系统,用于封装、保护和释放稳定性差的功能性成分,其中脂溶性营养物质可以溶解在油脂中,被人体消化吸收[17]。此外,在极端酸性和碱性条件下,也可以将破乳技术应用于冷萃取鱼油[18]。然而,目前针对不同pH 下大黄鱼MP 乳化性的研究有限,有待进一步研究以满足大黄鱼蛋白质高值化开发利用的需求。
通过不同pH 处理大黄鱼MP,对其Zeta 电位、接触角以及内源荧光性进行分析。以不同pH 处理的大黄鱼MP 和大豆油为原料制备乳液,对乳液的形貌、电位以及稳定性进行分析。分析pH 对MP 结构及乳化性的影响,为开发大黄鱼产品提供理论依据。
1 材料与方法
1.1 材料与试剂
大黄鱼购于厦门市新华都购物广场,去头、去尾、去内脏、去皮,纯水清洗干净,取背部肌肉切块,自封袋包装,-24 °C 冷冻保藏。十二烷基硫酸钠(SDS)购于Sigma 公司。其他化学试剂均为分析纯。实验过程中操作人员严格遵守伦理规范,并按照集美大学伦理委员会制定的规章制度执行。
1.2 仪器与设备
Vanti J-26S 高速冷冻离心机,美国Beckman公司;UV-2600A 紫外分光光度计,上海元析仪器有限公司;SDC-200 光学接触角测量仪,东莞市晟鼎精密仪器有限公司;Cary Eclipse 荧光分光光度计,美国Agilent 公司;Zetasizer Nano-ZS90纳米粒度电位仪,英国Malvern 公司;S-4 800 电子扫描显微镜,日本东京日立制造所。
1.3 实验方法
MP 提取 参考Cao 等[19]MP 提取的方法,并略作修改。取冷冻大黄鱼背部肌肉,加入4 倍体积低盐磷酸缓冲液(0.02 mol/L Na2HPO4、0.02 mol/L NaH2PO4、0.05 mol/L NaCl,pH 7.5)漂 洗3 次,离心(9 500 r/min,15 min,4 °C)弃上清液取沉淀。沉淀与4 倍质量的高盐磷酸缓冲液(0.02 mol/L Na2HPO4、0.45 mol/L NaCl,pH 7.5)混合均匀,浸提12 h。混合物离心(9 500 r/min,15 min,4 °C),弃沉淀取上清液。上清液加入10 倍质量的冷凝水,静置3 h 后离心(9 500 r/min,15 min,4 °C),沉淀即为MP,冻干备用。
MP 溶液及乳液制备 称取0.5 g MP,分别溶于pH 为2、4、6、8、10、12 的50 mL 低盐磷酸缓冲液中。取10 g/L 不同pH 处理的MP 溶液与大豆油按照体积比1∶1 混合,经20 000 r/min高速均质2 min,4 °C 冷藏备用。
SDS-PAGE 参考Fang 等[20]SDS-PAGE 电泳的方法,并略作修改。将2 g/L 蛋白悬浮液经10 000 r/min 离心10 min,取上清液。测定条件:10%分离胶、4%浓缩胶、上样量10 μL,利用8 mA 恒定电流运行15 min,再采用16 mA 恒定电流至终点。用考马斯亮蓝R-250 染色24 h,采用脱色液(10%甲醇,30%乙酸)脱色45 min 至背景清晰。
接触角的测定 参考Ren 等[21]接触角的测定方法,并略作修改。不同pH 处理的MP 溶液冻干,取冻干样品0.25 g,压片机25 MPa 压制成片。测定条件:MP 压片置于油相,1 μL 超纯水液滴吸附至压片表面,计时2 min,利用接触角测量仪测定分析。
内源荧光性的测定 参考闫春子等[22]内源荧光性的测定方法,并略作修改。MP 溶液用高盐缓冲液稀释至0.5 g/L。测定条件:激发波长295 nm,激发和发射狭缝宽度为2.5 nm,波长扫描范围为300~400 nm,扫描速率为600 nm/min。
乳液微观形貌及Zeta 电位 参考丁俭等[23]乳液微观形貌的观察方法,并略作修改。测定条件:吸取1 滴乳液,滴于载玻片上,盖上盖玻片后于光学显微镜下,用40 倍物镜进行乳液液滴的形貌观察。参考王旭等[24]乳液Zeta 电位的测定方法,并略作修改。测定条件:将制备的MP 悬液及乳液稀释100 倍,采用纳米粒度电位仪测定其电位。
乳液稳定性的测定 参考Ren 等[25]测定乳液稳定性的方法,并略作修改。制备好的乳液立即取10 mL 于比色管中,测量乳液总的高度和底端乳清层的高度。乳析指数(creaming index,CI,%)计算公式:
式中,H0为乳化后初始阶段乳液总高度(cm),Ht为乳化后t时刻乳化层高度(cm)。
数据分析 用SPSS Statistics 17.0 软件进行数据分析。采用单因素分析中Duncan 氏两两比较法进行差异显著性分析(P<0.05),结果用平均值±标准偏差表示。
2 结果
2.1 pH 处理对大黄鱼MP 结构性质的影响
pH 对MP 的Zeta 电位影响 不同pH 处理大黄鱼MP 的Zeta 电位结果显示,等电点位于pH 4~6,在等电点左侧,pH 越接近等电点,Zeta电位绝对值越小;在等电点右侧,pH 6~12 Zeta电位绝对值较大,可达36.15 mV;在pH 12 时Zeta 电位绝对值相对pH 10 有所降低(图1)。

图1 pH 处理大黄鱼肌原纤维蛋白Zeta 电位不同字母代表差异显著(P<0.05),图3 和图6 同。Fig.1 Zeta potential of myofibrillar proteins of L.crocea treated at different pH valuesLowercase letters indicate significant differences between different samples,P<0.05,the same as Fig.3 and Fig.6.
pH 对MP 的SDS-PAGE 影响 不同pH处理大黄鱼MP 后SDS-PAGE 电泳结果显示,经不同pH 处理后,MP 发生不同程度的降解(图2)。从上到下依次为副肌球蛋白、肌动蛋白、原肌球蛋白和肌球蛋白轻链,该结果与Wang 等[26]的研究基本一致。在等电点右侧,pH 增加,凝胶顶部多聚体逐渐加深,碱性条件下MP 更易聚集,且200 ku 处无明显条带。

图2 pH 处理大黄鱼肌原纤维蛋白SDS-PAGE 电泳图M.蛋白质标准物质200;Ⅰ~Ⅳ分别代表副肌球蛋白、肌动蛋白、原肌球蛋白和肌球蛋白轻链。Fig.2 SDS-PAGE of myofibrillar proteins of L.crocea treated at different pH valuesM.Marker 200;Ⅰ-Ⅳ represent paramyosin,actin,tropomyosin and troponin,respectively.
pH 对MP 接触角的影响 在pH 2~8 下,接触角均小于90°且变化不明显,表现为亲水性。随pH 继续增加,MP 接触角增大,接触角在pH 10 和pH 12 时均大于90°,MP 表现为明显的疏水性(图3)。
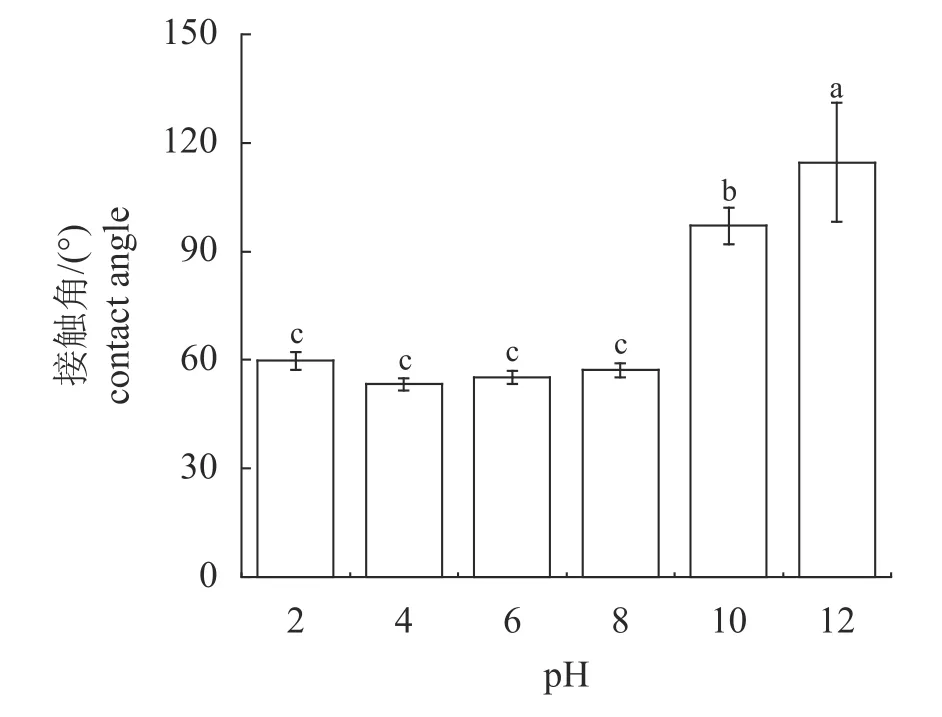
图3 pH 对MP 接触角的影响Fig.3 Effect of pH on contact angle of myofibrillar proteins
pH 对MP 内源荧光性的影响 进一步通过荧光光谱分析不同pH 处理MP 后内源荧光的变化,在等电点左侧,pH 越接近等电点,荧光强度越低,发射波长红移(从331 到340 nm)。在等电点右侧,随着pH 增加,荧光强度逐渐增加,发射波长先蓝移后红移(从337 到332 nm,再到337 nm) (图4)。
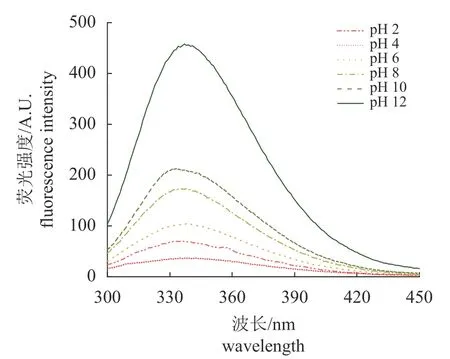
图4 pH 对MP 内源荧光强度的影响Fig.4 Effect of pH on endogenous fluorescence intensity of myofibrillar proteins
2.2 pH 对大黄鱼MP 乳化特性的影响
pH 对MP 乳液微观形貌的影响 不同pH 处理大黄鱼MP 后新鲜乳液微观形貌的结果显示,在等电点左侧乳滴较大且不均匀。而在等电点右侧,pH 6~10 时,乳滴粒径逐渐减小且大小趋于均匀,pH 12 时乳滴较小,彼此间出现明显的絮凝(图5)。

图5 pH 处理大黄鱼肌原纤维蛋白乳液的显微观察(40×)(a)~(f)分别为在pH 2、4、6、8、10 和12 下MP 制备的乳液。Fig.5 Microscopic observation of myofibrillar protein emulsions of L.crocea treated at different pH values(a)-(f) represent emulsions prepared by MP at pH 2,4,6,8,10 and 12,respectively.
pH 对MP 乳液Zeta 电位的影响 不同pH 处理大黄鱼MP 制备的乳液Zeta 电位,在等电点左侧乳液带正电,接近等电点时,乳液电位绝对值降低;在等电点右侧乳液带负电,随着pH增加,乳液电位绝对值呈先上升后下降趋势(图6)。该结果与MP 的Zeta 电位(图1)相一致。
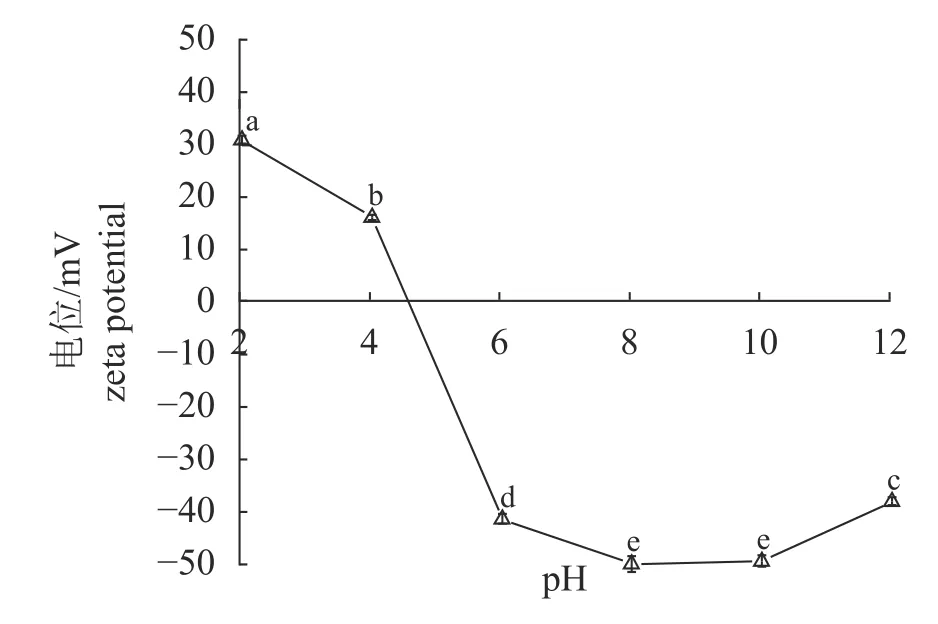
图6 pH 对MP 乳液的Zeta 电位的影响Fig.6 Effect of pH on Zeta potential of myofibrillar protein emulsions
pH 对MP 乳液稳定性的影响 不同pH处理对大黄鱼MP 乳液稳定性的结果显示,乳液在静置10 d 后,乳析指数基本稳定(图7)。在等电点左侧,乳析指数较大,乳液稳定性较差。在等电点右侧,随pH 值(6~12)增加,乳析指数先减后增,乳液稳定性在pH 8 下稳定性较好。在pH 12 时,MP 可能过度交联聚集,导致乳液稳定性下降,13 d 后出现破乳(图7)。
3 讨论
3.1 pH 处理对大黄鱼MP 结构性质的影响
pH 对 MP 电位的影响 Zeta 电位是指胶体分散体电动势,绝对值越大意味着静电斥力越大,与溶解度有关[27]。在等电点附近,MP 表面带电荷较少,静电相互作用最小,可能是由于范德华力和氢键促进蛋白凝聚导致溶解度下降[28]。在等电点右侧,随pH 增加,MP 表面携带负电荷越多,Zeta 电位绝对值越大。而在pH 12 时Zeta 电位绝对值略微降低,可能是由于MP 发生变性使表面暴露电荷减少。
pH 对MP SDS-PAGE 的影响 SDSPAGE 电泳能直观地呈现鱼肉MP 的降解和变性情况[29]。碱处理导致蛋白质变性聚合形成大分子质量聚集体[30]。在等电点左侧,凝胶顶部无聚集物,200 ku 处肌球蛋白重链条带消失,小分子质量蛋白条带加深,可能是由于肌球蛋白重链发生了降解。pH 4 下MP 电泳条带颜色较浅可归因于接近等电点使其蛋白浓度降低所致。与先前报道相符,与酸性条件相比,肌动蛋白在碱性条件下蛋白条带有加深趋势[31]。
pH 对 MP 接触角的影响 三相接触角(θ)可用于标识MP 的亲疏水性,一定程度反映MP在油水界面的分布、乳液的类型和稳定性[32]。天然蛋白质分子中,亲水基团一般暴露在外部并且可与水相互作用,疏水基团则位于蛋白分子内部[33]。碱处理后,肌原纤维蛋白构象变化,可能由于疏水基团暴露在外部导致疏水性增加。
pH 对 MP 内源荧光性的影响 蛋白质的内源荧光性主要来源于色氨酸,色氨酸对微环境的改变极其敏感[34]。最大发射波长小于330 nm,表明色氨酸基团位于蛋白分子内部非极性环境中;最大发射波长大于330 nm,表明色氨酸位于蛋白分子外部极性环境中[22]。在等电点左侧,接近等电点,蛋白发生聚集,色氨酸包埋在蛋白分子内部;在等电点右侧,随pH 增加,蛋白质分子排列顺序发生变化,三级结构展开,色氨酸向外部极性环境逐渐暴露,导致内源荧光强度增加[35]。该结果表明,MP 内部空间结构发生变化,内部疏水氨基酸暴露在蛋白表面,这与接触角的结果相一致(图3)。
3.2 pH 对大黄鱼MP 乳化特性的影响
pH 对MP 乳液微观形貌的影响 显微镜常用于观察乳滴,直观反映乳滴的颗粒大小和分散情况。Liu 等[36]研究新鲜乳液经1% SDS 溶液处理后的粒径分布,结果表明1% SDS 可以使油滴在乳液中保持分离,乳滴大小可以反映蛋白质的乳化能力,乳滴粒径越小,乳化能力越强。由此可以判断,在等电点左侧MP 的乳化能力较差;在等电点右侧,pH 4~8 时MP 的乳化能力逐渐增强,随着pH 值继续增加,乳滴粒径继续减小,同时聚集程度不断加深,在pH 12 稳定的乳液中出现明显聚集。
pH 对MP 乳液Zeta 电位的影响 乳液液滴表面带电量可在一定程度上反映乳滴的稳定性[37]。电位的绝对值越大,油滴间的静电斥力越大,阻止乳滴间发生聚集,从而有利于乳液的稳定性[38]。乳滴粒径减小导致表面积更大,分散粒子表面显示更多电荷,从而导致乳液Zeta 电位绝对值增加[39]。在pH 8 时,乳液的Zeta 电位绝对值达到最大值[(49.63±1.52) mV]。在pH 12 时,乳滴发生聚集,可能是由于MP 颗粒通过静电相互作用所致。
pH 对MP 乳液稳定性的影响 从宏观角度,通常利用乳析指数表征乳液的稳定性变化,乳析指数越小乳液越稳定[38]。Kurt[40]研究pH 对乳液稳定性的影响,结果表明pH 值远离等电点时净电荷增加,促使乳液稳定性增加。大黄鱼MP乳液Zeta 电位远离蛋白等电点,乳滴表面MP 彼此间的静电排斥有利于乳液的稳定性。通过不同pH 下乳液在不同贮藏时间的外观观察,观察到乳液的乳化程度和破乳现象,与以上乳液特性分析相一致。
综上所述,从大黄鱼MP 的开发利用出发,本研究在不同pH (2~12)条件下处理大黄鱼MP,对其结构性质和乳化稳定性进行分析。在pH 12 时,MP 发生聚集,导致绝对值略微降低。碱性条件下MP 更易聚集,其内部空间结构发生变化,疏水氨基酸暴露在蛋白表面,疏水性增加。本研究表明,在pH 8 下乳液稳定性较好,而在pH 12 下乳液贮藏13 d 后蛋白变性聚集,导致乳液失稳出现破乳。利用pH 处理可以达到改善大黄鱼MP 加工特性的目的,为今后其在食品工业中的加工应用提供指导依据。
(作者声明本文无实际或潜在的利益冲突)

