胍基乙酸对斑点叉尾鮰生长、肝脏抗氧化和肌肉能量代谢的影响
于海罗,肖调义,骆艺文,王红权,任 为,叶利海,章燕铃
(1.湖南农业大学,湖南省特色水产资源利用工程技术研究中心,湖南 长沙 410128;2.武汉正大水产有限公司,湖北 武汉 430070)
肌酸在机体能量代谢中发挥重要作用,其磷酸肌酸形式可提供高能磷酸键供二磷酸腺苷(ADP)生成三磷酸腺苷(ATP),维持ATP 动态平衡。肌酸可在机体内自行合成,也可外源添加,但肌酸在饲料添加过程中存在不稳定性。甘氨酸与L-精氨酸在精氨酸-甘氨酸脒基转移酶(AGAT)作用下生成胍基乙酸(GAA)和鸟氨酸。GAA 是肌酸的合成前体物质,GAA 在胍基乙酸脒基转移酶(GAMT)作用下生成肌酸[1]。GAA 性质稳定,因此常用GAA 作为肌酸的补充源[2]。饲料中添加GAA 在畜禽上应用广泛,大量研究表明GAA 可以提高动物的生长性能[3-5],改善肌肉品质和提高抗氧化能力[6-7]。目前GAA 在水产方面的研究报道相对较少,集中在眼斑拟石首鱼(Sciaenops ocellatus)、美洲牛蛙(Lithobates catesbeianus)、草鱼(Ctenopharygodon idella)和尼罗罗非鱼(Oreochromis niloticus)[8-12]等种类,未见有关于GAA 对斑点叉尾鮰 (Ictalurus punctatus)生长、抗氧化能力及能量代谢影响的报道。
斑点叉尾鮰属鲇形目(Siluriformes) 鮰科(Ictaluridae),原产于北美洲大陆,分布范围从加拿大南部到墨西哥北部,1984 年由湖北省水产科学研究所引进至中国[13]。据2021 中国渔业统计年鉴数据显示,斑点叉尾鮰2020 年养殖产量约30.85 万t,加工量约为4.65 万t,斑点叉尾鮰已逐渐成为消费者喜爱的经济鱼类。但近年来消费者对鱼肉品质要求在不断提高,而不同养殖模式[14]、饲料料型[15]以及暂养环境[16]等都会对斑点叉尾鮰肌肉品质产生影响,因此改善斑点叉尾鮰肌肉品质尤为重要。因此,本实验将验证GAA 对斑点叉尾鮰的生长性能、肌肉品质、抗氧化能力和能量代谢的影响,以期为GAA 在水产上应用提供更多参考依据。
1 材料与方法
1.1 饲料配方与制作
实验饲料以国产鱼粉、猪肉粉、豆粕和菜粕为蛋白源,豆油和鱼油为脂肪源,面粉为糖源(原料均由武汉正大水产有限公司提供)。在基础饲料中添加0、300、600 和900 mg/kg GAA(有效含量≥95%,湖北景瑞天恒生物科技有限公司),配制成4 种等能等氮的实验饲料,基础饲料组成及营养成分见表1。实验饲料在武汉正大水产有限公司研发中心实验室制作,所有原料粉碎后经60 目分级筛,按配比混匀,少量组分逐级扩大法混合,经熟化和烘干制成直径1.8 mm 的实验饲料,置于4℃冰箱保存备用。
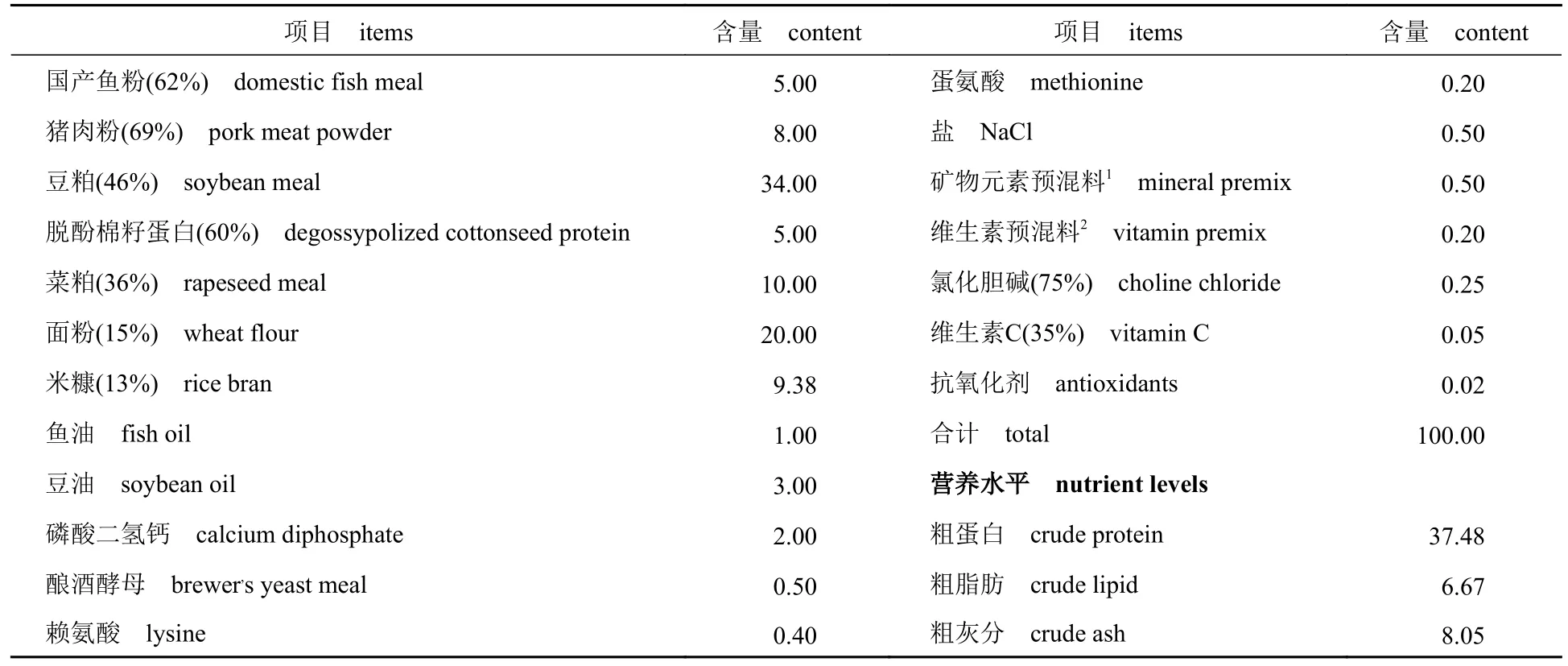
表1 基础饲料配方及常规成分(干物质)Tab.1 Formulation and proximate composition of the basal diet (air-dry basis) %
1.2 实验管理
实验斑点叉尾鮰由武汉正大水产有限公司提供,养殖地点为武汉正大水产有限公司实验车间。将实验斑点叉尾鮰置于网箱(2 m×2 m×1.6 m)中暂养2 周,暂养期间使用武汉正大水产有限公司专用斑点叉尾鮰料,每天分别在6: 30 和18: 00 饱食投喂进行驯食。驯食完成后禁食24 h,挑选健康斑点叉尾鮰至体积为1 000 L 的实验桶中,24 h 后开始投喂实验料。实验共设4 个处理组,每组5个重复,每个重复30 尾斑点叉尾鮰。养殖期间每天分别在6: 30 和18: 00饱食投喂;采用连续流水养殖,水源经沙滤、曝气和消毒,连续增氧保持溶解氧7.0 mg/L 以上;pH7.5~8.2,水温25~30℃;水质氨氮低于0.02 mg/L,亚硝酸盐低于0.01 mg/L。光照为自然光源,养殖周期为8 周。本研究获得了湖南农业大学实验动物管理和使用伦理委员会批准,过程中操作人员严格遵守湖南农业大学伦理规范,并按照湖南农业大学伦理委员会制定的规章制度执行。
1.3 样品制备与分析
生长性能与饲料利用 养殖结束时将斑点叉尾鮰饥饿24 h,对所有斑点叉尾鮰称重并计数,计算增重率、成活率和饲料系数;每桶随机取14尾吸干体表水分测量体重和体长,计算肥满度;其中10 尾解剖取内脏和肌肉,分别计重后将肝脏和肌肉保存于-80℃备用;剩余4 尾用于分析体常规营养成分。
全鱼和饲料常规营养成分测定 采用乙醚抽提法(GB/T 6433—1994)测定全鱼的粗脂肪,采用凯氏定氮法(GB/T 6432—1994)测定粗蛋白,采用马弗炉550 °C 灼烧法(GB/T 6438—1992)测定粗灰分,采用105℃烘干恒重法测定水分含量。
组织的酶活性和肌糖原含量测定 肝脏或肌肉酶活性指标和肌糖原含量测定,均使用南京建成生物工程研究所试剂盒测定。测定方法:肝脏总抗氧化能力(T-AOC,ABTS 法)、谷胱甘肽过氧化物酶(GSH-Px,比色法)、丙二醛(MDA)TBA 法)、超氧化物歧化酶(SOD,羟胺法)、过氧化氢酶(CAT,比色法)、丙酮酸激酶(PK,紫外比色法)、琥珀酸脱氢酶(SDH,比色法)、肌酸激酶(CK,比色法)、羟脯氨酸(HYP,碱水解法)、肌糖原(比色法),具体操作步骤参照说明书进行。
肌肉氨基酸和脂肪酸测定 取肌肉样品2.5 g,用盐酸匀浆、超声浸提等方法,使用氨基酸分析仪(L8900 日立)测定肌肉氨基酸组成。取肌肉样品0.5 g 置于50 mL 离心管中,加入苯-石油醚混合溶剂密闭浸提,用气相色谱质谱联用仪(安捷伦7890A/5975C)测定脂肪酸组成。
1.4 计算公式
各个指标计算公式:
式中,W0为体重(g),W1为初始体重(g),W2为终末体重(g),Ct为每桶累计耗用饲料总重(g),Lb为体长(cm),Lw为肝脏重量(g),Cw为内脏重量(g),Wf为腹部脂肪重量(g),t为养殖周期(d)。
1.5 数据分析
数据用IBM SPSS 22.0 软件进行单因素方差分析(One-Way ANOVA),用Tukey 多重比较组间均值差异,P<0.05 表示差异显著;数据以平均值±标准误(mean±SE)表示。
2 结果
2.1 饲料中GAA 水平对斑点叉尾鮰生长及饲料利用的影响
添加GAA 可显著影响斑点叉尾鮰的形体指标,与对照组相比,VSI 和IPF 在GAA300 组有下降趋势(P>0.05),随着GAA 添加量的增加而升高,与GAA300 组相比,GAA900 组斑点叉尾鮰VSI 和IPF 显著升高(P<0.05)(表2)。饲料中添加GAA 对FBW、WGR、SGR、FCR、HSI、CF和SR 无显著影响(P>0.05),FBW 和WGR 在GAA300 组最高(表2)。以IPF 为指标通过二次函数分析,获得最适IPF 的GAA 添加量为275 mg/kg(图1);以VSI 为指标通过二次函数分析,获得最适VSI 的GAA 添加量为150 mg/kg(图2)。

图1 饲料中GAA 水平对斑点叉尾鮰腹脂率的影响Fig.1 Effect of different dietary GAA supplementation on IPF of I.punctatus

图2 饲料中GAA 水平对斑点叉尾鮰脏体比的影响Fig.2 Effect of different dietary GAA supplementations on VSI of I.punctatus
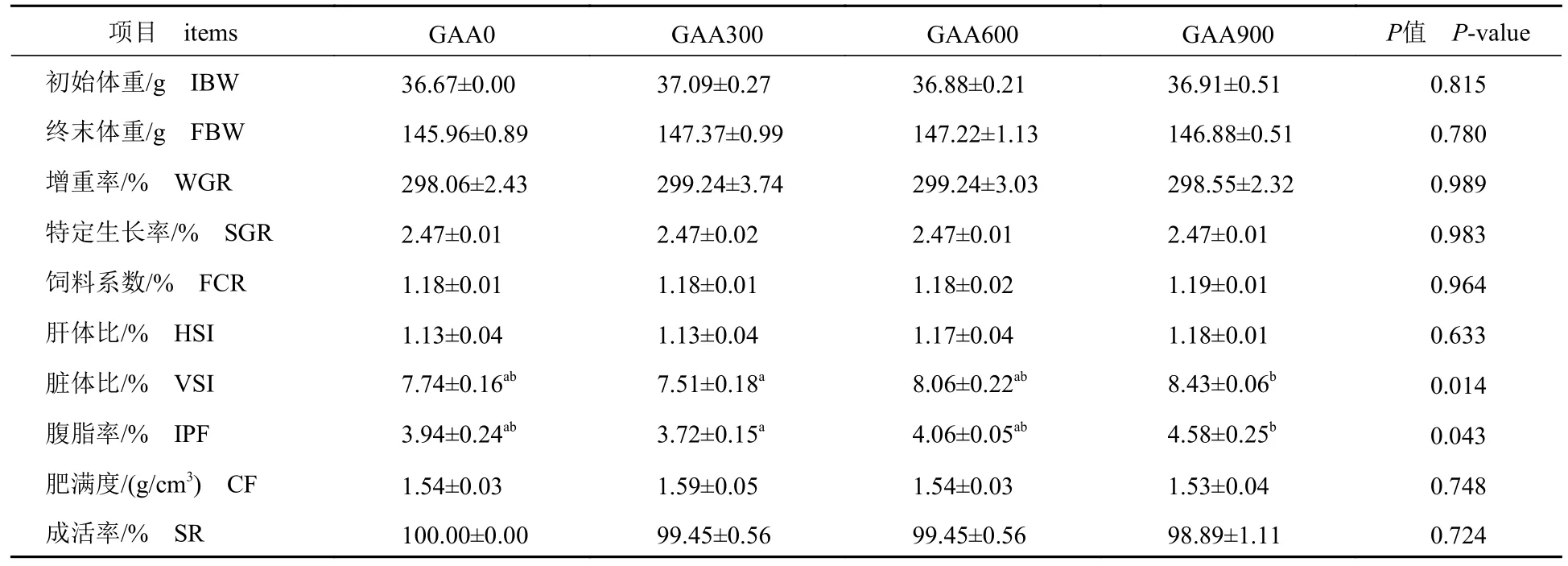
表2 饲料中GAA 水平对斑点叉尾鮰生长和饲料利用的影响Tab.2 Effect of different dietary GAA supplementation on growth performance and feed utilization of I.punctatus
2.2 饲料中GAA 水平对斑点叉尾鮰肌肉品质的影响
添加GAA 对斑点叉尾鮰全鱼水分、粗蛋白、粗脂肪和粗灰分含量均无显著影响(P>0.05)(表3)。肌糖原含量随着GAA 添加水平的增加有升高趋势(P>0.05);各添加组羟脯氨酸(HYP)含量显著高于对照组(P<0.05)(表4)。饲料GAA 水平对斑点叉尾鮰肌肉中游离氨基酸(表5)和脂肪酸(表6)含量均无显著影响(P>0.05)。
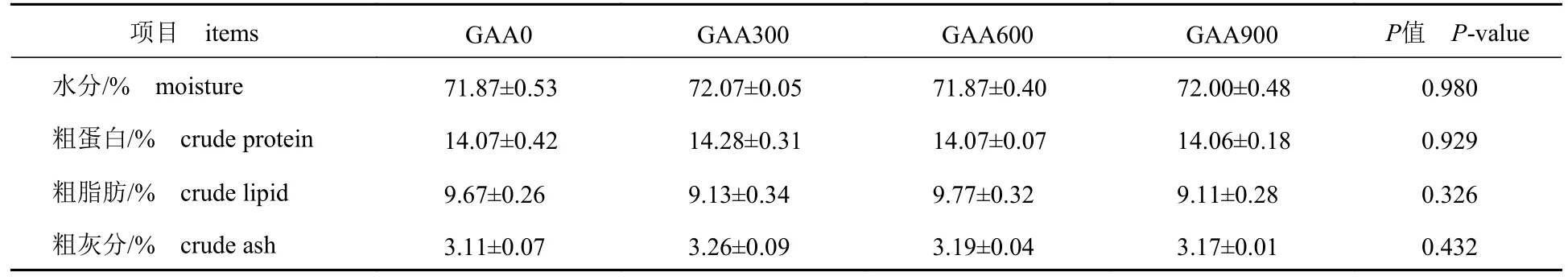
表3 饲料中GAA 水平对斑点叉尾鮰体成分的影响Tab.3 Effect of different dietary GAA supplementation on body nutritional composition of I.punctatus

表4 饲料中GAA 水平对斑点叉尾鮰肌肉糖原和羟脯氨酸含量的影响Tab.4 Effect of different dietary GAA supplementation on glycogen and hydroxyproline in muscle of I.punctatus

表5 饲料中GAA 水平对斑点叉尾鮰肌肉氨基酸组成的影响Tab.5 Effect of different dietary GAA supplementation on free amino acid composition in muscle of I.punctatus (dry matter) μg/g
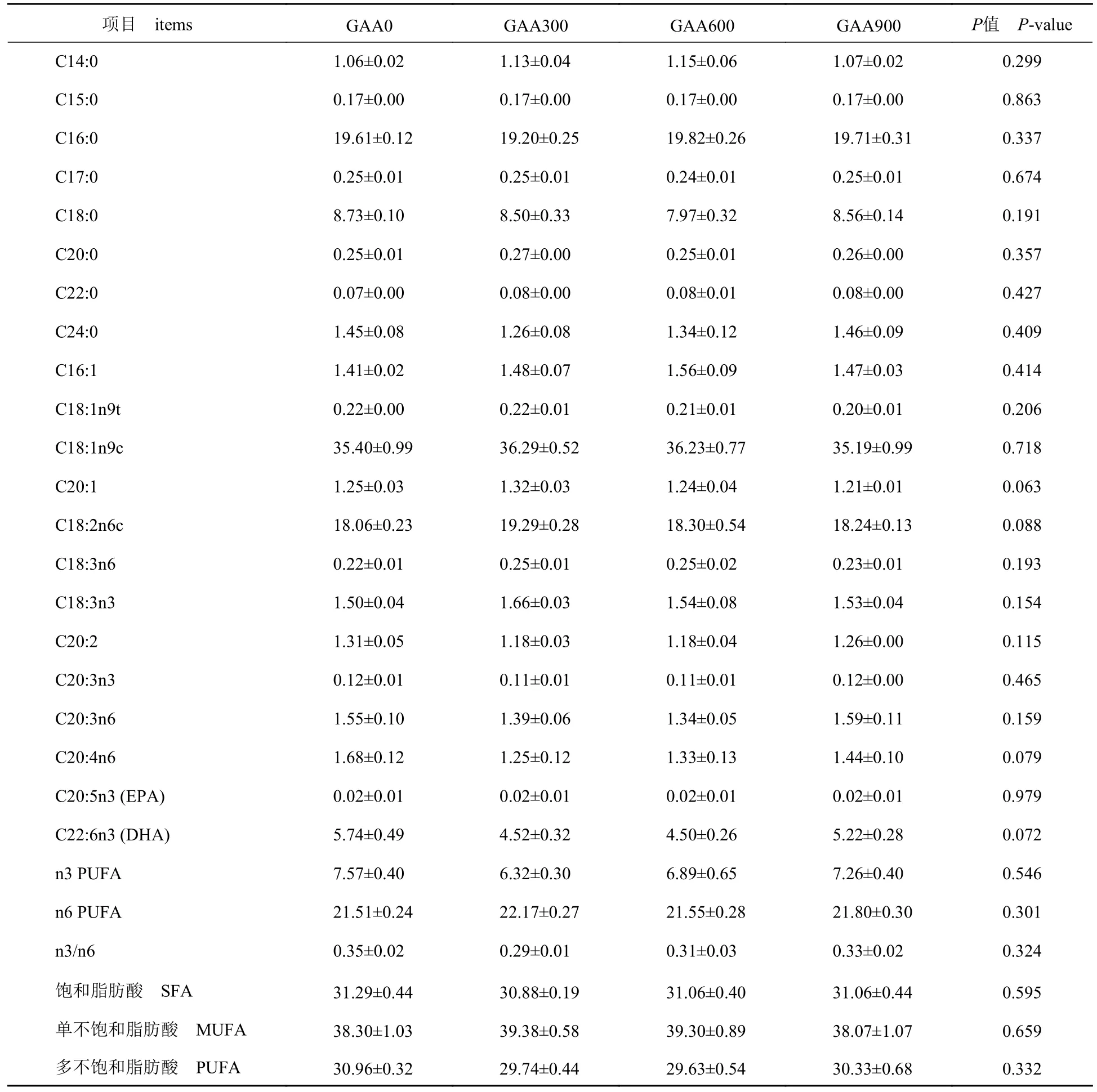
表6 饲料中GAA 水平对斑点叉尾鮰肌肉脂肪酸含量的影响Tab.6 Effect of different dietary GAA supplementation on the fatty acid (FA) of total FA in muscle of I.punctatus %
2.3 饲料中GAA 水平对斑点叉尾鮰肝脏抗氧化指标的影响
添加GAA 显著影响斑点叉尾鮰肝脏T-AOC、MDA 和SOD 抗氧化指标(P<0.05)。GAA300 组T-AOC 显著高于其他组(P<0.05),其他组间无显著差异(P>0.05);与对照组相比,MDA 含量在GAA600 组显著升高,在GAA900 组达到最大(P<0.05);与对照组相比,GAA300 组和GAA600 组的SOD 活性显著升高(P<0.05),GAA900 组SOD 活性有升高趋势(P>0.05);各组间的GSHPx 和CAT 活性无显著差异(P>0.05),GSH-Px 活性在GAA300 组最高(表7)。
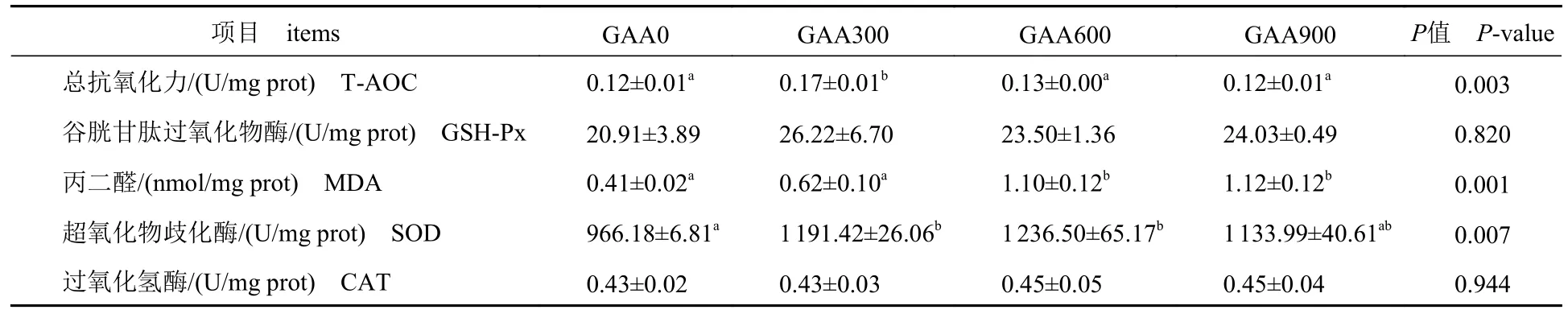
表7 饲料中GAA 水平对斑点叉尾鮰肝脏抗氧化指标的影响Tab.7 Effect of different dietary GAA supplementation on hepatic antioxidant indices of I.punctatus
2.4 饲料中GAA 水平对斑点叉尾鮰肌肉能量代谢酶酶活的影响
随着GAA 添加水平增加,肌肉CK 酶活性呈先上升后下降的趋势,但各组间无显著差异(P>0.05);与对照组相比,肌肉中SDH 酶活性在GAA300 组显著升高(P<0.05);肌肉PK 酶活性随GAA 添加水平的增加先上升后下降,其中GAA300 组和GAA600 组的PK 酶活性显著高于对照组(P<0.05)(表8)。

表8 饲料中GAA 水平对斑点叉尾鮰肌肉能量代谢酶的影响Tab.8 Effect of different dietary GAA supplementation on the activities of muscle energy enzymes of I.punctatus
3 讨论
3.1 饲料中GAA 水平对斑点叉尾鮰生长性能的影响
研究表明,适宜的精氨酸可促进生长[17]。GAA 由甘氨酸和L-精氨酸合成,添加外源性GAA 可作为精氨酸的有效替代物,促进精氨酸用于蛋白质合成代谢、信号传导和激素释放等;同时可直接提高磷酸肌酸ATP 值,提供更多ATP促进肌纤维发育,改善动物的生长性能[18]。但在本研究中添加GAA 对斑点叉尾鮰生长并无显著的促进作用,这与已有研究结果一致。洑琴等[19]在饲料中添加250、500 和1 000 mg/kg GAA 对建鲤(Cyprinus carpiovar.jian) FBW、SGR 和WGR均无改善作用。Stites 等[8]在眼斑拟石首鱼饲料中添加GAA(0、5 和10 g/kg)和肌酸(0 和20 g/kg)发现,添加GAA 对FBW 和WGR 无促进作用;但Lin 等[9]研究发现,添加0.4 g/kg GAA 可显著提高美洲牛蛙生长性能,造成这些结果差异可能的原因是不同的养殖动物对精氨酸的需求量不同。有研究表明精氨酸可调节脂肪组织和肌肉组织之间的脂质分布[20]。本研究中,随着GAA 添加水平增加,斑点叉尾鮰IPF 呈现先下降后上升趋势,在添加300 mg/kg 组最低。以IPF 为指标通过二次函数分析,获得最适IPF 的GAA 添加量为275 mg/kg,说明添加适量的GAA 可有效减少腹腔脂肪蓄积,间接调节脂质分布。
3.2 饲料中GAA 水平对斑点叉尾鮰肌肉品质的影响
胶原蛋白是反映肌肉品质的重要指标,胶原蛋白及其交联结构与肌肉硬度和质地有关,鱼类研究表明肌肉中胶原蛋白含量与硬度成正比[21]。李乃顺等[22]研究绿原酸对草鱼(Ctenopharyngodon idella)生长及肉质的影响中也指出,当添加量为0.02%时可显著提高肌肉中胶原蛋白的含量,从而改善肌肉品质。羟脯氨酸是胶原蛋白特有的氨基酸,补充适量羟脯氨酸可帮助体内胶原蛋白的重建。刘云正[23]研究发现,高植物蛋白替代鱼粉后添加羟脯氨酸对大菱鲆(Scophthalmus maximus)幼鱼生长的影响,表明添加40 I 和50 I 羟脯氨酸可以显著提高肌肉羟脯氨酸和胶原蛋白含量。本研究中,添加300~900 mg/kg GAA 可显著提高肌肉羟脯氨酸含量,从而提高肌肉中胶原蛋白含量,改善肌肉品质。动物肌肉停止供氧后,通过无氧酵解产生乳酸导致pH 降低,进而影响肉色、系水力等[1]。添加GAA可直接提高磷酸肌酸ATP 值,降低肌糖原作为能源物质的分解,缓解肌肉无氧酵解和降低乳酸含量,从而改善肌肉品质,所以肌糖原含量也可作为肌肉品质评价指标。本实验中添加GAA 后,肌肉中肌糖原含量均有提高,有助于提升斑点叉尾鮰肌肉品质。Yang 等[10]在植物蛋白饲料中添加0、150、300、450 和600 mg/kg GAA,通过60 d 养殖发现,添加300 mg/kg 组可显著提高肌肉中EPA 和DHA 含量,并对游离氨基酸中必需氨基酸和氨基酸总量产生显著影响。本实验中,添加GAA 对肌肉游离氨基酸和脂肪酸均无影响,可能是与养殖品种和养殖周期相关,具体原因还需进一步研究。
3.3 饲料中GAA 水平对斑点叉尾鮰肝脏抗氧化指标的影响
动物机体抗氧化酶系包括SOD、GSH-Px、CAT 等,T-AOC 是反映机体总抗氧化机能的指标。SOD 能够清除细胞中多余的自由基(),抵抗过氧化物攻击而保护细胞;GSH-Px 催化过氧化氢分解,降低过氧化物的含量,保护细胞膜结构和功能完整性,使机体不受氧化损害;CAT 将过氧化氢催化分解成水,解除自由基氧化造成的损害[24]。耿凯等[25]在育肥猪饲料中添加0.5% GAA 中药制剂发现,添加0.5% GAA 中药制剂可显著提高肝脏T-AOC、SOD 和GSH-Px 含量,提高育肥猪的抗氧化能力。王子苑等[26]在肉牛基础饲料中分别添加400 和800 mg/kg GAA,结果表明,添加400 mg/kgGAA 可显著提高肝脏T-AOC 和内源性抗氧化酶SOD、GSH-Px 酶活性,提高机体抗氧化能力。Zeng 等[27]发现,植物蛋白饲料中分别添加0.2、0.4、0.6 和0.8 g/kg GAA 对美国牛蛙(Rana catesbeiana)生长及抗氧化性能的影响,表明0.4~0.6 g/kg 组血清T-AOC 显著高于对照组,CAT 与添加量呈正相关,在0.8 g/kg 添加量时达到最大值。本研究中,添加300 mg/kg GAA 可显著提高斑点叉尾鮰肝脏T-AOC 和SOD 水平,分析可能是斑点叉尾鮰摄入适量GAA 有助于提高肌酸和磷酸肌酸含量,肌酸具有直接抗氧化作用,磷酸肌酸可抑制氧化应激反应增强抗氧化酶系统[24];当GAA 添加量为600~900 mg/kg 时,斑点叉尾鮰肝脏抗氧化能力反而降低,可能是添加过量导致GAA 代谢紊乱或化合物大量积累,GAA 表现为强氧化剂,并诱导氧化应激[28],从本实验MDA 变化推测高剂量GAA 可导致斑点叉尾鮰呈氧化应激状态。
3.4 饲料中GAA 水平对斑点叉尾鮰能量代谢关键酶的影响
CK 将磷酸肌酸上磷酸基团转移到ADP 后合成ATP,因此肌酸激酶在能量代谢中起重要作用[1];SDH 参与三羧酸循环,间接反映线粒体功能和组织供氧情况[18]。Azizaa 等[12]在尼罗罗非鱼饲料中添加0.12%和0.18% GAA 均能显著提高CK 活性;Lin 等[9]也证实添加0.4 和4 g/kg GAA 可显著提高CK 活性。本实验中添加300~900 mg/kg GAA较对照组CK 活性和肌糖原含量均有提高趋势,说明添加GAA 可能有助于减少糖类物质分解,更多以糖原形式储能。PK 是糖酵解限速酶之一,将磷酸烯醇式丙酮酸催化成丙酮酸并伴随有ATP 生成,可反映糖酵解水平。本实验研究表明添加300 mg/kg GAA 显著提高PK 活性,与前述部分研究证实GAA 可提高肌糖原含量的结果相对应,说明添加GAA 可促进糖酵解和能量代谢。这与李洁蕾等[29]研究结果一致;而王子苑等[26]在肉牛饲料中添加400 mg/kg GAA 和洑琴等[19]在建鲤饲料中添加250~1 000 mg/kg GAA 均显著降低了PK 活性,推测可能是与养殖动物种类相关。
4 结论
本实验条件下,斑点叉尾鮰饲料中添加适量的GAA(150~300 mg/kg)能降低腹部脂肪和脏体比,提高肝脏抗氧化能力和肌肉能量代谢。
(作者声明本文无实际或潜在的利益冲突)

