异体移植炎症因子1 对草鱼白细胞活力及炎性因子释放的影响
王祎琳,伍迎欢,赵燕英
(西南民族大学畜牧兽医学院,青藏高原动物保护与利用教育部重点实验室,青藏高原动物保护与利用四川省重点实验室,四川 成都 610041)
异体移植炎症因子1(allograft inflammatory factor-1,AIF-1)是一种分子量约为17 ku 的钙结合蛋白,其主要由单核细胞、巨噬细胞和淋巴细胞分泌[1]。异体移植炎症因子1 基因首先从大鼠(Rattus norvegicus)心脏移植排斥物中克隆[2]。此外,其他研究小组纯化或鉴定的daintain[3]、离子化钙联调节因子[4]和小胶质细胞应答因子1[5]都可能是异体移植炎症因子1 的类似物,但其功能的一致性尚待验证。在人(Homo sapiens)中,异体移植炎症因子1 的基因定位于人类白细胞抗原Ⅲ区域[4],提示其与免疫调节相关。较多研究显示,异体移植炎症因子1 与器官移植排斥[6]、炎性血管病变[7]、自身性免疫疾病[8]、癌症[9]等炎性疾病相关。目前已鉴定了多种生物的异体移植炎症因子1 序列,序列比对显示其高度同源[1],预示着其功能的相似性。
在水生生物中,已有报道称鳗弧菌(Vibrio anguillarum) 的诱导使菲律宾蛤仔(Ruditapes phil-ippinarum)血细胞中异体移植炎症因子1 的表达水平在72 h 后达到峰值[10]。溶藻弧菌(V.alginolyticus)、副溶血性弧菌(V.parahemolyticus)、李斯特菌(Listeria monocytogenes)、出血性败血症病毒(viral hemorrhagic septicemia virus)刺激了鲍(Haliotis)血细胞异体移植炎症因子1 的表达[11]。类立克次体(Rickettsia-lick organism)/脂多糖(lipopolysaccharide,LPS) 激发了近江牡蛎(Crassostrea ariakensis)血细胞中异体移植炎症因子1 的表达[12],此外,革兰氏阳性细菌/脂多糖也激发了海胆(Echinoidea)体腔细胞异体移植炎症因子1 的表达[13-14]。上述研究表明,病原微生物可激活水生生物异体移植炎症因子1 在免疫细胞尤其是血细胞中的表达,提示异体移植炎症因子1 参与了水生生物的天然免疫,但其具体免疫调节机制尚不清楚。
草鱼(Ctenopharyngodon idella)是我国重要的淡水经济鱼类,但同时草鱼病害较多。笔者前期克隆了草鱼异体移植炎症因子1 基因序列[15],本实验拟进一步探讨异体移植炎症因子1 对草鱼血液白细胞活力和炎性因子释放的影响。
1 材料与方法
1.1 主要材料与仪器
草鱼(300~500 g)购自成都市水产市场。动物实验和福利经西南民族大学动物伦理委员会批准。鱼(淡水)全血淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司;RPMI-1 640 培养基购自Hyclone 公司;胎牛血清购自 Gibco 公司;青链霉素双抗(双抗)、BCA 蛋白分析试剂盒、红细胞裂解液、CCK8 试剂盒、活性氧检测试剂盒及线粒体膜电位检测试剂盒购自Bioswamp 公司;AnnexinV-FITC/PI 细胞凋亡检测试剂盒购自碧云天生物技术;ATP 含量检测、一氧化氮检测试剂盒购自南京建成生物工程研究所;脂多糖、牛血清白蛋白购自Sigma 公司;超滤管购自Millipore公司,淡水鱼肿瘤坏死因子α (No.JYM0045Fs)、白细胞介素1β (No.JYM0047Fs)和白细胞介素6(No.JYM0091Fs) ELISA 检测试剂盒购自武汉基因美生物科技有限公司。
超净工作台购自苏州智净净化设备有限公司;酶标仪购置芬兰雷勃诊断有限公司;全自动化学发光分析仪购自上海天能科技有限公司;流式细胞仪购自Beckman 公司。
1.2 实验方法
草鱼白细胞准备 从市场购买体重(300±50) g 的草鱼,在(28.0 ± 0.5) °C 水循环系统中养殖1 周。养殖条件:5~10 mg/L 溶解氧,每天喂养3 次5%体重的鱼饲料,12 h 光暗交替。1周后,从草鱼尾静脉取血,按1∶1 (体积比)与样本稀释液混匀,加入等体积淋巴细胞分离液后,在外周血单核细胞离心管中离心。离心后取环状乳白色细胞层,用清洗液重悬细胞 3 次。加入红细胞裂解液,裂解红细胞至溶液透亮,磷酸盐缓冲液(PBS)洗涤细胞,终止裂解。离心后将白细胞转入含10% 胎牛血清的RPMI-1 640 培养基中。
蛋白质免疫印迹(Western blot) 在1×106个/mL 草鱼白细胞的培养基中加入100 ng/mL 脂多糖。48 h 后收集细胞外液并浓缩,通过Western blot 检测异体移植炎症因子1 的分泌水平。BCA 蛋白分析试剂盒定量总蛋白质浓度后,聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转膜。5%牛血清白蛋白封闭。接着将膜与草鱼异体移植炎症因子1 抗体[15](1∶1 000)在4 °C 孵育过夜,并用TBST(含有20 mmol/L Tris-HCl,pH 7.6,0.14 mol/L NaCl,0.1% Tween 20) 彻底清洗,二抗孵育后化学发光法检测免疫复合物。
细胞活力 使用CCK-8 试剂盒检测草鱼外周血白细胞活力。将1×105个/mL 草鱼白细胞接种至96 孔细胞培养板中,随机分为4 组,每组设置3 个重复。每组分别加入终浓度为0、0.1、1.0、10.0 nmol/L 的草鱼异体移植炎症因子1 重组蛋白[15]处理48 h 后,每孔加入10 μL 的CCK-8 溶液4,37 °C 孵育2 h,用酶标仪测定450 nm 处的光吸收值。
线粒体膜电位、ATP 含量 利用JC-1 荧光探针评估线粒体膜电位,流式细胞仪检测JC-1的单体和多聚体信号[16]。计算JC-1 多聚体和单体的比例用于衡量线粒体膜电位的高低。此外,裂解细胞,去除蛋白质,以ATP 为标准,利用ATP 检测试剂盒测定胞内ATP 的含量。
细胞凋亡、一氧化氮检测 按1×106细胞/孔浓度将草鱼白细胞接种至6 孔细胞培养板,加入上述浓度异体移植炎症因子1 处理48 h 后,收集细胞,重悬于结合缓冲溶液中,195 μL,2×105个/mL 细胞与5 μL Annexin V-FITC 室温避光孵育30 min。PBS 洗涤后,用PI 进行双染。流式细胞仪检测不同凋亡阶段的细胞比例。同时,活性氧、一氧化氮检测试剂盒分析细胞中活性氧和一氧化氮的水平。
肿瘤坏死因子α、白细胞介素1β 和白细胞介素6 含量测定 异体移植炎症因子1 处理草鱼白细胞48 h 后,分别利用肿瘤坏死因子α、白细胞介素1β 和白细胞介素6 ELISA 检测试剂盒测定细胞外液中这3 种细胞因子的含量,同样在450 nm 处检测光吸收值。
1.3 统计分析
用 SPSS 17.0 软件对实验数据进行分析,实验组和对照组之间的差异使用t检验,P<0.05 时认定为差异显著。
2 结果
2.1 脂多糖对异体移植炎症因子分泌的影响
脂多糖是革兰氏阴性细菌细胞壁外壁的主要组成部分,能诱发宿主细胞的固有免疫,在细菌的识别、黏附、转移和致病过程中发挥重要作用。本实验中,经100 ng/mL 脂多糖刺激后,草鱼白细胞分泌的异体移植炎症因子1 极其显著升高(图1),提示异体移植炎症因子1 参与了病原菌感染引发的草鱼免疫应答。
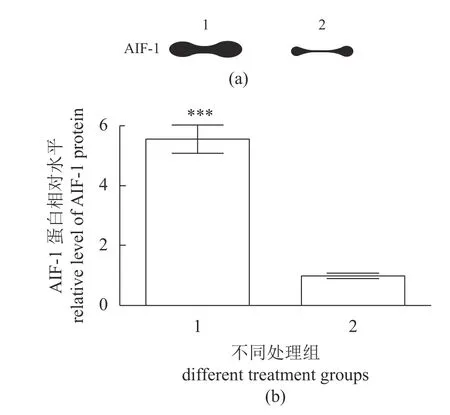
图1 草鱼异体移植炎症因子(AIF-1)的分泌(a) Western blot 影像,(b) AIF-1 蛋白相对水平;1.脂多糖,2.对照,***P<0.001;下同。Fig.1 The secretion of allograft inflammatory factor-1(AIF-1) in C.idella(a) Western blot image,(b) the relative level of AIF-1;1.LPS,2.control,***P<0.001;the same below.
2.2 细胞活力
为了探索草鱼异体移植炎症因子1 的分泌对白细胞的影响,本实验通过外加纯化的草鱼异体移植炎症因子1 重组蛋白后,检测白细胞的活力。结果显示,虽然0.1 nmol/L 异体移植炎症因子1并未明显增强白细胞,但1.0 nmol/L 和10.0 nmol/L异体移植炎症因子1 以浓度依赖的形式极其显著提高了白细胞活力(P<0.001)(图2)。
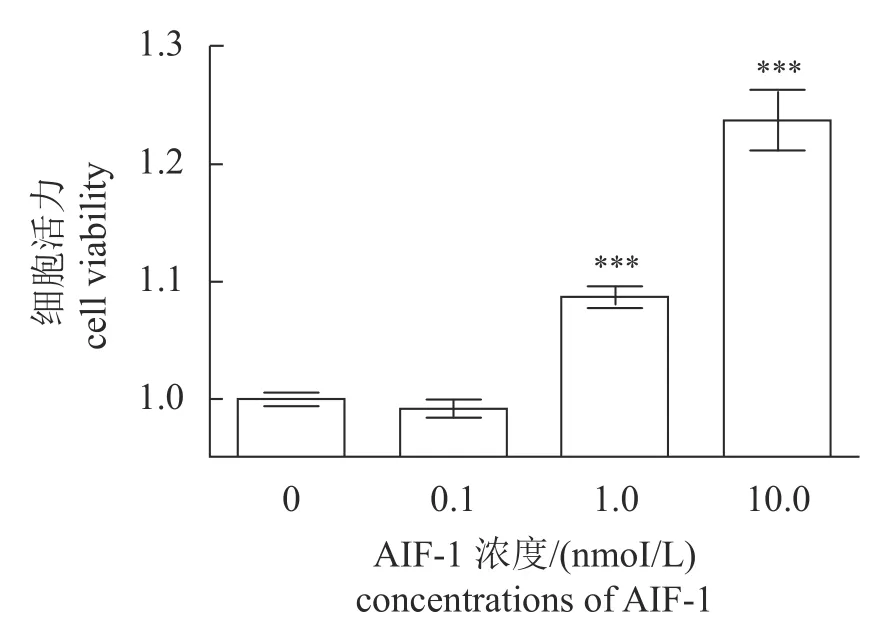
图2 草鱼白细胞活力Fig.2 Cell viability of C.idella leukocyte
2.3 细胞凋亡
细胞活力的降低很可能诱发细胞凋亡。因此,本实验检测了异体移植炎症因子1 的提高对白细胞凋亡的影响。结果显示,草鱼异体移植炎症因子1 在1.0 和10.0 nmol/L 时降低了白细胞的凋亡率,包括早期凋亡率和晚期凋亡率,尤其是10.0 nmol/L 异体移植炎症因子1 处理(图3)。

图3 草鱼白细胞凋亡(a) 对照,(b) 0.1 nmol/L AIF-1,(c) 1.0 nmol/L AIF-1,(d) 10.0 nmol/L AIF-1,(e) 异体移植炎症因子1 对白细胞凋亡的影响;(a)~(d).凋亡荧光图像;*P<0.05,***P<0.001。Fig.3 Cell apoptosis of C.idella leukocyte(a) control,(b) 0.1 nmol/L AIF-1,(c) 1.0 nmol/L AIF-1,(d) 10.0 nmol/L AIF-1,(e) effect of AIF-1 on leukocyte apoptosis;(a)-(d) fluorescent images;*P<0.05,***P<0.001.
2.4 线粒体活性
线粒体功能障碍是细胞凋亡的重要原因,为了进一步阐释异体移植炎症因子1 抑制草鱼白细胞凋亡的原因,本实验检测了异体移植炎症因子1 对白细胞线粒体功能的影响。结果显示,异体移植炎症因子1 改善了线粒体ATP 的产生(图4-a),这主要源于异体移植炎症因子1 增强了线粒体膜电位(图4-b)。

图4 线粒体功能(a) ATP 含量,(b) 线粒体膜电位(△Ψm);**P<0.01。Fig.4 Mitochondrial function(a) ATP content,(b) mitochondrial membrane potential;**P<0.01.
2.5 炎性介质的释放
在宿主免疫应答中,激活的白细胞将产生和释放多种炎性因子。本实验分别检测了异体移植炎症因子1 对常见炎性介质包括一氧化氮和活性氧产生以及炎性细胞因子肿瘤坏死因子α、白细胞介素1β 和白细胞介素6 的分泌。结果显示,异体移植炎症因子1 提高了一氧化氮(图5-a)和活性氧(图5-b)的产生,同时刺激了肿瘤坏死因子α(图6-a)、白细胞介素1β(图6-b)和白细胞介素6(图6-c)的分泌,提示异体移植炎症因子1 激活了草鱼外周血白细胞。
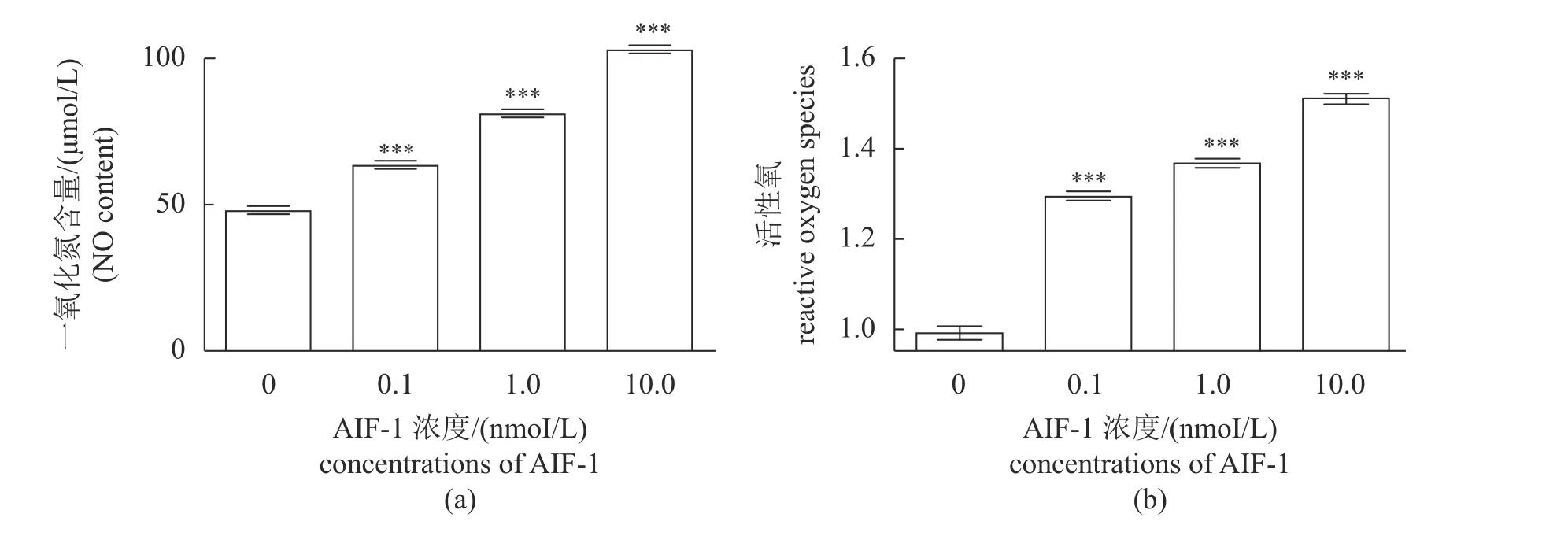
图5 一氧化氮和活性氧的产生(a) 一氧化氮水平,(b) 活性氧水平。Fig.5 Nitric oxide and reactive oxygen species production(a) nitric oxide,(b) reactive oxygen species.

图6 炎性细胞因子的分泌(a) 肿瘤坏死因子α,(b) 白细胞介素1β,(c) 白细胞介素6。Fig.6 Inflammatory cytokine secretion(a) tumor necrosis factor-alpha (TNF-α),(b) interleukin 1β (IL1β),(c) interleukin 6 (IL6).
3 讨论
水生生物先天免疫系统是其抵抗病原微生物感染的坚实屏障。如前所述,菲律宾蛤仔、近江牡蛎、鲍及海胆的异体移植炎症因子1 参与了病原菌、病毒和/或脂多糖刺激的免疫应答[10-14],但异体移植炎症因子1 在免疫应答激活过程中扮演的角色还不清楚。
研究显示,菲律宾蛤仔、鲍、近江牡蛎的异体移植炎症因子主要在血细胞表达[10-12],考虑到异体移植炎症因子1 是可分泌的细胞因子[1]。因此,本实验检测了脂多糖刺激后草鱼外周血白细胞异体移植炎症因子1 的释放,结果显示,脂多糖显著刺激了血细胞分泌的异体移植炎症因子1 水平,这一结果与其他小组发现的脂多糖诱导了近江牡蛎血细胞中异体移植炎症因子1 的表达[12]和海胆体腔细胞异体移植炎症因子1 的表达[13-14]结果相呼应,进一步说明异体移植炎症因子1 参与了革兰氏阴性细菌感染水生生物引发的免疫应答。
为了探查异体移植炎症因子1 的分泌上调在免疫激活中的作用,本实验检测了异体移植炎症因子1 对外周血白细胞增殖的影响。结果表明,异体移植炎症因子1 诱导了外周血白细胞的增殖,虽然在水生生物中还未发现相关的研究。但在小鼠(Mus musculus)巨噬细胞中的研究同样显示,削弱异体移植炎症因子1 的表达会抑制巨噬细胞的增殖,而重建异体移植炎症因子1 的表达则恢复了巨噬细胞的增殖[17]。因此,异体移植炎症因子1 对草鱼外周血细胞的增殖具有促进作用。
另一方面,本实验同时测量了外周血白细胞的凋亡。与增殖上调的结果相一致,异体移植炎症因子1 的添加抑制了草鱼外周血白细胞的凋亡,在大鼠中,干扰异体移植炎症因子1 的表达诱导了大鼠巨噬细胞的凋亡,而共转染其过表达质粒后,反转了干扰载体所诱导的细胞凋亡[18]。因此,异体移植炎症因子1 对于血液白细胞尤其是巨噬细胞的增殖是至关重要的。
线粒体是细胞内供给能量的细胞器,其对于细胞的存活不可或缺。线粒体的功能障碍直接导致了细胞凋亡。尤其是线粒体内膜的通透性增加,引发了线粒体膜电位降低(去极化),往往是细胞由存活走向凋亡的关键一步。在本研究中,草鱼异体移植炎症因子1 提高了线粒体ATP 的产量,这可能主要源于其对线粒体膜电位的维持,进而抑制了外周血细胞的凋亡。
免疫细胞在激活的过程中会产生多种炎性介质,这些炎性介质可杀灭病原菌,如一氧化氮和氧自由基。一氧化氮由一氧化氮合酶产生,它和氧自由基一起组成过氧化亚硝酸盐,过氧化亚硝酸盐可透过靶细胞细胞膜,扩散至细胞核,造成靶细胞DNA、蛋白质和脂质的硝化和氧化损伤[19]。本实验中草鱼异体移植炎症因子1 刺激了白细胞的一氧化氮和氧自由基的产生,提示其在白细胞杀灭病原菌的过程中发挥作用。这也与在大鼠中,异体移植炎症因子1 促进一氧化氮产生相一致[18]。而我们前期研究也显示,小鼠血液中异体移植炎症因子1 的提高引发了血液氧化应激[20]。
除了炎症介质以外,细胞因子是免疫细胞在杀灭病原体时释放的另一类小分子。细胞因子可以进一步诱发白细胞的增殖并促进其向病灶的迁移,也可消除病原体和异常细胞,而大量的炎性细胞因子则会引发“细胞因子风暴”,造成组织和器官损伤,甚至是个体的死亡。在本实验中,异体移植炎症因子1 显著诱发了炎性细胞因子包括肿瘤坏死因子α、白细胞介素1β 和白细胞介素6的分泌,而Zhang 等[21]也发现牡蛎异体移植炎症因子提高了肿瘤坏死因子、白介素17 和巨噬细胞迁移抑制因子的mRNA 水平。上述结果提示,异体移植炎症因子1 在免疫激活,尤其是“细胞因子风暴”中承担了一定的角色。
综上所述,本研究显示脂多糖诱导了草鱼外周血白细胞异体移植炎症因子1 的释放,过量的异体移植炎症因子1 刺激了白细胞的增殖,抑制了白细胞凋亡,这可能与线粒体功能的改善相关。同时异体移植炎症因子1 诱发了炎性介质一氧化氮、氧自由基及炎性细胞因子肿瘤坏死因子α、白细胞介素1β 和白细胞介素6 的分泌,提示异体移植炎症因子1 参与了草鱼外周血白细胞的激活。
(作者声明本文无实际或潜在的利益冲突)

