腥掷孢酵母17wy1 的分离、鉴定及对小麦白粉病防效初探
王俊美,李亚红,徐 飞,杨共强,冯超红,李好海,宋玉立
(1.河南省农业科学院 植物保护研究所/农业部华北南部作物有害生物综合治理重点实验室,河南 郑州 450002;2.河南省植物保护检疫站,河南 郑州 450002)
由布氏白粉菌(Blumeria graminisf.sp.tritici,Bgt)侵染引起的小麦白粉病在全球范围内普遍发生,是小麦生产上的主要病害之一,严重影响小麦的产量和品质。选用对小麦白粉病具有生防作用的微生物有望成为取代化学杀菌剂的一种有效方法[1-2]。拮抗酵母菌具有抗菌谱广、可以与化学杀菌剂联合使用、不产生对寄主和人有毒有害物质等优点,是一类理想的生防菌[3]。腥掷孢酵母是一种腐生酵母样担子菌,能够弹射孢子(称为掷孢子),通常附生在不同种类植物的叶片表面[4-5]。GOKHALE[6]将Tilletiopsis albescens和Tilletiopsis pallescens归到腥掷孢酵母属Tilletiopsis,WANG等[7]2015 年将腥掷孢酵母属属名Tilletiopsis变更为Golubevia,沿用至今。研究表明,腥掷孢酵母对白粉病具有生物控制活性[8]。国内外对于腥掷孢酵母的研究主要集中在对玫瑰、黄瓜、葡萄等高经济附加值作物病害的拮抗机制和控制方面[9-12]。小麦白粉病拮抗腥掷孢酵母菌的研究起步较晚,特别是直接从小麦上分离获得腥掷孢酵母菌并对其拮抗机制和病害控制进行研究的报道不多[13-14]。
笔者前期在室内培养小麦白粉菌的试验中观察到分生孢子有异常生长的现象,即菌落颜色呈现黄褐色、孢子散生且生长缓慢、孢子量消减且逐渐败落,推测可能是被某些具有拮抗作用的微生物寄生所致。因此,对这类拮抗微生物进行分离,并根据形态学特征和26S rDNA 序列分析确定其分类地位,同时,测定其发酵液对小麦白粉菌分生孢子萌发的抑制效果以及对室内盆栽、田间小麦白粉病的防治效果,利用定量PCR 解析其拮抗机制,为其在小麦白粉病防治中的应用提供理论依据。
1 材料和方法
1.1 供试材料
供试小麦白粉菌为本实验室保存的混合小麦白粉菌株;供试小麦材料为感白粉病品种津丰1号。
拮抗微生物分离采用PDA 培养基(马铃薯200 g/L、葡萄糖20 g/L、琼脂20 g/L、自然pH值,120 ℃灭菌30 min),拮抗微生物液体培养采用YPB 培养基(酵母膏10 g/L、蛋白胨20 g/L、葡萄糖20 g/L,自然pH值,120 ℃灭菌30 min)。
供试试剂:Omega DNA 提取试剂盒、Taq酶、dNTPs、Trizol 试剂、反转录试剂盒、荧光定量试剂等均购自宝生物工程(大连)有限公司。
1.2 拮抗微生物的分离纯化与分子生物学鉴定
用灭菌手术刀将生长异常的小麦白粉菌分生孢子小心刮下涂抹于PDA 固体培养基上,置于霉菌培养箱中25 ℃恒温培养,3~5 d 后挑取在培养皿盖上有映射的菌落部分并转接于PDA 培养基上进行纯化,重复2 次,收集培养物于PE 离心管中,提取DNA,进行PCR鉴定。
采用Omega 试剂盒提取DNA,利用26S rDNA D1/D2 区序列分析法进行分类鉴定。引物序列为NL1:5'-GCATATCAATAAGCGGAGGAAAAG-3' ;NL4:5'-GGTCCGTDTTTCAAGAACGG-3'[15]。 将PCR 产物直接送武汉奥科鼎盛生物科技有限公司进行测序,序列提交至GenBank 中心,获得登录号。通过BLAST 在线软件(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对分析并获得同源序列,根据试验菌株与已知酵母菌株相应序列的相似程度对试验菌株进行鉴定,并利用MEGA 7.0 软件构建系统进化树。将鉴定完毕、种类明确的分离菌株以PDA 试管斜面的方式接种培养,待菌落长出后,送中国微生物菌种保藏管理委员会普通微生物中心进行菌株保藏,获得菌株保藏号。
1.3 拮抗酵母菌对小麦白粉菌分生孢子萌发的抑制试验
将PDA 培养基上的拮抗酵母菌转接于YPB 液体培养基中,于180 r/min、25 ℃条件下摇培7 d,用灭菌的擦镜纸过滤,显微镜检测孢子浓度并稀释至5×107个/mL 备用。采用载玻片上涂布培养基的方法培养小麦白粉菌分生孢子,测定拮抗酵母菌发酵液对小麦白粉菌分生孢子萌发的影响。具体步骤如下:制作0.5%水琼脂培养基,用移液器取450 μL未冷凝的0.5%水琼脂和等体积的拮抗酵母菌发酵液在2 mL 离心管中混匀,均匀涂于载玻片上,设置孢子浓度为5×106、5×107个/mL 的拮抗酵母菌发酵液和CK(水琼脂培养基)3种处理,每处理重复3次。将新鲜的小麦白粉菌分生孢子均匀抖落在冷凝好的培养基上,之后将载玻片置于吸水纸保湿的塑料盒中,18 ℃培养箱中黑暗培养24 h,用普通光学显微镜观察并记录小麦白粉菌分生孢子的萌发情况,计算拮抗酵母菌发酵液对小麦白粉菌分生孢子的萌发抑制率。
孢子萌发抑制率=(对照萌发率-处理萌发率)/对照萌发率×100%。
1.4 拮抗酵母菌对小麦白粉病的盆栽防治试验
室内种植小麦盆苗,于两叶一心期采用抖落孢子法接种小麦白粉菌并置于光照培养箱中18 ℃条件下培养。待6~7 d 显症时,将孢子浓度为5×106、5×107个/mL 的拮抗酵母菌发酵液喷施于发病小麦叶片上,以清水作对照,7 d 后进行第2 次喷施。14 d 后调查不同处理盆苗中每株麦苗上部2 个发病严重叶片的发病情况,共调查3 个重复,每重复100片。记录病级并计算病情指数及防效。病级鉴定标准按照盛宝钦等[16]提出的反应级别进行分级。
病情指数=∑(病级数×该级病叶数)/(调查叶数×最高病级数)×100;
防治效果=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.5 拮抗酵母菌对小麦白粉病的田间防治试验
田间种植感病小麦品种津丰1 号,苗期在其周边栽种小麦白粉病显症麦苗。正常田间管理同,小麦整个生长期不喷施杀菌剂。孕穗至抽穗期,当感病品种充分发病时,在孢子浓度为5×107个/mL 的酵母菌发酵液中加入0.1% 吐温80 作为分散剂,喷施于发病小麦上,以喷施清水作对照,每处理1 m2,重复3 次。药后10 d 进行病害调查,每个重复5 点取样,每点选取30 株。按照GB/T 17980.22—2000《农药田间药效试验准则(一)杀菌剂防治禾谷类白粉病》的方法进行病级调查并计算病情指数及防效。
1.6 小麦病程相关蛋白基因表达的定量分析
采集1.4 中不同处理的小麦叶片,分别提取RNA,利用反转录试剂盒获得cDNA第一链,10倍稀释后于-20 ℃保存备用。根据小麦的病程相关蛋白PR1(抗菌蛋白)、PR2(β-1,3-葡聚糖酶)、PR5(类甜蛋白)和TaPAL(苯丙氨酸解氨酶)的基因序列信息合成引物[17-18],以小麦组成型表达基因18SrRNA(Accession No.AY049040)作为内参,引物序列见表1。荧光定量反应在伯乐CFX Connect 定量PCR仪上进行,反应体系:2×SYBR Premix ExTaq10 μL,上、下游引物(浓度为10 μmol/L)各1 μL,cDNA 模板5 μL,ddH2O 补 足 至20 μL。反 应 程 序:95 ℃30 s;95 ℃5 s,55 ℃退火34 s,72 ℃35 s,40个循环。反应结束后进行荧光值变化曲线和熔解曲线分析。每个样品设置3个技术重复,采用2-△△Ct法计算基因的相对表达量[19]。

表1 本研究所用引物Tab.1 Primers in this study
1.7 数据处理与分析
利用Excel 2010 和SPSS 18.0 对试验数据进行统计分析,所有试验数据采用平均值±标准误差表示,利用邓肯氏(Duncan’s)新复极差法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 拮抗微生物的分离纯化与鉴定
从异常生长的白粉菌孢子堆上获得一株真菌分离物,命名为17wy1,其菌落特征为乳白色或奶油色,光滑无皱褶,呈凸起状,表面湿润且具有光泽,边缘整齐;能弹射孢子于培养皿盖上并形成白色镜像,在显微镜下可观察到其投射的孢子为肾形或豆形,称之为掷孢子(图1a、1b)。将固体和液体培养物在普通光学显微镜下观察,可见其孢子为椭圆形,大小不等,同时具有明显的出芽生殖特征(图1c、1d)。

图1 拮抗微生物17wy1的菌落及显微形态Fig.1 Morphology and micromorphology of antagonistic microorganism 17wy1
分离物17wy1 的26S rDNA D1/D2 区序列GenBank 登录号为ON479429.1,运用在线BLAST 软件进行比对分析后选取同源序列,通过MEGA 7.0软件中的邻接法(Neighboor-joining,NJ)计算进化距离,构建17wy1 与其他15 个掷孢酵母菌的遗传进化树。结果(图2)显示,菌株17wy1 位于一个独立的进化小分支上,与来自腥掷孢酵母菌的5 个菌株(Golubevia pallescensCBS 369.85、Tilletiopsis pallescensM115、Golubevia pallescensGYDJ-G、GolubeviapallescensCBS 606.83、Tilletiopsis pallescensCBS 438.90)位于同一个大的进化分支,且序列相似性达95%以上,进化关系较近;与其他9个酵母菌位于不同进化分支上,进化关系较远。可见,17wy1是一种腥掷孢酵母菌(Golubevia albescens),且不同于目前已经报道的Golubevia pallescens,是一个新菌株。

图2 腥掷孢酵母菌17wy1 26S rDNA D1/D2区的同源进化分析Fig.2 Homology evolution analysis of 26S rDNA D1/D2 sequence of Golubevia albescens 17wy1
形态学特征和分子生物学鉴定结果表明,该菌为一种新的腥掷孢酵母菌。将菌株邮寄至中国微生物菌种保藏管理委员会普通微生物中心进行保藏,保藏号为CGMCC No:14148。
2.2 腥掷孢酵母菌17wy1对小麦白粉菌分生孢子萌发的抑制效果
由表2 和图3 可见,小麦白粉菌分生孢子在水琼脂培养基上的萌发率为93.4%;酵母菌发酵液处理后多数分生孢子萌发受到抑制,其中5×106个/mL酵母菌发酵液处理的孢子萌发率为30.1%,萌发抑制率为67.8%;5×107个/mL 酵母菌发酵液处理的孢子萌发率为13.9%,萌发抑制率为85.1%。
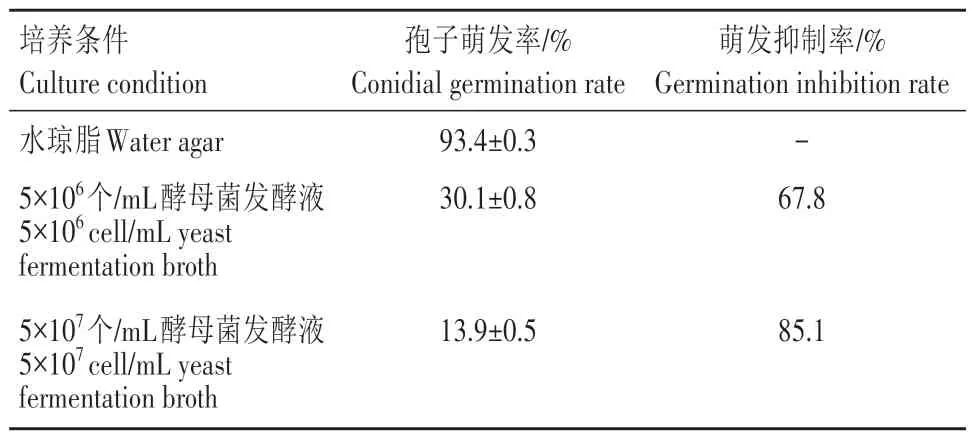
表2 腥掷孢酵母菌17wy1发酵液处理对小麦白粉菌孢子萌发抑制率Tab.2 Inhibition rate for conidium germination of Bgt treated with yeast 17wy1 fermentation broth
2.3 腥掷孢酵母菌17wy1对小麦白粉病的盆栽防治效果
室内盆栽试验结果表明,盆苗对照上小麦白粉菌生长旺盛,且随着病害加重麦苗逐渐枯萎死亡;喷施酵母菌发酵液的白粉菌生长被抑制,分生孢子堆明显消减,麦苗恢复生长(图4)。调查计算病情指数和防效,正常发病对照的病情指数为99.7,5×106个/mL 酵母菌发酵液处理的病情指数为57.4,防效为42.4%;5×107个/mL 酵母菌发酵液处理的病情指数为41.3,防效为58.5%。

图4 腥掷孢酵母菌17wy1对盆栽小麦白粉病的防治效果Fig.4 Control effect of yeast 17wy1 on wheat powdery mildew in pot
2.4 腥掷孢酵母菌17wy1对小麦白粉病的田间防治效果
由图5 可见,对照小麦叶片及叶鞘上白粉菌菌丝层较厚,形成连片病斑;喷施17wy1发酵液后白粉菌分生孢子数量明显减少,仅在小麦叶鞘边缘有少量稀薄的菌丝。田间正常发病植株病情指数高达88.33,喷施17wy1 发酵液的小麦植株病情指数仅为26.67,防效为69.8%。

图5 腥掷孢酵母菌17wy1对田间小麦白粉病的防治效果Fig.5 Control effect of yeast 17wy1 on wheat powdery mildew in field
2.5 小麦病程相关蛋白基因表达分析
小 麦 病 程 相 关 蛋 白 基 因PR1、PR2、PR5 和TaPAL的定量表达分析结果见图6,其中基因PR1、PR5在接种小麦白粉菌的小麦叶片中相对表达量均为0.99,17wy1 发酵液处理的接种叶片中相对表达量为543.10、30.61,表达量显著增强;基因PR2在接种小麦白粉菌的叶片中相对表达量为1.00,17wy1发酵液处理叶片相对表达量为0.09,表达量显著下降;基因TaPAL在接种白粉菌的叶片中相对表达量为0.99,用17wy1 发酵液处理后叶片中相对表达量为1.52。

图6 接种白粉菌后不同处理小麦叶片中防御相关基因的定量分析Fig.6 Quantitative analysis of defense-related genes in wheat leaves with different treatments after Bgt inoculation
3 结论与讨论
许多研究人员开展了小麦白粉病生防菌的筛选和鉴定等研究工作。伊艳杰等[20]从小麦茎叶组织中分离内生真菌,筛选出多个对小麦白粉菌分生孢子萌发抑制效果较好的菌株,其中2 株对小麦离体叶段和活体盆栽苗白粉病的防效达80%以上。曹远银等[21]从山西等5个省(市)的52份不同生态环境土样中分离筛选出一株对小麦白粉病有良好防效的链孢拟诺卡氏菌株。张晶等[22]从不同省份的土样中分离菌株,通过孢子萌发抑制试验和药效试验筛选出对小麦白粉病防效较好的放线菌菌株。李玲等[23]获得2 株对小麦白粉菌分生孢子萌发具有明显抑制作用的木霉菌,抑制率分别为90.06% 和85.95%,对盆栽麦苗白粉病的防效分别达68.63%、66.67%。这些研究表明,生防菌株在室内小麦白粉菌孢子萌发抑制试验、离体叶段和活体盆栽防治试验中对白粉菌有较好的拮抗效果。
RUSS 等[14]通过显微镜观察到被重寄生的小麦白粉菌分生孢子上有酵母菌菌丝长出,2 种酵母菌对白粉菌的寄生率分别为26%(菌株BC0812)和16.1%(菌株BC0850)。KÖHL 等[13]筛选出对小麦白粉病有拮抗作用的腥掷孢酵母菌菌株BC0441 和BC0850,可使田间盆栽麦苗期叶片的白粉菌孢子量减少30%~62%。本研究从异常生长的小麦白粉菌分生孢子上分离获得一株腥掷孢酵母17wy1,其发酵液对分生孢子萌发抑制率达85.1%,对室内盆栽麦苗白粉病的防效为58.5%,田间防效为69.8%。表明腥掷孢酵母菌对小麦白粉菌具有较好的拮抗作用。
RUSS等[14]根据转录组分析结果推测,腥掷孢酵母菌在与小麦白粉菌的互作过程中,可通过调节植物防御反应、清除H2O2来控制对自身的损害、兼性重寄生和氮竞争等作用,实现对病原菌的控制和自身的生理调节。本研究中,显症盆苗在酵母菌处理后小麦病程相关基因PR1上调表达,与RUSS 等[14]的结论一致,由于PR1 是系统获得抗性的标志性蛋白质,说明腥掷孢酵母菌17wy1 可通过介导小麦的获得抗性途径增强其对白粉病的抗性。PR2基因在本研究中呈下调表达,与RUSS 等[14]的结果不同,可能是由于小麦体内β-1,3-葡聚糖酶种类较多而不同研究中获得的基因种类不同。本研究中获得的PR5基因上调表达,与RUSS 等[14]的研究结果相反,是否不同腥掷孢酵母菌株启动的植物防御途径有差异,有待于进一步的试验验证。RUSS等[14]的研究结果表明,TaPAL基因在菌株BC0812处理的白粉菌接种叶片中被诱导上调表达,而在菌株BC0850 处理的接种叶片与对照叶片的表达量差异不明显。本研究中TaPAL基因在17wy1 处理后上调表达,但处理前后的表达值变化较小,是否不同菌株诱导的PAL基因的表达情况不同,仍需要进一步试验验证。
综上,本研究获得的腥掷孢酵母17wy1 对小麦白粉菌分生孢子的萌发有明显抑制作用,对室内盆苗和田间小麦白粉病具有较好的防治效果,其通过增强小麦体内抗病相关基因的表达提高小麦的抗病性,在小麦白粉病的防治中具有潜在应用价值,可进一步开发和利用。

